Пентакарбонилгидридомарганец - Википедия - Pentacarbonylhydridomanganese
 | |
 | |
| Имена | |
|---|---|
| Другие имена Пентакарбонилманганат (-I) водорода (7Cl); Марганец, пентакарбонилгидро- (8Cl); Пентакарбонил гидридомарганца; Гидридопентакарбонилмарганец; Пентакарбонилгидрид марганца; Пентакарбонилгидромарганец; Пентакарбонилмагидрид | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| HMn (CO)5 | |
| Молярная масса | 195,99799 г / моль |
| Внешность | При комнатной температуре он жидкий и бесцветный. Ниже его точки плавления он может быть сублимирован в вакууме.[1] |
| Кислотность (пKа) | 7.1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Пентакарбонилгидридомарганец является металлоорганическое соединение с формулой HMn (CO)5. Этот компаунд - один из самых стабильных «первого ряда». гидриды переходных металлов.
Подготовка
Впервые об этом сообщили в 1931 году.[2] Из нескольких способов производства этого соединения:[3] представляет собой протонирование пентакарбонилманганат-аниона. Последний образуется за счет уменьшения декарбонил диманганца, (Mn (CO)5)2. Реакция показана ниже.
- LiHB (C2ЧАС5)3 (Супергидрид ) + ½ Mn2(CO)10 → Li [Mn (CO)5] + ½ H2 + (C2ЧАС5)3B
- Ли [Mn (CO)5] + CF3ТАК3H → HMn (CO)5 + Ли+
CF3ТАК3−
Соли [Mn (CO)5]−
может быть выделен как кристаллический PPN+
(μ-нитридо-бис- (трифенилфосфор)) соль, которая плавно протонируется CF3ТАК3ЧАС.[3]
- PPN [Mn (CO)5] + CF3ТАК3H → HMn (CO)5 + PPN+
CF3ТАК3−
Это соединение также может быть образовано реакцией раствора пентакарбонил (триметилсилил) марганца с водой.[4] Реакция показана ниже.
- 2 (СО)5MnSiMe3 + H2O → HMn (CO)5 + Я3SiOSiMe3
Структура и свойства
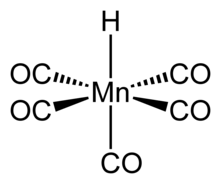
Соединение имеет октаэдрическую симметрию. [5] и это молекулярная точечная группа это C4в.[6] H-Mn длина облигации составляет 1,44 ± 0,03 Å.[6] Эти данные подтверждаются исследованиями дифракции электронов в газовой фазе.
Структура HMn (CO)5 был изучен многими методами, в том числе дифракция рентгеновских лучей, нейтронография, и электронная дифракция.[6] HMn (CO)5 может быть связано со структурой гексакарбонильного комплекса, такого как Mn (CO)+
6, и поэтому обладает следующими аналогичными свойствами.[7] Оккупированный молекулярные орбитали наверху 2 т2 г орбитали. Они характеризуются как металлические 3dπ орбитали. Поскольку разрыхляющие 2π-орбитали взаимодействуют с карбонильными группами (или в данном случае ЧАС−
) т2 г орбиталь стабилизирована по сравнению с 3dπ orbital, что, в свою очередь, вызовет изменения в сигма- и пи-взаимодействиях.
Основные реакции
В pKа HMn (CO)5 в воде - 7,1.[8] Таким образом, это сопоставимо с сероводород, обычная неорганическая кислота, по ее кислотности.
Обычная реакция с участием HMn (CO)5 видов представляет собой замену лигандов CO на органофосфины, что происходит как термически, так и фотохимически.[9] Таким образом, следующие производные образуют MnH (CO)3п2, MnH (CO)2п3, а MnH (CO) P4, (где P = P (OEt)3, PPh (OEt)2, PPh2OEt, PPh (OiPr)2).
Соединение HMn (CO)5 может использоваться для уменьшения олефины и другие органические соединения, а также галогениды металлов.[3]
Это соединение может быть метилировано диазометан.[1]
- HMn (CO)5 + CH2N2 → Mn (CO)5CH3 + N2
Примечания
- ^ а б Eley, D.D .; Сосны, Герман; Вайс, П. Достижения в катализе. 32. 385. ISBN 978-0-12-007832-5
- ^ Хибер, В. Лейтерт, Ф. Naturwissenschaften. 1931. 360.
- ^ а б c Хантер, Алан Д; Бьянкони, Ларри Дж; DiMuzio, Стивен Дж; Брахо, Дайан Л. Синтез и взаимосвязь между структурой и свойствами в химии η6-арена) Cr (CO) 3: от управляемых экспериментов к открытому исследованию. J. Chem. Educ. 75. 1998. 891. Дои:10.1021 / ed075p891
- ^ Финн, М. Пентакарбонил (триметилсилил) марганец. Энциклопедия реагентов для органического синтеза. Дои:10.1002 / 047084289X.rp022s
- ^ Лю, Сянь-мэй; Ван, Чао-янь; Цянь-шу; Се; Yaoming; Кинг, Р. Брюс; Шефер, Генри Ф., III. Одноядерные и биядерные карбонилгидриды марганца. Dalton Trans., 2009, 3774-3785, Дои:10.1039 / b822913a
- ^ а б c Куколич С.Г. Микроволновый спектр и молекулярная структура пентакарбонилгидрида марганца. 33. 1994. 1217-1219.
- ^ Фенске, Ричард. Электронная структура и связь в пентакарбонилгалогенидах и гидриде марганца. Неорганическая химия. 9. 1970. 1053-1060.
- ^ Моррис, Роберт Х. (10 августа 2016 г.). "Кислотная сила Бренстеда – Лоури металлогидридных и дигидрогеновых комплексов". Химические обзоры. 116 (15): 8588–8654. Дои:10.1021 / acs.chemrev.5b00695. HDL:1807/78047. ISSN 0009-2665. PMID 26963836.
- ^ Альбертин, Габриэле. Катионные молекулярно-водородные комплексы Mn (I). Металлоорганические соединения. 16. 1997. 4959-4969.
