Фосфорная кислота - Phosphorus acid
Оксокислота фосфора это общее название для любого кислота чей молекула состоит из атомов фосфор, кислород, и водород.[1] Таких соединений потенциально бесконечно много. Некоторые из них нестабильны и не изолированы, но производные анионы и органический группы присутствуют в конюшне соли и сложные эфиры. Наиболее важными из них - в биологии, геологии, промышленности и химических исследованиях - являются фосфорные кислоты, сложные эфиры и соли которого являются фосфаты.
В общем, любой атом водорода, связанный с атомом кислорода, является кислотным, что означает, что группа –OH может потерять протон. ЧАС+
оставляя отрицательно заряженный -О−
группы и, таким образом, превращая кислоту в оксоанион фосфора. Каждому дополнительному потерянному протону соответствует константа диссоциации кислоты Kа1, Ка2 Kа3, ..., часто выражается одеколон (pKа1, pKа2, pKа3, ...). Атомы водорода, непосредственно связанные с фосфором, обычно не являются кислотными.
Классификация
Оксокислоты фосфора можно классифицировать по степень окисления (s) атома (ов) фосфора, который может варьироваться от +1 до +5. Атомы кислорода обычно находятся в степени окисления -2, но могут находиться в состоянии -1, если молекула включает пероксидные группы.
Степень окисления +1
- Гипофосфор или фосфиновая кислота, ЧАС
3PO
2 (или же ЧАС
2ПО (ОН)), а монопротовая кислота (это означает, что только один из атомов водорода является кислым). Его соли и сложные эфиры называются гипофосфиты или фосфиниты.
Степень окисления +3
- Фосфор или фосфоновая кислота, ЧАС
3PO
3 (или же HPO (ОН)
2), а дипротоновая кислота (только с двумя кислыми атомами водорода). Его соли и сложные эфиры называются фосфиты или фосфонаты.
Степень окисления +4
- Гипофосфорная кислота, ЧАС
4п
2О
6 (или же (HO)
2п–Р (ОН)
2). Все четыре атома водорода кислые. Его соли и сложные эфиры гипофосфаты.
Степень окисления +5
Наиболее важные члены этой группы - это фосфорные кислоты, где каждый атом фосфора связанный к четырем атомам кислорода, один из них через двойная связь, расположенные как углы тетраэдр. Два или более из них PO
4 тетраэдры могут быть соединены общими атомами кислорода с одинарными связями, образуя линейные или разветвленные цепи, циклы или более сложные структуры. Односвязные атомы кислорода, которые не являются общими, дополняются кислыми атомами водорода. Их общая формула Hп−Икс+2ппО3п−Икс+1, куда п - количество атомов фосфора и Икс это количество фундаментальные циклы в структуре молекулы.
Эти кислоты, их сложные эфиры и соли ("фосфаты ") включают некоторые из самых известных и наиболее важных соединений фосфора.
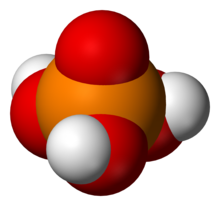
3PO
4.
Самый простой член этого класса -
- Фосфорная кислота правильный, также называемый ортофосфорный или монофосфорный кислота, ЧАС
3PO
4 (или же ОП (ОН)
3), трипротонная кислота. Он образует ортофосфатную соль и сложные эфиры, обычно называемые фосфаты.
Наименьшие соединения этого класса с двумя или более атомами фосфора называются «олигофосфорными кислотами», а более крупные соединения с линейными -P-O- скелетами - «полифосфорными кислотами»; без определенного разделения между ними. Некоторые из наиболее важных участников:
- Пирофосфорная кислота, ЧАС
4п
2О
7 (или же (HO)
2п–O–Р (ОН)
2), с четырьмя кислыми атомами водорода. Формы пирофосфаты. - Трифосфорный или триполифосфорный кислота, ЧАС
5п
3О
10 (или же (HO)
2п–O–Р (ОН)–O–Р (ОН)
2), с пятью кислыми атомами водорода. Формы трифосфаты или триполифосфаты. - Тетрафосфорная кислота, ЧАС
6п
4О
13 (или же (HO)
2п(–O–Р (ОН))2–O–Р (ОН)
2), с шестью кислыми атомами водорода. Формы тетрафосфаты.
Позвоночник может быть разветвленным, как в
- трифосфонофосфорная кислота, ЧАС
6п
4О
13 или P (O) (-ОП (О) (ОН)
2)3, разветвленный изомер тетраполифосфорной кислоты.
В PO
4 тетраэдры могут быть соединены в замкнутые цепи –P – O–, как в
- Триметафосфорный, или же циклотрифосфорный кислота, ЧАС
3п
3О
9 (или же (HPO
3)
3, (–P (O) (OH) –O–)3), циклическая молекула с тремя кислыми атомами водорода. Образует триметафосфат соли и сложные эфиры.
Метафосфорная кислота общий термин для фосфорных кислот с одним циклом, (–P (O) (OH) –O–)п, чей элементарная формула является HPO
3.
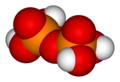
Пирофосфорная кислота
ЧАС
4п
2О
7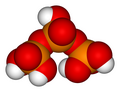
Триполифосфорная кислота
ЧАС
5п
3О
10
Тетраполифосфорная кислота
ЧАС6п4О13
Триметафосфорная кислота
ЧАС
3п
3О
9
Еще одно соединение, которое может быть включено в этот класс:
- Пероксомонофосфорная кислота, H3PO5 (или OP (OH)2(OOH)), которую можно рассматривать как монофосфорную кислоту с перекись группа, замещающая атом кислорода в одном из гидроксил группы
Смешанные состояния окисления
Некоторые оксикислоты фосфора имеют два или более атома P в разных степенях окисления. Одним из примеров является
- Изогипофосфорная кислота, ЧАС
4п
2О
6 (или H (OH) (O) P − O − P (O) (OH)2), тетрапротонная кислота и изомер гипофосфорной кислоты, содержащие P в степени окисления +3 и +5

п4О10

Смотрите также
дальнейшее чтение
- Шредер Х.С., Курц Л., Мюллер В.Е., Лоренц Б. (март 2000 г.). «Полифосфат в кости» (PDF). Биохимия (Москва). 65 (3): 296–303. Архивировано из оригинал (PDF) на 2011-08-25.
внешняя ссылка
- Определение полифосфатов с использованием ионной хроматографии с обнаружением подавленной проводимости, инструкция по применению 71 от Dionex
- США 3044851
- Фосфор + кислоты в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
Рекомендации
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
| | Этот статья включает список связанных элементов с одинаковыми именами (или похожими именами). Если внутренняя ссылка неправильно привел вас сюда, вы можете изменить ссылку, чтобы она указывала прямо на предполагаемую статью. |




