Пирамидный карбокатион - Pyramidal carbocation
Эта статья может быть слишком техническим для большинства читателей, чтобы понять. Пожалуйста помогите улучшить это к сделать понятным для неспециалистов, не снимая технических деталей. (Февраль 2017 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |

А пирамидный карбокатион это тип карбокатион с определенной конфигурацией. Этот ион существует как третий класс, помимо классических и неклассические ионы. В этих ионах одиночный атом углерода парит над четырех- или пятисторонним многоугольник, фактически формируя пирамида. Ион с четырехсторонней пирамидой будет нести заряд 1+, а пятисторонняя пирамида будет нести заряд 2+. На изображениях (вверху справа), черная точка на вертикальной линии представляет парящий атом углерода.
Кажущееся координационное число пять или даже шесть, связанное с атомом углерода на вершине пирамиды, является редкостью по сравнению с обычным максимумом, равным четырем.
История
В то время изучение этих катионов дало удивительные результаты в вычислительная химия. При расчете оптимальной геометрии монокатиона, возникающего при извлечении хлорида из 3-хлортрицикло [2.1.0.02,5] пентан, три моста должны были ориентироваться в пространстве под углами примерно 120 °. Однако расчеты показали, что четырехгранная пирамида является наиболее устойчивой конфигурацией. На вершине этой пирамиды находится атом углерода, все еще связанный с водородом. Первоначальная ожидаемая структура оказалась даже не близкой к минимуму энергии: она представляла максимум.[1]
- Рисунок 1: Несколько возможностей для (CH)5 катион.

- 1а Исходная ситуация в расчетах: только что ушел хлорид-ион.
- 1b ожидаемая структура. Заряд был делокализован по трем атомам углерода.
- 1c представление пирамидального иона.
В зависимости от используемого метода ионная 1c на рисунке 1 - абсолютный или просто относительный минимум.
Теоретические основы
Полное теоретическое обсуждение будет использовать все орбитали всех участвующих атомов. В первом приближении можно использовать ЛКАО из молекулярные орбитали в многоугольник образуя основу пирамиды и орбитали на апикальный атом, как атом углерода на вершине пирамиды. Это приближение даст представление о внутренней устойчивости структур.
Апикальный атом углерода
В апикальный атом углерода связан только друг с другом заместитель, так что sp-гибридизация следовало ожидать. Заместитель будет ориентирован вверх. К основному многоугольнику доступны три орбитали:
- Второй зр-орбиталь. Эта орбиталь имеет относительно низкую энергию из-за вклада s-орбитали. Относительно узловых плоскостей остальных p-орбиталей симметрию этой орбитали можно записать как SИксSy,[2] симметричный относительно обеих плоскостей. Орбиталь имеет довольно низкую энергию с точки зрения Метод Хюккеля его значение оценить непросто, хотя оно будет меньше α, поскольку орбиталь будет иметь значительный s-характер.
- Две p-орбитали. Эти орбитали имеют более высокое энергосодержание, чем sp-орбитали. В терминах метода Хюккеля энергия будет α. С точки зрения симметрии эти орбитали равны ортогональный, описан как АИксSy и SИксАy[2]
Основание пирамиды
| Фигура 2: Орбитали апикального атома углерода (вверху) и МО основания (внизу)[2] |
 |
| Рисунок 3: Взаимодействие апикальной и базальной орбиталей. Буква «A» наверху обозначает вершинный углерод, «P» обозначает пирамидальную структуру, «B» обозначает базальную часть пирамиды. |
 |
Аппроксимация основания пирамиды - замкнутое кольцо атомов углерода, все они sp2 гибридизированный. Точные результаты зависят от размера кольца; общие выводы можно сформулировать так:
- На самой нижней молекулярной орбитали, наблюдаемой с вершины пирамиды, нет узловых плоскостей. Симметрия будет SИксSy.[2] В методе Хюккеля его энергия равна (α - 2β)
- Следующий уровень энергии заняты двумя вырожденными орбиталями. В терминах симметрии они записываются как SИксАy и АИксSy.[2] Энергия зависит от размера кольца:
| размер кольца | уровень энергии |
|---|---|
| 3 | (α + β) |
| 4 | α |
| 5 | (α - 0,618 β) |
| 6 | (α - β) |
- В зависимости от размера базы будут и другие МО, но они не имеют отношения к настоящему обсуждению.
Взаимодействие между вершиной и основанием
Для получения связывающих взаимодействий между атомами или частями молекул должны быть выполнены два условия:
- Объединяемые орбитали должны иметь одинаковую симметрию.
- Меньшая разница в энергии между объединяющимися орбиталями даст больший стабилизирующий эффект.
Орбитали апикального углерода и основного многоугольника могут объединяться в соответствии с их симметрией. Результатом будет более стабильная конфигурация пирамид. На рисунке 2 изображены аспекты симметрии.
- Апикальная sp-орбиталь сочетается с самой низкой MO основного кольца с низкой связью и высокой анти-связующей орбиталью.
- Две апикальные p-орбитали объединяются со вторыми по величине энергетическими уровнями основного кольца. В результате получаются две связывающие и две анти-связывающие орбитали. Рисунок 3 представляет собой графическое представление результатов.
Заполнение атомных и молекулярных орбиталей в пирамидальных структурах с разным размером основания приводит к следующей таблице. Учитываются только связывающие орбитали.
| п = 3 (тригональный) | п = 4 (квадрат) | п = 5 (пятиугольный) | п = 6 (шестиугольный) | |||||
|---|---|---|---|---|---|---|---|---|
| орбитали | обвинять | орбитали | обвинять | орбитали | обвинять | орбитали | обвинять | |
| 1с орбитали на углероде | 4 | −8 | 5 | −10 | 6 | −12 | 7 | −14 |
| связь σ между водородом и апикальным углеродом | 1 | −2 | 1 | −2 | 1 | −2 | 1 | −2 |
| σ связь между водородом и основным углеродом | 3 | –6 | 4 | –8 | 5 | 10 | 6 | –12 |
| σ связь между основными атомами углерода | 3 | –6 | 4 | –8 | 5 | –10 | 6 | –12 |
| соединение МО между апикальной и нижней основной орбиталью | 1 | –2 | 1 | –2 | 1 | –2 | 1 | –2 |
| соединение МО между апикальной и второй по низшей основной орбиталями | 2 | –4 | 2 | –4 | 2 | –4 | 2 | –4 |
| общее количество электронов | –28 | –34 | –40 | –46 | ||||
| общий заряд ядра: (n + 1) * (C + H) = (n + 1) * (6 + 1) | +28 | +35 | +42 | +49 | ||||
| Чистая плата за структуру | 0 | 1+ | 2+ | 3+ | ||||
В случае трехсторонней пирамиды никаких ионов явно не наблюдается; возникает известный нейтральный вид: тетраэдран. Для этой молекулы такой способ описания является альтернативой. квантово-механическое описание.
Остальные пирамидальные конструкции будут заряжены в соответствии с их базовым размером.
Примеры
Монокация
- Рисунок 4: Ряд производных трикло [3,1,0,02,4] пентан (TCP), приводящий к тому же пирамидальному катиону. Атом углерода, несущий уходящая группа становится основным, а углерод на анти положение становится апикальным.
Группа «R» либо 1H или 2H (D ):

4а:
3-гидрокси-1,4-диметил-TCP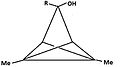
4b:
3-гидрокси-1,5-диметил-TCP
4c:
3-метокси-3,5-диметил-TCP
4d:
полученный карбокатион
В 1972 году Масамунэ описывает результаты растворения ряда предшественников 4d (рисунок 4) при - 70 ° С. в суперкислотный (смесь SO2ClF и FSO3ЧАС). На основе как 13C, а также 1Спектр H-ЯМР очевиден: в каждом случае образуется один и тот же посредник. Кроме того, при разрушении сверхкислой среды либо метанол или же бензойная кислота, образуется такой же продукт. (видеть: Реакция ... ниже).[3]
| группа / атом ( !) | 13C | 1ЧАС | |
|---|---|---|---|
| 1 | 93.56 | - |  |
| 2 / 4 | 73.00 | 4.62 | |
| 3 (если R = 1ЧАС) | 60.97 | 4.68 | |
| 5 | -23.04 | - | |
| Метил на 1 | 7.45 | 2.15 | |
| Метил на 5 | -1.03 | 1.84 | |
| ( !) В этой таблице атомы углерода названы, в 1H-ЯМР сигнал водорода, переносимого названными атомами углерода, изображен | |||
- Распределение в спектре водорода частично связано с интенсивностью (водороды в основном кольце), частично с обычным опытом: водород на внешней стороне круговой сопряженной системы имеет сигналы с более высокими миллионными долями по сравнению с ТМС, тогда как сигналы, расположенные над кольцом, будут иметь более низкие даже отрицательные, сигналы относительно TMS.
- Присвоение в 13C-ЯМР следуют тем же соображениям, что и для 1H. Хотя интенсивность углеродного ЯМР является плохим ориентиром для количества атомов, в основном кольце незамещенные атомы углерода достаточно похожи, чтобы использовать интенсивность в качестве показателя их количества. Мощным инструментом также является множественность углеродного сигнала из-за связи с атомами водорода, связанными с углеродом.
- Сам Масамунэ ничего не говорит о природе промежуточного иона.[5] Тем не менее, исходя из правил, сформулированных Олахом,[6] он может исключить локализованные катионы (например, 1-бутил) или делокализованные (например, аллил). Ожидаемые сигналы для этих ионов составляют около 200 ppm.
Реакция с метанолом и бензойной кислотой
- Фигура 5: Продукты реакции диметилпирамидного катиона с метанолом и бензойной кислотой.
"R" -группа либо1H или 2H (D ):
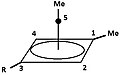
5а = 4d
Пирамидный катион
5b
Продукт реакции с бензойной кислотой
в диплоар апротонном растворителе
5c
продукт реакции с метанолом
в метаноле
Как описано выше, независимо от пути его синтеза пирамидный ион 5а реагирует с метанолом или бензоатом, давая продукты, регулируемые реагентом и реакционной средой, что ясно из схем замещения. В 1972 году Масамунэ [3][4] не может объяснить различное поведение промежуточного звена. В терминах теории HSAB можно дать объяснение.
В 1975 году Масамунэ рассчитал[7] в незамещенном ионе большая часть заряда приходится на атомы водорода. Замена водорода на углерод, центральный атом метильной группы, более электроотрицательный заместитель (2,5 против 2,1 по шкале Полинга) будет концентрировать заряд на углероде скелета. Эта концентрация заряда имеет несколько эффектов:
- Реакция с бензоатом регулируется π - π взаимодействиями. Вырождение основной МО-системы будет потеряно. Поскольку апикальная сторона недоступна, бензоат будет подходить с нижней стороны пирамиды. Взаимодействие между двумя π-системами, обе нарушенные в одной точке, вызовет определенную ориентацию. Ориентация, при которой взаимодействие между положительным зарядом, генерируемым метильной группой на пирамиде, и зарядом, прилегающим к карбоксильной группе, будет направлять систему в реакцию карбоксильной группы с углеродом 2 или 4 основания пирамиды. Когда реакция с бензоатом происходит на углероде 2, мостики образуются между апикальным углеродом и атомами 1 и 3. Связь также образуется между анти-углерод 4 и верхушка. Реакция на углероде 4 будет иметь такой же эффект, хотя полученная молекула имеет зеркальное отношение по отношению к молекуле, которая возникает в результате реакции в положении 2.
- Реакция с метанолом носит управляемый характер. В базовой системе идентифицируемый центр положительного заряда присутствует на атоме углерода, несущем метильную группу. Метанол с его твердая база в кислороде, будет реагировать в центре положительности. Метокси-группа появляется у углерода 1, заставляя мосты образовываться между углеродом 2 и 4 до вершины, а также между анти-углерод 3.
Бишомомонокарбокация
В химии приставка «гомо-» обозначает гомолог, аналогичным образом соединение, содержащее один или, как в данном случае, два дополнительных CH2-группы. Общим аспектом бишомо-ионов является наличие 1,4-циклогексадиен кольцо вместо циклобутадиен один.

Мосты между гомоатомами бисомокарбокатиона
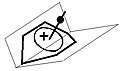
Самолеты, содержащие зр2 гибридные атомы и атомы, связанные с ними
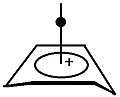
Мосты бисомо-карбокатион
Стабильность этого иона сначала может показаться странной, поскольку увеличение кольца в целом уменьшит перекрытие связей между орбиталями в центре пирамидальной структуры. Здесь зр2 гибридизация, и, следовательно, планарность атомов и атомов, непосредственно связанных с sp2 центров, заставляет вершины p-орбиталей базальных углеродов сближаться друг с другом, создавая тем самым прочную основу для размещения апикального углерода. Усиление конфигурации перемычкой между гомоатомами, преобразование основания пирамиды в норборнадиен, создает еще более устойчивую структуру.
Дикция
Согласно результатам, представленным в таблице 1, пятигранный пирамидальный карбокатион будет двухвалентным. Это подтверждается теоретическими[8] и практическая работа Хогевена.[9][10] В отличие от монокатиона, который описывается несколькими схемами замещения, дикатион в основном изучается с помощью его гексаметильного производного. Синтез начинается в гексаметил Дьюара бензол (сложный я в таблице 4) реагируя с Cl2 в 5,6-дихлор-1,2,3,4,5,6-гексаметилбицикло [2.1.1] гекс-2-ен (соединение II в таблице 4). Растворение этого соединения в фторсульфоновая кислота дает начало диконату (структура III в таблице 4).
 |  |  |
| Я: Мне6-Бензол Дьюара | II: Продукт реакции Меня6 Бензол Дьюара с хлором | III: пирамидная дикция |
О наличии пирамидного иона в растворе фторсульфоновой кислоты свидетельствует 1Рука 13C-ЯМР-спектр (таблица 5).
| Интенсивность | 1ЧАС | 13CСингулет | 13CКвартет |
|---|---|---|---|
| 1 | 1,96 (т) | 22,5 | - 2.0 |
| 5 | 2,65 (т) | 126,3 | 10,6 |
Назначение сигналов основано на их интенсивности и множественности. Определение пирамидальной структуры основано на наблюдаемой простоте спектров: пять равных C-CH3 группы, объединенные с одним выдающимся C-CH3 группа. Единственный способ построить молекулярную сущность из этих данных - это пятигранная пирамида. Быстрые равновесия между вырожденными классическими или неклассическими карбокатионами отбрасываются, так как положение сигналов не соответствует ожидаемым значениям для таких структур.[8]
Кристаллическая структура [C6(CH3)6]2+ (SbF6−)2 • HSO3F был получен в 2017 году. Хотя апикальный атом углерода гексакоординирован, правило четырехвалентности углерода все же выполняется. В то время как C-CH3 длина связи 1,479 (3) Å типична для одинарной связи C-C, остальные пять очень длинных расстояний C-C 1,694 (2) -1,715 (3) Å указывают на порядок связи <1.[11]
Реакции дикика
| Рисунок 6: Реакции пирамидального карбодикации. |
|---|
 |
|
Реакции дикикации распадаются на три группы:[9][10]
- Термические реакции Гексаметилзамещенный дикатион представляет собой стабильную структуру до 40 ° C (104 ° F). Выше этой температуры происходит реакция: гидрид -ion берется, после чего следует необратимая перестановка в Комплекс Мейзенхаймера который стабилен в среде фторсульфоновой кислоты (см. рис. 6, верхняя реакция).
- Заряженные нуклеофилы (гидрид, метоксид, гидроксид) реагируют обратимо, приводя, независимо от нуклеофила, к идентичному 2,4-замещенному трицикло [3.1.0.03,6] гексановые производные, например: с метоксидом: 2,4-диметокситрицикло [3.1.0.03,6] гексан образуется (см. рис. 6, средний путь реакции).
- Незаряженные нуклеофилы (амины подобно триэтиламин ) действуют как основание, обратимо извлекая два атома водорода из иона, в результате образуя диметиленовое производное бензвален (см .: рис. 6, нижняя реакция).
Другие схемы замещения в дикатонах
Продукт реакции дикатиона с триэтиламин предлагает путь к другим моделям замещения, кроме гексаметила.[12] Одна или обе двойные связи окисляются до кетона. Затем кетон реагирует с металлоорганическое соединение получение алкилированного гидроксида. Образованные таким образом соединения содержат одну или две другие алкильные группы, в зависимости от количества окисленных двойных связей. Когда спирты растворяются в фторсульфоновая кислота, они снова порождают новые пирамидные препараты. Обе неметильные группы занимают базальные позиции. Каждая другая позиция в пирамидальном скелете по-прежнему несет метильную группу. Таблица 6 суммирует эти результаты.
 |  |  |  |  |
| Я: Продукт реакции с Et3N | II: Монокетон | III: алкилированный моноспирт | IV: Пирамидный ион при первом растворении в ФСО3ЧАС | V: Пирамидный катион при вторичном растворении в ФСО3ЧАС |
 |  |  |  | |
| II: Дикетон | III: алкилированный диол | IV: Пирамидный ион при первом растворении в ФСО3ЧАС | V: Пирамидный катион при вторичном растворении в ФСО3ЧАС |
До этого момента схема замещения двухвалентного пирамидного иона не имеет большого значения для его поведения. Четкая разница возникает, когда термостабильность, если ионы типа V (Таблица 6) изучается: при -40 ° C (-40 ° F) апикальный этилзамещенный ион стабилен в течение 48 часов, в то время как апикальный iso-пропиловый ион больше не обнаруживается.
Трехвалентные и высшие ионы
Во время обзора литературы (конец 1978 г.) не было сообщений о трехвалентных или более высоких пирамидных катионах.
Примечания и ссылки
- ^ Stohrer, W.D .; Хоффманн, Р. (1972). «Изомерия растяжения связей и политопальные перегруппировки в (CH) 5+, (CH) 5- и (CH) 4CO». Варенье. Chem. Soc. 94 (5): 1661–1668. Дои:10.1021 / ja00760a039.
- ^ а б c d е S обозначает, что орбиталь симметрична относительно плоскости, обозначенной нижним индексом. An А описывает антисимметрию относительно указанной нижним индексом плоскости.
- ^ а б Masamune, S .; Sakai, M .; Она, Х. (1972). "Природа (CH)5+ разновидность. I. Сольволиз 1,5-диметилтрицикло [2.1.0.02,5] пент-3-илбензоат ». Варенье. Chem. Soc. 94 (25): 8955–8956. Дои:10.1021 / ja00780a078.
- ^ а б S. Masamune, S .; Sakai, M .; Ona, H .; Джонс, А.Дж. (1972). "Природа (CH)5+ разновидность. II. Прямое наблюдение иона карбония производных 3-гидроксигомотетраэдрана ». Варенье. Chem. Soc. 94 (25): 8956. Дои:10.1021 / ja00780a079.
- ^ Хотя Масамунэ представляет свои практические результаты позже в том же году, что и Штёрер и Хоффманн - свои теоретические, маловероятно, что Масамунэ смог отредактировать свою статью в тот момент, когда значение теоретической работы стало ясным.
- ^ Olah, G.A .; Донован, Д.Дж .; Пракаш, Г. (1978). «Катион α, 1-диметилциклопропилкарбинила». Буквы Тетраэдра. 19 (48): 4779–4782. Дои:10.1016 / s0040-4039 (01) 85729-4.
- ^ Масамунэ, С. (1975). «Некоторые аспекты напряженных систем. [4] Аннулен и его аддукт CH +». Чистая и прикладная химия. 44 (4): 861–884. Дои:10.1351 / pac197544040861.
- ^ а б Hogeveen, H .; Kwant, P.W .; Postma, J .; van Duynen, P. Th. (1974). «Электронные спектры пирамидальных дикатионов, (CCH3)62+ и (CCH)62+". Буквы Тетраэдра. 15 (49–50): 4351–4354. Дои:10.1016 / S0040-4039 (01) 92161-6.
- ^ а б Hogeveen, H .; Квант, П. В. (1974). «Химия и спектроскопия в сильнокислых растворах. XL. (CCH3)62+, необычный диктофон ». Журнал Американского химического общества. 96 (7): 2208–2214. Дои:10.1021 / ja00814a034.
- ^ а б Hogeveen, H .; Квант, П. В. (1973). "Прямое наблюдение удивительно стабильного дикика необычной структуры: (CCH3)62⊕". Буквы Тетраэдра. 14 (19): 1665–1670. Дои:10.1016 / S0040-4039 (01) 96023-X.
- ^ Малищевский, Мориц; Сеппельт, К. (25 ноября 2016 г.). "Определение кристаллической структуры пентагонально-пирамидального гексаметилбензола дикатиона C6 (CH3) 6 2+". Angewandte Chemie International Edition. 56 (1): 368–370. Дои:10.1002 / anie.201608795. ISSN 1433-7851. PMID 27885766.
- ^ G. Giordano, G .; Heldeweg, R .; Хогевен, Х. (1977). «Пирамидные дикатионы. Введение базальных и апикальных заместителей». Варенье. Chem. Soc. 99 (15): 5181–5183. Дои:10.1021 / ja00457a050.










