(E) -Стильбен - (E)-Stilbene
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК (E) -Стильбен | |
| Предпочтительное название IUPAC 1,1′-[(E) -Этен-1,2-диил] дибензол | |
| Другие имена Бибензилиден транс-α, β-Дифенилэтилен (E) -1,2-дифенилэтилен ((1E) -2-фенилвинил) бензол транс-Стильбене [(E) -2-фенилэтенил] бензол | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.002.817 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C14ЧАС12 | |
| Молярная масса | 180.250 г · моль−1 |
| Внешность | Твердый |
| Плотность | 0,9707 г / см3 |
| Температура плавления | От 122 до 125 ° C (от 252 до 257 ° F; от 395 до 398 K) |
| Точка кипения | От 305 до 307 ° C (от 581 до 585 ° F, от 578 до 580 K) |
| Практически нерастворим | |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материалов |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | > 112 ° C (234 ° F) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
(E) -Стильбен, широко известный как транс-стильбен, является органическое соединение представлен сжатая структурная формула C6ЧАС5CH = CHC6ЧАС5. Классифицируется как дневник, он имеет центральную этилен часть с одним фенил группа заместители на каждом конце углерод-углеродного двойная связь. Он имеет (E) стереохимия, означающая, что фенильные группы расположены на противоположных сторонах двойной связи, противоположной ее геометрический изомер, СНГ-стильбен. Транс-стильбен представляет собой белое кристаллическое твердое вещество при комнатной температуре и хорошо растворяется в органических растворителях. Его можно преобразовать в СНГ-стильбен фотохимически, а затем отреагировал на производство фенантрен.
Стилбен был открыт в 1843 году французским химиком. Огюст Лоран.[1] Название «стильбене» происходит от Греческий слово στίλβω (стильбо), что означает «Я сияю» из-за блестящего внешнего вида состава.[2]
Изомеры
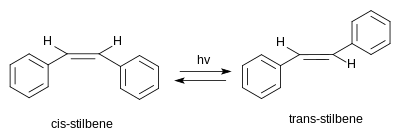
Стилбене существует как два возможных стереоизомеры. Один транс-1,2-дифенилэтилен, называемый (E) -стильбен или транс -стильбен. Второй СНГ-1,2-дифенилэтилен, называемый (Z) -стильбен или же СНГ -стильбен, и стерически затрудненный и менее стабильны, поскольку стерические взаимодействия заставляют ароматические кольца выходить из плоскости и предотвращают спряжение.[3] СНГ-стильбен представляет собой жидкость при комнатной температуре (точка плавления: 5–6 ° C (41–43 ° F)), а транс-стильбен представляет собой твердое кристаллическое вещество, которое не плавится примерно до 125 ° C (257 ° F), что свидетельствует о том, что два изомера имеют существенно разные физические свойства.[4][5]
Подготовка и реакции
Было разработано много синтезов. Один из популярных маршрутов предполагает сокращение бензоин с использованием амальгамы цинка.[5]
- C6ЧАС5–CH (OH) –C (= O) –C6ЧАС5 транс-C6ЧАС5–CH = CH – C6ЧАС5
Оба изомера стильбена могут быть получены декарбоксилированием α-фенилкоричная кислота, транс-стильбен производится из (Z) -изомер кислоты.[4]
Ричард Хек[6] и Цутому Мизороки[7] независимо сообщили о синтезе транс-стильбен путем связывания йодобензол и стирол с использованием катализатора палладия (II), в том, что сейчас известно как Реакция Мизороки-Хека.[8][9] Подход Мизороки дал более высокий урожай.
Стилбен вступает в реакции, типичные для алкенов. Транс-стильбен подвергается эпоксидированию пероксимонофосфорная кислота, H3PO5, с выходом 74% транс-стильбена оксид в диоксан.[10] В эпоксид сформированный продукт рацемическая смесь из двух энантиомеры 1,2-дифенилоксиран. В ахиральный мезо сложный (1р,2S) -1,2-дифенилоксиран возникает из СНГ-стильбен, хотя перекисное эпоксидирование СНГ-изомер производят как СНГ- и транс-эпоксидные продукты. Например, используя терт-бутилгидропероксид, окисление СНГ-стильбен производит 0,8% СНГ-стильбена оксид, 13,5% транс-стильбена оксид и 6,1% бензальдегид.[11][12] Оксид стильбена Enantiopure был получен лауреатом Нобелевской премии. Карл Барри Шарплесс.[13]
Стилбен может быть полностью окислен до бензальдегида путем озонолиз[14] или же Окисление Лемье-Джонсона и более сильные окислители, такие как подкисленные перманганат калия будет производить бензойная кислота. Vicinal диолы может производиться через Дигидроксилирование Апджона или же энантиоселективно с помощью Асимметричное дигидроксилирование по Шарплесу[15][16] с энантиомерные избытки достигает 100%.[17][18][19]
Бромирование транс-стильбен производит преимущественно мезо-1,2-дибром-1,2-дифенилэтан (иногда называемый мезо-стильбен дибромид) в соответствии с механизмом, включающим циклический бромоний ионный промежуточный продукт типичного электрофильного реакция присоединения брома;[20] СНГ-стильбен дает рацемическая смесь из двух энантиомеры 1,2-дибром-1,2-дифенилэтана в неполярном растворителе, таком как четыреххлористый углерод, но степень производства мезо сложный увеличивается с полярностью растворителя, с выходом 90% в нитрометан.[21] Образование небольших количеств двух энантиомеров стильбен дибромида из транс-изомер предполагает, что промежуточный ион бромония существует в химическое равновесие с карбокатионным интермедиатом PhCHBr – C+(H) Ph с вакантным p орбитальный уязвимы для нуклеофильной атаки с любого лица.[20] Добавление солей бромида или трибромида восстанавливает большую часть стереоспецифичности даже в растворителях с диэлектрическая постоянная выше 35.[22]
При УФ-облучении превращается в СНГ-стильбене, классический образец фотохимическая реакция с участием транс-СНГ изомеризация, и может подвергаться дальнейшей реакции с образованием фенантрен.[23]
Производные и использование
(E) -Стильбен сам по себе имеет небольшую ценность, но он является предшественником других производных, используемых в качестве красители, оптические отбеливатели, люминофор, и сцинтилляторы.[24] Стилбене - один из получить медиумы используется в лазеры на красителях.[25]


Динатрий 4,4'-динитростильбен-2,2'-дисульфонат подготовлен сульфирование из 4-нитротолуол с образованием 4-нитротолуол-2-сульфоновой кислоты, которую затем можно связать окислительно с использованием гипохлорит натрия сформировать (E) -стильбен производная[26] в процессе, первоначально разработанном Артур Грин и Андре Валь в конце девятнадцатого века.[27][28] Были разработаны усовершенствования процесса с более высокими выходами с использованием окисления на воздухе в жидком аммиаке.[29] Продукт полезен, поскольку его реакция с анилин производные приводит к образованию азокрасители. Коммерчески важные красители, производные от этого соединения, включают Direct Red 76, Direct Brown 78 и Direct Orange 40.[25]
В стильбеноиды представляют собой встречающиеся в природе производные стильбена. Примеры включают ресвератрол и его кузен, птеростильбен. В стильбэстролы, которые структурно, но не синтетически связаны с (E) -стильбен, экспонат эстрогенный Мероприятия. В эту группу входят диэтилстильбестрол, фосфестрол, и диенэстрол.
Приложение
Таблица 1. Давление паров[30]
| Изомер | Температура, ° C | Давление паров, кПа |
|---|---|---|
| СНГ-стильбен | 100 | 0.199 |
| СНГ-стильбен | 125 | 0.765 |
| СНГ-стильбен | 150 | 2.51 |
| транс-стильбен | 150 | 0.784 |
Рекомендации
- ^ Лоран, Огюст (1843). "Mémoire sur la série stilbique" [Воспоминания о серии стильбене]. Comptes rendus (На французском). 16: 856–860. С п. 857: "En soumettant ce sulfure à la distillation, il donne plusieurs produits, et entre autres, un composé fort remarquable que je nomme" Stilbène."(При отправке этого сульфида [т.е. фенилтиоальдегида, C6ЧАС5(CS) H] до [сухой] перегонки, он дает несколько продуктов, и среди прочего очень замечательное соединение, которое я называю «стильбен».)
- ^ Миллер, Уильям Аллен (1880). Элементы химии: теоретические и практические. т. 3 (5-е изд.). Лондон, Англия: Longmans, Green and Co., стр. 366.
- ^ Элиэль, Эрнест Л .; Вилен, Сэмюэл Х. (1994). Стереохимия органических соединений. Джон Уайли и сыновья. стр.566 -567. ISBN 0-471-01670-5.
- ^ а б Пряжки, Роберт Э .; Уиллер, Норрис Г. (1953). "СНГ-Стильбене ». Органический синтез. 33: 88. Дои:10.15227 / orgsyn.033.0088.; Коллективный объем, 4, п. 857
- ^ а б Shriner, R.L .; Бергер, Альфред (1943). "транс-Стильбене ». Органический синтез. 23: 86. Дои:10.15227 / orgsyn.023.0086.; Коллективный объем, 3, п. 786
- ^ Хек, Р.Ф.; Нолли, Дж. П. (1972). «Катализируемые палладием реакции винилового замещения водорода с арил-, бензил- и стирилгалогенидами». J. Org. Chem. 37 (14): 2320–2322. Дои:10.1021 / jo00979a024.
- ^ Мизороки, Цутому; Мори, Кунио; Одзаки, Ацуму (1971). «Арилирование олефина арилйодидом, катализируемое палладием». Бык. Chem. Soc. Jpn. 44 (2): 581. Дои:10.1246 / bcsj.44.581.
- ^ Черт возьми, Ричард Ф. (1982). «Винилирование органических галогенидов, катализируемое палладием». Орг. Реагировать. 27: 345–390. Дои:10.1002 / 0471264180.or027.02. ISBN 0471264180.
- ^ Белецкая, Ирина Петровна; Чепраков, Андрей В. (2000). «Чертова реакция как точильный камень палладиевого катализа». Chem. Ред. 100 (8): 3009–3066. Дои:10.1021 / cr9903048. PMID 11749313.
- ^ Огата, Йоширо; Томизава, Кохтаро; Икеда, Тошиюки (1979). "Окисление транс-стильбен с пероксимонофосфорной кислотой ». J. Org. Chem. 44 (14): 2362–2364. Дои:10.1021 / jo01328a006.
- ^ Инь, Гочуань; Дэнби, Эндрю М .; Китко, Дэвид; Картер, Джон Д .; Scheper, Уильям М .; Буш, Дэрил Х. (2007). «Эпоксидирование олефинов алкилгидропероксидом с новым комплексом марганцевого цикла с перекрестными мостиками: демонстрация оксигенации двумя разными реактивными промежуточными продуктами». Неорг. Chem. 46 (6): 2173–2180. Дои:10.1021 / ic061957r. PMID 17295471.
- ^ Буш, Дэрил Х.; Инь, Гочуань; Меньше, Хён-Джин (2011). «Катализируемое кислотой Льюиса эпоксидирование олефинов с использованием перекиси водорода: растущее значение и расширение диапазона». В Ояме, С. Тед (ред.). Механизмы гомогенного и гетерогенного эпоксидного катализа. Эльзевир. С. 119–153. ISBN 9780080558011.
- ^ Чанг, Хан-Тин; Шарплесс, К. Барри (1996). «Синтез энантиочистого оксида стильбена в молярном масштабе». J. Org. Chem. 61 (18): 6456–6457. Дои:10.1021 / jo960718q. PMID 11667495.
- ^ Бишоп, Клайд Э .; Денсон, Дональд Д .; Рассказ, Пол Р. (1968). «Механизмы озонолиза. СНГ, транс-стильбеновая система ». Tetrahedron Lett. 9 (55): 5739–5742. Дои:10.1016 / S0040-4039 (00) 76338-6.
- ^ Якобсен, Эрик Н .; Марко, Иштван; Mungall, William S .; Шредер, Георг; Шарплесс, К. Барри (1988). «Асимметричное дигидроксилирование с помощью лиганд-ускоренного катализа». Варенье. Chem. Soc. 110 (6): 1968–1970. Дои:10.1021 / ja00214a053.
- ^ Кольб, Хартмут С .; VanNieuwenhze, Michael S .; Шарплесс, К. Барри (1994). «Каталитическое асимметричное дигидроксилирование». Chem. Ред. 94 (8): 2483–2547. Дои:10.1021 / cr00032a009.
- ^ Ван, Чжи-Минь; Шарплесс, К. Барри (1994). «Процедура асимметричного дигидроксилирования твердого вещества для получения в масштабе килограмма Enantiopure Hydrobenzoin». J. Org. Chem. 59 (26): 8302–8303. Дои:10.1021 / jo00105a065.
- ^ McKee, Blaine H .; Gilheany, Declan G .; Шарплесс, К. Барри (1992). "(р,р) -1,2-Дифенил-1,2-этандиол (Стилбендиол) ». Органический синтез. 70: 47. Дои:10.15227 / orgsyn.070.0047.; Коллективный объем, 9, п. 383
- ^ Атта-ур-Рахман; Шах, Захир (1993). «Асимметричное гидроксилирование». Стереоселективный синтез в органической химии. Springer-Verlag. С. 406–410. ISBN 9781461383277.
- ^ а б Гилберт, Джон С .; Мартин, Стивен Ф. (2010). «10.6 - Бромирование алкенов». Экспериментальная органическая химия: миниатюрный и микромасштабный подход (5-е изд.). Cengage Learning. С. 376–383. ISBN 9781439049143.
- ^ Пряжки, Роберт Э .; Бадер, Джейн М .; Турмайер, Роланд Дж. (1962). «Стереоспецифичность добавления брома к СНГ- и транс-Стильбене ». J. Org. Chem. 27 (12): 4523–4527. Дои:10.1021 / jo01059a097.
- ^ Бьянкини, Роберто; Чиаппе, Чинция (1992). «Стереоселективность и обратимость присоединения электрофильного брома к стильбенам в хлороформе: влияние равновесия бромид-трибромид-пентабромид в противовесе ионных промежуточных продуктов». J. Org. Chem. 57 (24): 6474–6478. Дои:10.1021 / jo00050a021.
- ^ Квасьневский, С.П .; Claes, L .; François, J.-P .; Делез, М. С. (2003). «Теоретическое исследование на высоком уровне структуры и вращательных барьеров транс-стильбене ». J. Chem. Phys. 118 (17): 7823–7836. Bibcode:2003ЖЧФ.118.7823К. Дои:10.1063/1.1563617.
- ^ Фогт, Питер Ф .; Герулис, Джон Дж. (2000). «Ароматические амины». Энциклопедия промышленной химии Ульмана. Вайнхайм: Вайли-ВЧ. Дои:10.1002 / 14356007.a02_037. ISBN 3527306730.
- ^ а б Голод, Клаус; Мишке, Питер; Рипер, Вольфганг; Рауэ, Родерих; Кунде, Клаус; Энгель, Алоис (2005). «Азокрасители». Энциклопедия промышленной химии Ульмана. Вайнхайм: Вайли-ВЧ. Дои:10.1002 / 14356007.a03_245. ISBN 3527306730.
- ^ Камминг, Уильям М .; Хоппер, И. Вэнс; Уиллер, Т. Шерлок (1926). «Препарат 294. - Динитро-стильбен-дисульфоновая кислота (натриевая соль)». Систематическая органическая химия: современные методы получения и оценки. Нью-Йорк: Компания D. Van Nostrand. п. 314.
- ^ Грин, Артур Г.; Валь, Андре Р. (1897). "Ueber die Oxydation von Paranitrotoluolsulfosäure" [Об окислении параграф-нитротолуолсульфоновая кислота]. Бер. Dtsch. Chem. Ges. (на немецком). 30 (3): 3097–3101. Дои:10.1002 / cber.189703003128.
- ^ Грин, Артур Г.; Валь, Андре Р. (1898). "Ueber die Oxydation der Paranitrotoluolsulfosäure" [Об окислении параграф-нитротолуолсульфоновая кислота]. Бер. Dtsch. Chem. Ges. (на немецком). 31 (1): 1078–1080. Дои:10.1002 / cber.189803101195.
- ^ Патент США 5041632, Гульельметти, Леонардо, «Процесс получения 4,4'-динитростильбен-2,2-дисульфоновой кислоты», опубликовано 20 августа 1991 г., опубликовано 20 августа 1991 г. Корпорация Ciba-Geigy
- ^ Лиде, Дэвид (1995). CRC Справочник по химии и физике (76-е изд.). США: CRC Press, Inc., стр. 6–107. ISBN 0-8493-0476-8.


![{ displaystyle { ce {-> [{ ce {Zn (Hg)}}] [{ ce {HCl}} { text {,}} { ce {CH3CH2OH}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e1406e12754001b43f053ffef11d727e4d7de0e9)


