Заживление костей - Bone healing

Заживление костей, или же заживление перелома, это пролиферативный физиологический процесс, в котором тело облегчает ремонт трещина в кости.
В общем лечение перелома костей состоит из того, что врач восстанавливает (подталкивает) смещенные кости на место посредством перемещения с анестетиком или без него, стабилизирует их положение, чтобы помочь сращению, а затем ожидает естественного процесса заживления кости.
Было обнаружено, что адекватное потребление питательных веществ значительно влияет на целостность заживления перелома.[1] Возраст, тип кости, лекарственная терапия и ранее существовавшая патология костей являются факторами, влияющими на заживление. Роль заживления кости заключается в создании новой кости без рубца, который наблюдается в других тканях, что было бы структурной слабостью или деформацией.[2]
Процесс всей регенерации кости может зависеть от угла вывиха или перелома. Хотя формирование кости обычно охватывает весь период процесса заживления, в некоторых случаях костный мозг внутри перелома заживает за две или менее недель до финальной фазы ремоделирования.[нужна цитата ]
Хотя иммобилизация и хирургическое вмешательство могут способствовать заживлению, перелом в конечном итоге заживает в результате физиологических процессов. Процесс заживления в основном определяется надкостница (в соединительная ткань мембрана, покрывающая кость). Надкостница является одним из источников клеток-предшественников, которые развиваются в хондробласты и остеобласты которые необходимы для выздоровление кости. Другими источниками клеток-предшественников являются Костный мозг (при наличии), эндост, маленький кровеносный сосуд, и фибробласты.[3]
Первичное исцеление
Первичное заживление (также известное как прямое заживление) требует правильной анатомической репозиции, которая является стабильной, без образования промежутков. Такое заживление требует только ремоделирования пластинчатой кости, Гаверсовские каналы и кровеносные сосуды без мозоль формирование. Этот процесс может занять от нескольких месяцев до нескольких лет.[4]
Контактное исцеление
Когда зазор между концами кости составляет менее 0,01 мм, а межфрагментарная деформация менее 2%, может произойти контактное заживление. В этом случае режущие конусы, состоящие из остеокластов, образуются поперек линий перелома, образуя полости со скоростью 50–100 мкм / день. Остеобласты заполняют полости по гаверсовской системе. Это вызывает образование пластинчатой кости, которая ориентирована в продольном направлении вдоль длинной оси кости. Образуются кровеносные сосуды, пронизывающие гаверсовскую систему. Реконструкция пластинчатая кость приводит к исцелению без мозоль формирование.[4]
Исцеление разрывов
Если щель в переломе составляет от 800 мкм до 1 мм, трещина заполняется остеокластами, а затем пластинчатой костью, ориентированной перпендикулярно оси кости. Этот первоначальный процесс занимает от трех до восьми недель. перпендикулярная ориентация ламеллярной кости слабая, поэтому требуется вторичная костная реконструкция для переориентации пластинчатой кости в продольном направлении.[4]
Вторичное исцеление
Вторичное заживление (также известное как непрямое заживление переломов) - наиболее распространенная форма заживления костей. Обычно он состоит только из эндохондральная оссификация. Иногда, внутримембранозная оссификация происходит вместе с эндохондральным окостенением. Внутримембранозная оссификация, опосредованная периостальный слой кости, происходит без образования мозоль. При эндохондральной оссификации отложение кости происходит только после минерализации хряща.[нужна цитата ] Этот процесс заживления происходит при консервативном лечении перелома с использованием ортопедическая повязка или иммобилизация, внешняя фиксация, или же внутренняя фиксация.[4]
Реакция
После перелома кости клетки крови скапливаются рядом с местом повреждения. Вскоре после перелома кровеносные сосуды сужаются, останавливая дальнейшее кровотечение. В течение нескольких часов внесосудистые клетки крови образуют сгусток, называемый гематома[нужна цитата ] который действует как шаблон для образования костной мозоли. Эти клетки, в том числе макрофаги, высвобождают медиаторы воспаления, такие как цитокины (фактор некроза опухоли альфа (TNFα), семейство интерлейкинов-1 (Ил-1), интерлейкин 6 (Ил-6), 11 (Ил-11), и 18 (IL-18)) и увеличивают проницаемость кровеносных капилляров. Воспаление достигает пика через 24 часа и завершается через семь дней. Через рецептор фактора некроза опухоли 1 (TNFR1) и рецептор фактора некроза опухоли 2, TNFα опосредует дифференцировку мезенхимальные стволовые клетки (возникла из Костный мозг ) в остеобласт и хондроциты. Фактор 1, полученный из стромальных клеток (SDF-1) и CXCR4 опосредуют рекрутирование мезенхимальных стволовых клеток. ИЛ-1 и ИЛ-6 являются наиболее важными цитокинами для заживления костей. IL-1 способствует образованию мозолей и кровеносных сосудов. IL-6 способствует дифференцировке остеобластов и остеокласты.[4] Все клетки сгустка крови дегенерируют и умирают. В этой области фибробласты воспроизвести. В течение 7-14 дней они образуют рыхлую совокупность клеток, перемежающихся с мелкими кровеносными сосудами, известную как грануляционная ткань.[нужна цитата ] Остеокласты перемещаются, чтобы реабсорбировать мертвые концы костей, а другая некротическая ткань удаляется.[5]
Ремонт
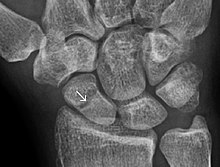
Через семь-девять дней после перелома клетки надкостница копировать и трансформировать. Клетки надкостницы проксимальнее (на ближней стороне) разрыв трещины превращается в хондробласты, которые образуют гиалиновые хрящи. Клетки надкостницы дистальнее (на дальнем конце) разрыв трещины превращается в остеобласты, которые образуют тканая кость[нужна цитата ] через резорбция кости кальцинированного хряща и рекрутирования костных клеток и остеокластов.[4] Фибробласты в грануляционной ткани развиваются в хондробласты, которые также образуют гиалиновый хрящ. Эти две новые ткани увеличиваются в размерах, пока не соединятся друг с другом. Эти процессы завершаются образованием новой массы неоднородной ткани, известной как перелом мозоли[нужна цитата ] Пик образования каллуса приходится на 14-й день перелома.[4] В конце концов, разрыв трещины перекрывается.[нужна цитата ]
Следующий этап - замена гиалинового хряща и тканой кости на пластинчатая кость. Процесс замены известен как эндохондральная оссификация в отношении гиалинового хряща и замещения костной ткани по отношению к тканой кости. Замена тканой кости происходит до замещения гиалинового хряща. Пластинчатая кость начинает формироваться вскоре после того, как коллагеновая матрица любой ткани становится минерализованной.[нужна цитата ] На этом этапе процесс индуцируется IL-1 и TNFα.[4] Минерализованная матрица пронизана микрососуд и многочисленные остеобласты. Остеобласты образуют новую пластинчатую кость на недавно обнаженной поверхности минерализованного матрикса. Эта новая пластинчатая кость имеет форму губчатая кость. В конце концов, вся костная ткань и хрящ исходной костной мозоли при переломе заменяется губчатой костью, восстанавливая большую часть первоначальной прочности кости.[нужна цитата ]
Ремоделирование
Ремоделирование начинается уже через три-четыре недели после перелома и может занять 3-5 лет.[4] Процесс заменяет губчатую кость на компактная кость. Грабекулярная кость сначала рассасывается остеокласты, создавая неглубокую яму рассасывания, известную как «лакуна Ховшипа». Затем остеобласты откладывают компактную кость в резорбционной ямке. В конце концов костная мозоль при переломе принимает новую форму, которая точно повторяет первоначальную форму и прочность кости. Этот процесс может быть достигнут за счет формирования электрической полярности во время частичной нагрузки на длинную кость;[нужна цитата ] где электроположительная выпуклая поверхность и электроотрицательная вогнутая поверхность активируют остеокласты и остеобласты соответственно.[4] Этот процесс может быть усилен некоторыми синтетическими биоматериалами для инъекций, такими как Цемент, которые являются остеокондуктивными и способствуют заживлению костей[нужна цитата ]
Препятствия

- Плохое кровоснабжение, что приводит к гибели остеоцитов. Гибель костных клеток также зависит от степени перелома и нарушения гаверсовской системы.
- Состояние мягких тканей. Мягкие ткани между концами костей ограничивают заживление.
- Питание и медикаментозная терапия. Плохое общее состояние здоровья снижает скорость исцеления. Лекарства, ухудшающие воспалительную реакцию, также препятствуют заживлению.
- Инфекционное заболевание. Направляет воспалительную реакцию от заживления к борьбе с инфекцией.
- Возраст. Молодая кость соединяется быстрее, чем взрослая кость.
- Ранее существующее злокачественное новообразование костей.
- Механические факторы, такие как неправильное выравнивание костей и слишком сильное или слишком слабое движение. Избыточная подвижность может нарушить мостовидную мозоль, препятствуя сращению; но небольшое биомеханическое движение улучшает формирование костной мозоли.[5]
Осложнения
Осложнения заживления перелома включают:
- Инфекция: это наиболее частое осложнение переломов, возникающее преимущественно при открытых переломах. Посттравматическая раневая инфекция - наиболее частая причина хронического остеомиелита у пациентов. Остеомиелит также может возникнуть после хирургической фиксации перелома.[7]
- Не союз: нет прогрессирования заживления в течение шести месяцев после перелома. Части перелома остаются разделенными, что может быть вызвано инфекцией и / или отсутствием кровоснабжения (ишемией) кости.[8] Есть два типа несращения: атрофический и гипертрофический. Гипертрофия заключается в образовании избыточной костной мозоли, приводящей к тому, что концы костей выглядят склеротическими, вызывая рентгенологический вид "слоновьей стопы".[5] из-за чрезмерного перелома прекращается подвижность, но достаточное кровоснабжение.[4] Атрофическое несращение приводит к повторной абсорбции и округлению концов костей[5] из-за недостаточного кровоснабжения и чрезмерной подвижности концов костей.[4]
- Mal-union: заживление происходит, но заживающая кость имеет «угловую деформацию, перемещение или вращательное совмещение, требующее хирургической коррекции». Это наиболее часто встречается в длинных костях, таких как бедренная кость.[9]
- Отсроченное сращение: время заживления зависит от локализации перелома и возраста пациента. Отсроченное сращение характеризуется «сохранением линии перелома и редкостью или отсутствием образования костной мозоли» на рентгенограмме. Исцеление все еще происходит, но гораздо медленнее, чем обычно.[8]
Галерея
Коллагеновые волокна тканой кости

Остеокласт с множеством ядер в «пенистой» цитоплазме.

Световая микрофотография декальцинированный кость, отображающая остеобласты, образующие новую компактную кость, содержащую два остеоцита, внутри резорбционной ямки в губчатой кости.
Хронология рентгенологических исследований у детей раннего возраста
На медицинская визуализация, вторичное заживление костей у маленьких детей со временем проявляет следующие особенности:
| Разрешение мягких тканей | 7-10 дней (или 2-21 день) |
| Расширение разрыва | 4-6 недель (56%) |
| Периостальная реакция | 7 дней - 7 недель |
| Краевой склероз | 4-6 недель (85%) |
| Первая мозоль | 4-7 недель (100%) |
| Радиоплотность мозоли> коры | 13 недель (90%) |
| Мостовидная мозоль | 2.6 - 13 недель |
| Включение периоста | 14 недель |
| Ремоделирование | 9 недель (50%) |
Сноски
- ^ Сьюзан Э. Браун, доктор философии. «Как ускорить заживление переломов» (PDF). Центр улучшения костей.
Хотя ни один ученый еще не провел клинических испытаний с использованием всех 20 основных питательных веществ для заживления переломов, в нескольких исследованиях было обнаружено, что терапия с использованием нескольких питательных веществ снижает осложнения и ускоряет заживление переломов.
- ^ Гомес-Баррена Е., Россет П., Лозано Д., Становичи Дж., Эрмталлер С., Гербхард Ф. Заживление переломов костей: клеточная терапия при отсроченных сращениях и несращениях. Кость. 2015;70:93–101.
- ^ Ферретти С., Маттиоли-Бельмонте М. Стволовые клетки, полученные из надкостницы, для предложений по регенеративной медицине: расширение современных знаний. Всемирный журнал стволовых клеток. 2014; 6 (3): 266-277. DOI: 10.4252 / wjsc.v6.i3.266.
- ^ а б c d е ж грамм час я j k л Ричард, Марселл; Томас А., Эйнхорн (1 июня 2012 г.). «Биология заживления переломов». Травма, повреждение. 42 (6): 551–555. Дои:10.1016 / j.injury.2011.03.031. ЧВК 3105171. PMID 21489527.
- ^ а б c d Няры Тамас, Scamell BE. (2015). Принципы травм костей и суставов и их заживления. Хирургия (Оксфорд). 33 (1), стр. 7-14.
- ^ Джаррая, Мохамед; Хаяси, Даичи; Ремер, Франк В .; Crema, Michel D .; Диас, Луис; Конлин, Джейн; Марра, Моника Д .; Джомаах, Набиль; Гермази, Али (2013). "Рентгенологически оккультные и тонкие переломы: обзор изображений". Радиологические исследования и практика. 2013: 1–10. Дои:10.1155/2013/370169. ISSN 2090-1941. ЧВК 3613077. PMID 23577253. CC-BY 3.0
- ^ Роуботэм, Эмма; Бэррон, Доминик (2009). «Радиология осложнений переломов». Ортопедия и травмы. 23 (1): 52–60. Дои:10.1016 / j.mporth.2008.12.008.
- ^ а б Джахагирдар, Раджив; Скаммелл, Бриджит Э (2008). «Принципы заживления переломов и нарушений сращения костей». Хирургия. 27 (2): 63–69. Дои:10.1016 / j.mpsur.2008.12.011.
- ^ Чен, Эндрю Т; Валлье, Хизер А (2016). «Несмежные и открытые переломы нижней конечности: эпидемиология, осложнения и внеплановые процедуры». Травма, повреждение. 47 (3): 742–747. Дои:10.1016 / j.injury.2015.12.013. PMID 26776462.
- ^ Если иное не указано в полях, ссылка:
- Проссер, Ингрид; Лоусон, Зоя; Эванс, Элисон; Харрисон, Сара; Моррис, Сью; Магуайр, Сабина; Кемп, Элисон М. (2012). «График радиологических особенностей заживления переломов у детей раннего возраста». Американский журнал рентгенологии. 198 (5): 1014–1020. Дои:10.2214 / AJR.11.6734. ISSN 0361-803X. PMID 22528890.
- Данные взяты из научных исследований, в частности, Islam et al. где данные противоречат учебникам радиологии:
Ислам, Омар; Соболевский, Дон; Саймонс, С .; Дэвидсон, Л. К .; Ashworth, M. A .; Бабин, Пол (2000). «Развитие и продолжительность рентгенологических признаков заживления костей у детей». Американский журнал рентгенологии. 175 (1): 75–78. Дои:10.2214 / ajr.175.1.1750075. ISSN 0361-803X. PMID 10882250.
Рекомендации
- Брайтон, Карл Т. и Роберт М. Хант (1986), «Гистохимическая локализация кальция в костной мозоли перелома с пироантимонатом калия: возможная роль митохондриального кальция хондроцитов в кальцификации костной мозоли», Журнал костной и суставной хирургии, 68-А (5): 703-715
- Брайтон, Карл Т. и Роберт М. Хант (1991), «Ранние гистологические и ультраструктурные изменения костной мозоли при переломе костного мозга», Журнал костной и суставной хирургии, 73-А (6): 832-847
- Брайтон, Карл Т. и Роберт М. Хант (1997), "Ранние гистологические и ультраструктурные изменения микрососудов периостальной мозоли", Журнал ортопедической травмы, 11 (4): 244-253
- Хэм, Артур В. и Уильям Р. Харрис (1972), «Ремонт и трансплантация кости», Биохимия и физиология кости, Нью-Йорк: Academic Press, стр. 337-399



