Протохлорофиллид - Википедия - Protochlorophyllide
 | |
| Имена | |
|---|---|
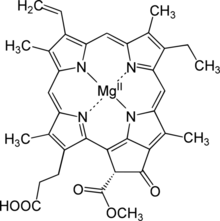
| Название ИЮПАК Магний (21р) -3- (2-карбоксиэтил) -14-этил-21- (метоксикарбонил) -4,8,13,18-тетраметил-20-оксо-9-винил-3,4,23,25-тетрадегидрофорбин-23, 25-диид | |
| Другие имена Моновинил протохлорофиллид | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| КЕГГ | |
PubChem CID | |
| |
| |
| Характеристики | |
| C35ЧАС32MgN4О5 | |
| Молярная масса | 612,957 г / моль |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |

Протохлорофиллид,[1] или же моновинил протохлорофиллид, является промежуточным звеном в биосинтез из хлорофилл а. Ему не хватает фитол боковая цепь хлорофилла и уменьшенный пиррол в кольце D.[2] Протохлорофиллид очень флуоресцентный; мутанты, которые его накапливают, светятся красным при облучении синим светом.[3] В покрытосеменные, более поздние стадии превращения протохлорофиллида в хлорофилл зависят от света, и такие растения бледные (хлоротичный ) если вырос в темноте. Голосеменные, водоросли, а фотосинтезирующие бактерии имеют другой, не зависящий от света фермент, и тоже становятся зелеными в темноте.
Превращение в хлорофилл
Фермент, превращающий протохлорофиллид в хлорофиллид а, следующее промежуточное звено на пути биосинтеза,[4] является протохлорофиллид редуктаза,[5] EC 1.3.1.33. Есть два структурно не связанных белка с этой активностью: светозависимый и темновой. Светозависимой редуктазе для работы необходим свет. Темно-операционная версия представляет собой совершенно другой белок, состоящий из трех субъединиц, которые демонстрируют значительное сходство последовательностей с тремя субъединицами нитрогеназа, который катализирует образование аммиака из диазота.[6] Этот фермент может быть эволюционно старше, но (будучи похож на нитрогеназу) очень чувствителен к свободным кислород и не работает, если его концентрация превышает примерно 3%.[7] Следовательно, для развития нужна была альтернативная, зависимая от света версия.
Большинство фотосинтезирующих бактерий имеют как светозависимые, так и светонезависимые редуктазы. Покрытосеменные потеряли темную операционную форму и полагаются на 3 немного разных копии светозависимой версии, часто сокращенно обозначаемых как POR A, B и C. У голосеменных гораздо больше копий аналогичного гена (Лоблольская сосна насчитывает около 11 Сосна лоблолли (Pinus taeda L.) содержит несколько экспрессируемых генов, кодирующих светозависимый НАДФН: протохлорофиллидоксидоредуктазу (ПОР) ). У растений ПОР кодируется в ядро клетки и только потом перевезли к месту работы, хлоропласт. В отличие от ПОР, у растений и водорослей, у которых есть действующий в темноте фермент, он, по крайней мере, частично кодируется в геном хлоропласта.[8]
Потенциальная опасность для растений
Сам хлорофилл связан с белками и может передавать поглощенную энергию в нужном направлении. Однако протохлорофиллид встречается в основном в свободной форме и в условиях освещения действует как фотосенсибилизатор, образуя высокотоксичные свободные радикалы. Следовательно, растениям необходим эффективный механизм регулирования количества предшественника хлорофилла. У покрытосеменных это делается на этапе δ-аминолевулиновая кислота (ALA), одно из промежуточных соединений в пути биосинтеза. Растения, которые питаются ALA, накапливают высокие и токсичные уровни протохлорофиллида, как и мутанты с нарушенной регуляторной системой.
Арабидопсис ГРИПП мутант с нарушенной регуляцией может выжить только в непрерывной темноте (протохлорофиллид не опасен в темноте) или при постоянном освещении, когда растение способно превращать весь продуцируемый протохлорофиллид в хлорофилл и не накапливать его чрезмерно, несмотря на отсутствие регуляции. В ячмень Тигрина мутант (мутировавший по тому же гену,[9]) свет убивает большую часть листовой ткани, которая образовалась в темноте, но часть листа, возникшего в течение дня, выживает. В результате листья покрываются белыми полосами некротических участков, а количество белых полос приближается к возрасту листа в днях. Зеленые области переживают последующие ночи, вероятно, потому, что синтез хлорофилла в зрелой ткани листа в любом случае значительно снижен.
Белок, регулирующий биосинтез, FLU
Несмотря на многочисленные прошлые попытки найти мутант, сверхаккумулирующий протохлорофиллид в обычных условиях, только один такой ген (грипп) в настоящее время (2009 г.) известен. Грипп (впервые описано в [3]) представляет собой кодируемый ядром, расположенный в хлоропласте белок, который, по-видимому, содержит только сайты взаимодействия белок-белок. В настоящее время неизвестно, какие другие белки взаимодействуют через этот линкер. Регуляторный белок - это трансмембранный белок, который находится в тилакоид мембрана. Позже было обнаружено, что Тигрина мутанты ячменя, известные давно, также мутированы в том же гене.[9] Непонятно, почему не наблюдались мутанты какого-либо другого гена; возможно, мутации в других белках, участвующих в регуляторной цепи, фатальны. Грипп это единственный ген, а не член генная семья.
Позже по сходству последовательностей похожий белок был обнаружен у Хламидомонада водоросли[10] показывая, что эта регуляторная подсистема существовала задолго до того, как покрытосеменные растения утратили независимый фермент конверсии. По-другому Хламидомонада регуляторный белок более сложен: он больше, пересекает тилакоидную мембрану дважды, а не один раз, содержит больше сайтов белок-белковых взаимодействий и даже подвергается альтернативному воздействию. сращивание. Похоже, что в процессе эволюции система регулирования претерпела упрощение.
Рекомендации
- ^ Запись в базе данных соединений KEGG [1]
- ^ Уиллоуз, Роберт Д. (2003). «Биосинтез хлорофиллов из протопорфирина IX». Отчеты о натуральных продуктах. 20 (6): 327–341. Дои:10.1039 / B110549N. PMID 12828371.
- ^ а б Мескаускене Р., Натер М., Гослингс Д., Кесслер Ф., Оп ден Камп Р., Апель К. ГЛУ: негативный регулятор биосинтеза хлорофилла у Arabidopsis thaliana. Труды Национальной академии наук Соединенных Штатов Америки. 2001; 98 (22): 12826-31 pdf.
- ^ Р. Каспи (18 июля 2007 г.). «3,8-дивинил-хлорофиллид а, биосинтез I (аэробный, светозависимый)». База данных метаболических путей MetaCyc. Получено 2020-06-04.
- ^ Запись фермента KEGG 1.3.1.33 [2]
- ^ Юичи ФудзитаКинжал и Карл Э. Бауэр (2000). Восстановление светонезависимой протохлорофиллидредуктазы из очищенных субъединиц Bchl и BchN-BchB. J. Biol. Chem., Vol. 275, выпуск 31, 23583-23588. [3]
- ^ С. Ямазаки, Дж. Номата, Ю. Фуджита (2006) Дифференциальное действие двойных протохлорофиллидредуктаз для биосинтеза хлорофилла в ответ на уровни кислорода в окружающей среде в цианобактериях Лептолингбья боряна. Физиология растений, 2006, 142, 911-922 [4]
- ^ Дж. Ли, М. Гольдшмидт-Клермон, М. П. Тимко (1997). Кодируемый хлоропластом chlB необходим для светонезависимой активности протохлорофиллидредуктазы у Хламидомонада Reinhardtii. Растительная клетка 5 (12): 1817–1829. [5].
- ^ а б Ли, Кын Пё; Ким, Чанхонг; Ли, Дэ Вон; Апель, Клаус (2003). «TIGRINA d, необходимый для регуляции биосинтеза тетрапирролов в ячмене, является ортологом гена FLU Arabidopsis thaliana". Письма FEBS. 553 (1–2): 119–124. Дои:10.1016 / s0014-5793 (03) 00983-9. PMID 14550558. S2CID 34038176.
- ^ А. Фальциатор, Л. Мерендино, Ф. Барнеч, М. Цеол, Р. Мескаускене, К. Апель, Дж. Д. Рошэ (2005). Белки FLP действуют как регуляторы синтеза хлорофилла в ответ на световые и пластидные сигналы в Хламидомонада. Гены и Дев, 19: 176-187 [6]
