Тиоредоксиновый фолд - Thioredoxin fold
| Тиоредоксин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
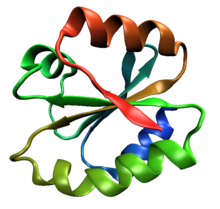 Одна молекула человека тиоредоксин (PDB ID 1ERT), канонический пример тиоредоксинового фолд-класса. | |||||||||
| Идентификаторы | |||||||||
| Символ | Тиоредоксин, Trx | ||||||||
| Pfam | PF00085 | ||||||||
| Pfam клан | CL0172 | ||||||||
| ИнтерПро | IPR013766 | ||||||||
| PROSITE | PDOC00172 | ||||||||
| SCOP2 | 3тркс / Объем / СУПФАМ | ||||||||
| CDD | cd01659 | ||||||||
| Мембранома | 337 | ||||||||
| |||||||||
| Тиоредоксин | |
|---|---|
| Идентификаторы | |
| Символ | Trx |
| Мембранома | 260 |
В тиоредоксиновый фолд это белок складывать общий для ферменты которые катализируют дисульфидная связь формирование и изомеризация. Сгиб назван в честь канонического примера. тиоредоксин и встречается в обоих прокариотический и эукариотический белки. Это пример альфа / бета складка белка который имеет оксидоредуктаза Мероприятия. Пространственная топология складки представляет собой четырехцепочечный антипараллельный бета-лист зажатый между тремя альфа спирали. Топология жилы - 2134 с тремя антипараллельными остальным.
Сохранение последовательности
Несмотря на вариабельность последовательности во многих областях складки, белки тиоредоксина имеют общий активный сайт последовательность с двумя реактивными цистеин остатки: Cys-X-Y-Cys, где X и Y часто, но не обязательно гидрофобный аминокислоты. Восстановленная форма белка содержит два свободных тиол группы у остатков цистеина, тогда как окисленная форма содержит дисульфидную связь между ними.
Образование дисульфидной связи
Различные белки, содержащие тиоредоксиновый фолд, сильно различаются по своей реакционной способности и pKa свободных тиолов, что происходит из способности общей структуры белка стабилизировать активированные тиолат. Хотя структура довольно последовательна среди белков, содержащих тиоредоксиновую складку, pKa чрезвычайно чувствительна к небольшим изменениям в структуре, особенно в размещении белковый каркас атомы около первого цистеина.
Примеры
Белки человека, содержащие этот домен, включают:
- DNAJC10
- ERP70
- GLRX3
- P4HB; P5; PDIA2; PDIA3; PDIA4; PDIA5; PDIA6; PDILT
- QSOX1; QSOX2
- STRF8
- TXN; TXN2; TXNDC1; TXNDC10; TXNDC11; TXNDC13; TXNDC14; TXNDC15; TXNDC16; TXNDC2; TXNDC3; TXNDC4; TXNDC5; TXNDC6; TXNDC8; TXNL1; TXNL3
Рекомендации
- Creighton TE. (2000). Сворачивание белка связано с образованием дисульфидной связи. В Механизмы сворачивания белков 2-е изд. Редактор RH Pain. Издательство Оксфордского университета.
