Бутоксид титана - Википедия - Titanium butoxide
 структура газовой фазы | |
| Имена | |
|---|---|
| Название ИЮПАК бутан-1-олат титана (4+) | |
| Другие имена | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.024.552 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| Номер ООН | 2920 |
| |
| |
| Характеристики | |
| C16ЧАС36О4Ti | |
| Молярная масса | 340.32164 |
| Запах | слабый спиртоподобный[1] |
| Плотность | 0,998 г / см3[1] |
| Температура плавления | -55 ° С[1] |
| Точка кипения | 312 ° С[1] |
| разлагается[1] | |
| Растворимость | большинство органических растворителей, кроме кетоны[1] |
| 1.486[1] | |
| Термохимия | |
Теплоемкость (C) | 711 Дж / (моль · К)[2] |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -1670 кДж / моль[2] |
| Опасности | |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 3122 мг / кг (крыса, перорально) и 180 мг / кг (мышь, внутривенно).[1] |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
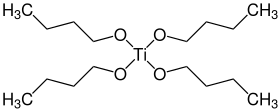
Бутоксид титана металлорганический химическое соединение с формула Ti (OBu)4 (Бу = CH2CH2CH2CH3). Это бесцветная жидкость без запаха, хотя выдержанные образцы желтоватого цвета со слабым запахом спирта. Растворим во многих органических растворителях.[1][3] Гидролизуется, чтобы дать оксид титана, что позволяет осаждать TiO2 покрытия различных форм и размеров вплоть до наномасштаба.[4][5]
Структура и синтез

Как и большинство алкоголятов титана (исключение: изопропоксид титана ), Ti (OBu)4 не является мономером, а существует в виде кластера (см. этоксид титана ). Тем не менее, его часто изображают как простой мономер.
Производится путем обработки тетрахлорид титана с бутанол:
- TiCl4 + 4 HOBu → Ti (OBu)4 + 4 HCl
Для завершения реакции требуется основание.
Реакции
Как и другие алкоксиды титана, бутоксид титана обменивает алкоксидные группы:
- Ti (OBu)4 + HOR → Ti (OBu)3(ИЛИ) + HOBu
- Ti (OBu)3(ИЛИ) + HOR → Ti (OBu)2(ИЛИ ЖЕ)2 + HOBu
По этой причине бутоксид титана несовместим со спиртовыми растворителями.
Бутоксид титана, как и алкоксидный обмен, легко гидролизуется. Детали реакции сложны, но их можно обобщить с помощью этого сбалансированного уравнения.
- Ti (OBu)4 + 2 часа2O → TiO2 + 4 HOBu
Пиролиз также дает диоксид:
- Ti (OBu)4 → TiO2 + 2 Bu2О
Реакции и опасность

Тетрабутилортотитанат реагирует с алкилциклосилоксанами. С окатаметилциклотетрасилоксаном он производит дибутоксидиметилсилан, 1,5-дибутоксигексаметилтрисилоксан, 1,7-дибутоксиоктаметилтетрасилоксан, 1,3-дибутокситетраметилдисилоксан и полимеры. Вместе с гексаметилциклотрисилоксаном он также производит дибутоксидиметилсилан.[6]
Рекомендации
- ^ а б c d е ж грамм час я j Бутил титанат. pubchem.ncbi.nlm.nih.gov
- ^ а б c Тетрабутил титанат. nist.gov
- ^ Поханиш, Ричард П .; Грин, Стэнли А. (2009). Руководство Wiley по химической несовместимости. Джон Вили и сыновья. п. 1010. ISBN 978-0-470-52330-8.
- ^ а б Ван, Цуй (2015). "Жесткий шаблон хирального TiO2 нановолокна с оптической активностью на основе электронных переходов ». Наука и технология перспективных материалов. 16 (5): 054206. Bibcode:2015STAdM..16e4206W. Дои:10.1088/1468-6996/16/5/054206. ЧВК 5070021. PMID 27877835.
- ^ Ву, Лимин; Багдачи, Джамиль (2015). Функциональные полимерные покрытия: принципы, методы и применение. Вайли. п. 10. ISBN 978-1-118-88303-7.
- ^ Андрианов К.А., Ш. Пичхадзе В.В., Комарова В.В., Ц. Н. Вардосанидзе (1962). «Реакции органоциклосилоксанов с тетрабутилортотитанатом». Вестник АН СССР. Отделение химических наук.. 11 (5): 776–779. Дои:10.1007 / BF00905301. ISSN 0568-5230.CS1 maint: использует параметр авторов (связь)
