Цикл обратной связи с переводом транскрипции - Википедия - Transcription translation feedback loop
Петля обратной связи транскрипции-трансляции (TTFL), является клеточной моделью для объяснения циркадные ритмы в поведении и физиология. TTFL, широко консервативный у разных видов, является саморегулирующимся, при котором транскрипция часовых генов регулируется их собственными белковыми продуктами.
Открытие
Циркадные ритмы документированы веками. Например, французский астроном Жан-Жак д’Орту де Майран отметили периодическое 24-часовое движение Мимоза листья растений появляются уже в 1729 году. Однако наука только недавно начала открывать клеточные механизмы, ответственные за управление наблюдаемыми циркадными ритмами. Клеточная основа циркадных ритмов подтверждается тем фактом, что ритмы наблюдались в одноклеточные организмы[1]
Начиная с 1970-х годов, эксперименты, проводимые Рон Конопка и коллеги, в которых передовые генетические методы были использованы для индукции мутации, показали, что Drosophila melanogaster образцы с измененными период (За) гены также продемонстрировала измененную периодичность. По мере совершенствования экспериментальных инструментов генетической и молекулярной биологии исследователи далее идентифицировали гены, участвующие в поддержании нормального ритмического поведения, что привело к концепции, что внутренние ритмы изменяются небольшим подмножеством генов основных часов. Хардин и его коллеги (1990) были первыми, кто предположил, что механизмом, управляющим этими ритмами, была цепь отрицательной обратной связи. Последующие крупные открытия подтвердили эту модель; особенно эксперименты, проведенные Томасом К. Дарлингтоном и Николасом Гекакисом в конце 1990-х годов, которые идентифицировали белки часов и охарактеризовали их методы у дрозофилы и мышей, соответственно. Эти эксперименты привели к созданию модели петли обратной связи транскрипции-трансляции (TTFL), которая сейчас стала доминирующей парадигмой для объяснения циркадного поведения у широкого круга видов.[2]
Общие механизмы TTFL
TTFL - это петля отрицательной обратной связи, в которых гены часов регулируются их белковыми продуктами. Как правило, TTFL включает два основных направления: положительные регулирующие элементы, которые способствуют транскрипция и белковые продукты, подавляющие транскрипцию. Когда положительный регуляторный элемент связывается с часами промотор гена, транскрипция продолжается, в результате чего создается мРНК стенограмма, а затем перевод протекает, в результате чего получается белковый продукт. Имеются характерные задержки между накоплением транскриптов мРНК, накоплением белка и подавлением генов из-за динамики трансляции, посттрансляционная модификация белка, димеризация белков и внутриклеточное путешествие к ядро.[3] У всех видов белки, участвующие в TTFL, содержат общие структурные мотивы, такие как PAS домены, участвует в белок-белковых взаимодействиях, и bHLH домены, участвует в связывании ДНК.[4]
Как только достаточное количество модифицированных белковых продуктов накапливается в цитоплазма, они транспортируются в ядро, где они ингибируют положительный элемент от промотора, чтобы остановить транскрипцию часовых генов. Таким образом, ген часов транскрибируется на низких уровнях до тех пор, пока его белковые продукты не расщепляются, что позволяет положительным регуляторным элементам связываться с промотором и перезапускать транскрипцию. Петля отрицательной обратной связи TTFL имеет множество свойств, важных для клеточных циркадных часов. Во-первых, это приводит к суточным ритмам как транскрипции гена, так и изобилия и размера белка, вызванного задержкой между трансляцией и отрицательной регуляцией гена. Период цикла или время, необходимое для завершения одного цикла, остается неизменным у каждого человека и, за исключением мутаций, обычно составляет около 24 часов. Это позволяет стабильно увлечение к 24-часовому циклу света и темноты, который испытывает Земля. Кроме того, белковые продукты часовых генов контролируют нижестоящие гены, которые не являются частью петли обратной связи, позволяя часам создавать суточные ритмы в других процессах, таких как метаболизм, в организме.[3] Наконец, TTFL - это предельный цикл, что означает, что это замкнутый цикл, который вернется к своей фиксированной траектории, даже если он будет нарушен, поддерживая колебательный путь в течение фиксированного 24-часового периода.[5]
Выдающиеся модели
Наличие TTFL высоко консервативно у всех видов животных; однако многие игроки, вовлеченные в процесс, изменились с течением времени эволюции в пределах разных видов. При сравнении растений, животных, грибов и других эукариот наблюдаются различия в генах и белках, участвующих в TTFL. Это говорит о том, что часы, соответствующие модели TTFL, эволюционировали несколько раз за время существования жизни.[6]
| Drosophila melanogaster | |
|---|---|
| Положительные регуляторы | CYC, Часы |
| Отрицательные регуляторы | TIM, PER |
| Млекопитающие | |
| Положительные регуляторы | BMAL1, ЧАСЫ |
| Отрицательные регуляторы | PER1, PER2, CRY1, CRY2 |
| Нейроспора | |
| Положительные регуляторы | WC-1. WC-2 |
| Отрицательные регуляторы | FRQ |
Drosophila melanogaster
TTFL был впервые обнаружен в Дрозофила, и система разделяет несколько компонентов с TTFL млекопитающих. Транскрипция часовых генов, Период (за) и Вневременный (Тим), инициируется, когда положительные элементы Цикл (dCYC) и Часы (dCLK) образуют гетеродимер и связывают Промоутеры электронной коробки, инициируя транскрипцию. В течение дня ТИМ деградирует; Световое воздействие способствует перееданию CRY в TIM, что приводит к убиквитинизации и возможной деградации TIM.[7] В течение ночи TIM и PER могут образовывать гетеродимеры и медленно накапливаться в цитоплазме, где PER фосфорилируется киназой. ДВОЙНОЙ ВРЕМЯ (DBT). Посттранскрипционная модификация множества фосфатных групп нацелена на комплекс для деградации и способствует ядерной локализации. В ядре димер PER-TIM связывается с димером CYC-CLK, который заставляет димер CYC-CLK высвобождаться из E-боксов и ингибирует транскрипцию. После разрушения PER и TIM димеры CYC-CLK снова способны связывать E-боксы, чтобы инициировать транскрипцию, замыкая петлю отрицательной обратной связи.[8]
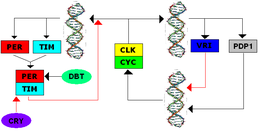
Вторичные петли обратной связи взаимодействуют с этой первичной петлей обратной связи. CLOCKWORK ORANGE (CWO) связывает E-боксы, чтобы действовать как прямой конкурент CYC-CLK, тем самым подавляя транскрипцию. PAR-ДОМЕННЫЙ БЕЛК 1 ε (PDP1ε) является активатором обратной связи, а VRILLE (VRI) является ингибитором обратной связи промотора Clk, и их экспрессия активируется с помощью dCLK-dCYC. Индуцированный экдизоном белок 75 (E75) ингибирует clk выражение и Тим-зависимо активирует per транскрипция. Все эти вторичные петли усиливают первичный TTFL.[8]
Криптохром в Дрозофила это фоторецептор синего света, который запускает деградацию TIM, косвенно приводя к сбросу фазы часов и возобновлению продвижения на выражение.[8]
Млекопитающие
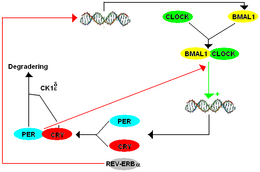
Модель TTFL млекопитающих содержит много компонентов, которые являются гомологами компонентов, обнаруженных у Drosophila. Система млекопитающих работает так: BMAL1 образует гетеродимер с ЧАСЫ инициировать транскрипцию мПер и криптохром (плакать). Есть три паралога или исторически схожие гены, которые теперь появляются как дупликации период ген у млекопитающих, перечисленных как mPer1, mPer2, и mPer3. Есть также два паралога криптохрома у млекопитающих. Белки PER и CRY образуют гетеродимер, а фосфорилирование PER с помощью CK1δ и CK1ε регулирует локализацию димера в ядре. В ядре PER-CRY негативно регулирует транскрипцию своих родственных генов, связывая BMAL1-CLOCK и вызывая их высвобождение из промотора E-box.[8]
Хотя мПер паралоги работают вместе как функциональный ортолог dPer, каждый из них выполняет особую функцию. mPer1 и mPer2 необходимы для работы часов в мозгу, а mPer3 играет заметную роль только в циркадных ритмах периферических тканей. Выбивание либо mPer1 или же mPer2 вызывает изменение периода, с mPer1 нокауты произвольно с меньшим периодом и mPer2 нокауты в свободном беге с более длительным периодом по сравнению с исходным тау, прежде чем в конечном итоге станут аритмическими. По аналогии, mCry1 нокауты приводят к сокращению периода и mCry2 нокауты приводят к удлинению периода с двойным mCry1/ мCry2 нокауты приводят к аритмичности.[8]
У млекопитающих также есть вторичные петли, хотя они более сложные, чем у млекопитающих. Дрозофила. Как CWO в Дрозофила, Удалено при раке пищевода1,2 (Dec1 Dec2) подавить мПер экспрессия путем связывания E-боксов, что предотвращает связывание CLOCK-BMAL1 их целей. Рецепторы REV-ERB и ОРФАНОВЫЙ РЕЦЕПТОР, СВЯЗАННЫЙ С РЕТИНОВОЙ КИСЛОТОЙ (ROR), играют роль, аналогичную PDP1ε и VRI в Дрозофила, за исключением того, что они регулируют партнера CLOCK по связыванию BMAL1 вместо того, чтобы напрямую регулировать CLOCK. D-ELEMENT BINDING PROTEIN (DBP) и E4 BINDING PROTEIN (E4BP4) связываются с последовательностью промотора D-Box для регулирования мПер выражение.[8]
Как эти гены связаны с Drosophila melanogaster проявляется в функции каждого из генов и в том, как они эволюционно изменились. BMAL1 является ортолог из ЦИКЛ. Это означает, что BMAL1 и CYCLE имеют общую историю, но встречаются у разных видов. Еще один пример параллелей между Drosophila melanogaster и млекопитающие также встречаются в плакать и мПер поскольку они являются функциональными ортологами на и Тим.[8]
Грибы: Нейроспора
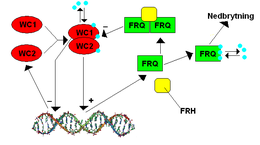
Ген частота (frq) в Нейроспора был идентифицирован как второй известный ген часов в 1979 году Дж. Фельдманом и его коллегами. Frq был впервые клонирован в 1989 году CR McClung и его коллегами. Этот ген представлял особый интерес, потому что его экспрессия очень сложна по сравнению с другими известными микробными генами. Два положительных белка-регулятора, БЕЛЫЙ ОШЕЙНИК-1 (WC-1) и БЕЛЫЙ ОШЕЙНИК-2 (WC-2) связывают промотор frq, который называется Clock Box, поздней субъективной ночью для активации транскрипции. Свет также важен для индукции экспрессии FRQ; WC-1 представляет собой фотопигмент, и свет позволяет WC-1 и WC-2 связывать другой промотор, называемый проксимальным элементом светового ответа (PLRE). Белок FRQ отрицательно регулирует активность WC-1 и WC-2. Некоторые киназы (CK1, CK2 и PRD-4 / киназа контрольной точки 2) и фосфатазы (PP1 и PP2A) регулируют способность FRQ перемещаться в ядро и стабильность FRQ, WC-1 и WC-2.[9]
Растения: Арабидопсис
Первая модель TTFL была предложена для Арабидопсис в 2001 г. и включали два фактора транскрипции MYB: ПОЗДНИЙ УДЛИНЕННЫЙ ГИПОКОТИЛ (LHY), ЦИРКАДИАНСКИЕ ЧАСЫ, АССОЦИАЦИЯ 1 (CCA1) и ВРЕМЯ ЭКСПРЕССИИ КАБИНЫ 1 (TOC1). CCA1 и LHY экспрессируются утром и взаимодействуют вместе, подавляя экспрессию TOC1. Экспрессия CCA1 и LHY снижается в темноте, позволяя TOC1 экспрессировать и негативно регулировать экспрессию CCA1 и LHY. CCA1 и LHY также могут связываться со своим собственным промотором для репрессии собственной транскрипции.[10]
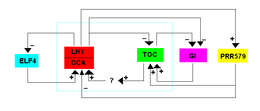
Вторая петля существует с участием PRR9, PRR7 и PRR5, которые все являются гомологами TOC1 и подавляют экспрессию CCA1 и LHY. Эти гены PRR напрямую репрессируются LHY и TOC1. Эти гены также регулируются «вечерним комплексом» (EC), который образован LUX ARRHYTHMO (LUX), RARLY FLOWERING 3 (ELF3) и RARLY FLOWERING 4 (ELF4). LUX представляет собой фактор транскрипции с функцией, аналогичной MYB, тогда как ELF3 и ELF4 являются ядерными белками, функции которых неизвестны. «Вечерний комплекс» косвенно способствует экспрессии LHY и CCA1, которые подавляют транскрипцию его собственных компонентов. Поскольку эта модель состоит из двух ингибиторов, ведущих к активации, ее также называют репрессилятором.[10]
Недавно обнаруженный цикл включает подъем (подъем) семейство генов, которые экспрессируются утром и индуцируют транскрипцию вечерних генов, таких как PRR5, TOC1, LUX и ELF4. Как только полученные белки транслируются, PRR9, PRR7 и PRR5 репрессируют RVE8. RVE8 также взаимодействует с НОЧНЫМ СВЕТОМ И РЕГУЛИРУЕМЫМ ЧАСОМ (LNK1, 2, 3 и 4) утренними компонентами, при этом LNK либо антагонизируют, либо совместно активируют RVE8.[10]
Хотя GIGANTEA (GI) не известен как основная часть Арабдопсис Модель TTFL подавляется CCA1, LHY и TOC1. Кроме того, GI активирует экспрессию CCA1 и LHY.[10]
Цианобактерии
Исследования часов цианобактерий привели к открытию трех основных генов часов: KaiA, KaiB, и KaiC. Первоначально считалось, что эти белки следуют модели TTFL, аналогичной модели, предложенной для эукария, так как наблюдались ежедневные закономерности в изобилии мРНК и белков и уровне фосфорилирования, отрицательная обратная связь белков с их родственными генами, сброс фазы часов в ответ на сверхэкспрессию KaiC и изменение активности Kai посредством взаимодействия друг с другом.[11] Каждый из этих результатов соответствовал пониманию TTFL в то время. Однако более поздние исследования с тех пор пришли к выводу, что посттрансляционные модификации, такие как фосфорилирование, более важны для контроля часов. Когда промоторы для белков Kai были заменены неспецифическими промоторами, не было прерывания центральной петли обратной связи, как можно было бы ожидать, если бы ингибирование происходило через обратную связь белков на их специфические промоторы. Как следствие, было установлено, что модель TTFL в значительной степени неточна для цианобактерий; регуляция транскрипции не является центральным процессом, управляющим ритмами цианобактерий. Хотя транскрипционная и трансляционная регуляция присутствует, они были сочтены скорее эффектами часов, чем необходимыми для их работы.[12]
Альтернативы модели TTFL
Посттрансляционные петли обратной связи (PTFL), участвующие в регуляции часовых генов, также были обнаружены, часто работая в тандеме с моделью TTFL. Как у млекопитающих, так и у растений посттрансляционные модификации, такие как фосфорилирование и ацетилирование, регулируют количество и / или активность часовых генов и белков. Например, было показано, что уровни фосфорилирования компонентов TTFL ритмично изменяются. Эти посттрансляционные модификации могут служить сигналами деградации, регуляторами связывания и сигналами для привлечения дополнительных факторов.[13]
Примечательно, что цианобактерии демонстрируют ритмичные 24-часовые изменения фосфорилирования в петле обратной связи, которая не зависит от транскрипции и трансляции: циркадные ритмы фосфорилирования наблюдаются, когда белки Kai петли обратной связи помещаются в пробирку с АТФ, независимо от каких-либо других клеточных механизмов. . Эта трехбелковая посттрансляционная система широко принята в качестве основного генератора, необходимого и достаточного для управления суточными ритмами.[14] В дополнение к системе Kai у цианобактерий, окисление белков пероксиредоксина, как было показано, происходит независимо от транскрипции и трансляции как в эритроцитах млекопитающих, так и в водорослях. Остреококк Таури клетки; эта система сохраняется у многих организмов.[15] Неясно, взаимодействует ли система пероксиредоксина с часами на основе TTFL или сама является частью новых часов на основе PTFL. Однако оба этих открытия подразумевают, что у некоторых организмов или типов клеток PTFL достаточно для управления циркадными ритмами.
Смотрите также
Рекомендации
- ^ Mergenhagen D (2001). «Циркадные ритмы у одноклеточных организмов». Актуальные темы микробиологии и иммунологии. Справочник по поведенческой нейробиологии. Springer США. 90: 123–47. Дои:10.1007/978-1-4615-1201-1_4. ISBN 9781461512011. PMID 6775877.
- ^ Вулунд Л., Редди А.Б. (декабрь 2015 г.). «Краткая история циркадного времени: появление окислительно-восстановительных колебаний как нового компонента биологических ритмов». Перспективы в науке. 6: 27–37. Дои:10.1016 / j.pisc.2015.08.002.
- ^ а б Hastings MH, Maywood ES, O'Neill JS (сентябрь 2008 г.). «Циркадная кардиостимуляция клеток и роль цитозольных ритмов». Текущая биология. 18 (17): R805 – R815. Дои:10.1016 / j.cub.2008.07.021. PMID 18786386.
- ^ Данлэп Дж. С., Лорос Дж. Дж., Лю Й., Кростуэйт С.К. (январь 1999 г.). «Циркадные системы эукариот: общие циклы». Гены в клетки. 4 (1): 1–10. Дои:10.1046 / j.1365-2443.1999.00239.x. PMID 10231388.
- ^ Шередос Б (2013). «Научные диаграммы как следы группового познания: краткий когнитивно-исторический анализ». Материалы ежегодного собрания Общества когнитивных наук. 35 (35).
- ^ Лаудон А.С. (июль 2012 г.). «Циркадная биология: часы возрастом 2,5 миллиарда лет». Текущая биология. 22 (14): R570-1. Дои:10.1016 / j.cub.2012.06.023. PMID 22835791.
- ^ Йоши Т., Герман-Луибл К., Хельфрих-Фёрстер С. (02.01.2016). «Циркадные пути поступления света у дрозофилы». Коммуникативная и интегративная биология. 9 (1): e1102805. Дои:10.1080/19420889.2015.1102805. ЧВК 4802797. PMID 27066180.
- ^ а б c d е ж грамм Андреани Т.С., Ито Т.К., Йилдирим Э., Хванбо Д.С., Аллада Р. (декабрь 2015 г.). «Генетика циркадных ритмов». Клиники медицины сна. 10 (4): 413–21. Дои:10.1016 / j.jsmc.2015.08.007. ЧВК 4758938. PMID 26568119.
- ^ Данлэп Дж. К., Лорос Дж. Дж., Колот Х. В., Мехра А., Белден В. Дж., Ши М., Хонг К. И., Ларрондо Л. Ф., Бейкер С. Л., Чен С. К., Швердтфегер С., Коллопи П. Д., Гэмсби Дж. Дж., Ламбрегтс Р. (2007). «Циркадные часы в Neurospora: как гены и белки взаимодействуют, чтобы произвести устойчивый, увлекаемый и компенсированный биологический осциллятор с периодом около суток». Симпозиумы Колд-Спринг-Харбор по количественной биологии. 72: 57–68. Дои:10.1101 / sqb.2007.72.072. ЧВК 3683860. PMID 18522516.
- ^ а б c d Санчес С.Е., Кей С.А. (декабрь 2016 г.). «Циркадные часы растений: от простого хронометриста до сложного менеджера по развитию». Перспективы Колд-Спринг-Харбор в биологии. 8 (12): a027748. Дои:10.1101 / cshperspect.a027748. ЧВК 5131769. PMID 27663772.
- ^ Джонсон CH, Мори Т., Сюй Y (сентябрь 2008 г.). "Цианобактериальный циркадный часовой механизм". Текущая биология. 18 (17): R816 – R825. Дои:10.1016 / j.cub.2008.07.012. ЧВК 2585598. PMID 18786387.
- ^ Шередос Б (2013). «Научные диаграммы как следы группового познания: краткий когнитивно-исторический анализ». Материалы ежегодного собрания Общества когнитивных наук. 35 (35).
- ^ Кодзима С., Шингл Д.Л., Грин CB (февраль 2011 г.). «Посттранскрипционный контроль циркадных ритмов». Журнал клеточной науки. 124 (Pt 3): 311–20. Дои:10.1242 / jcs.065771. ЧВК 3021995. PMID 21242310.
- ^ Херли Дж. М., Лорос Дж. Дж., Данлэп Дж. С. (октябрь 2016 г.). «Циркадные осцилляторы: вокруг контура обратной связи транскрипции-трансляции и на выходе». Тенденции в биохимических науках. 41 (10): 834–846. Дои:10.1016 / j.tibs.2016.07.009. ЧВК 5045794. PMID 27498225.
- ^ Браун С.А., Ковальска Э., Даллманн Р. (март 2012 г.). «(Повторное) изобретение циркадной петли обратной связи». Клетка развития. 22 (3): 477–87. Дои:10.1016 / j.devcel.2012.02.007. PMID 22421040.
