Карбоксилатный комплекс переходного металла - Transition metal carboxylate complex

Карбоксилатные комплексы переходных металлов находятся координационные комплексы с участием карбоксилат (RCO2−) лиганды. Отражая разнообразие карбоновых кислот, количество карбоксилатов металлов велико. Многие из них полезны в коммерческих целях, и многие из них привлекли пристальное внимание ученых. Карбоксилаты проявляют множество способов координации, наиболее распространенными являются κ1- (O-монодентатный), κ2 (O, O-двузубые) и мостиковые.
- Структуры из отобранных ацетатов металлов

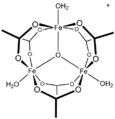
Ацетат серебра
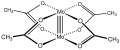
Ацетат молибдена (II), иллюстрирующий четверную связь Mo-Mo.[1]
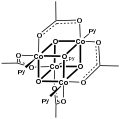
[CoO (ацетат)]4, "Das Cubane "
Для простых карбоксилатов ацетатные комплексы являются иллюстративными. Большинство ацетатов переходных металлов представляют собой комплексы со смешанными лигандами. Один из распространенных примеров - гидратированный никель ацетат, Ni (O2CCH3)2(ЧАС2O)4, который имеет внутримолекулярную водородную связь между некоординированными атомами кислорода и протонами акво-лиганд. Стехиометрически простые комплексы часто бывают мультиметаллическими и включают основные ацетаты металлов, в состав которых входят оксидные лиганды.[2]
Бинарные диацетаты металлов, т.е. комплексы, содержащие только ацетатные лиганды, часто принимают форму Структура китайского фонаря. Хорошо изученные примеры включают диметаллические тетракарбоксилаты (M2(OAc)4) где M = Cu (II), Rh (II), Cr (II) и Mo (II). Диацетат платины и диацетат палладия образуют необычные конструкции, состоящие из платина квадратной формы4 и Pd3 ядра, иллюстрирующие способность ацетата стабилизировать мультиметаллические структуры.
Реакции и заявки
Ацетаты металлов распространены катализаторы или предварительные катализаторы. Особенно полезны липофильные комплексы этилгексаноаты.
Ди- и поликарбоксилаты
Оксалатные комплексы
- Строение некоторых оксалатных комплексов металлов.

[Cr2(оксалат)5]4-.
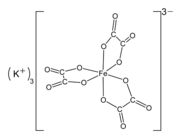
Ферриоксалат калия (K
3[Fe (C
2О
4)
3] · 3H2О)
Оксалиплатин, противораковый препарат

[Zr (оксалат)4]4-
Оксалат (C2О42-) представляет собой отличительный дикарбоксилат. Как малый симметричный (D2ч) динегативный ион, оксалат обычно образует пятичленный МО2C2 хелатные кольца. Оксалат редко образует четырехчленный МО.2Кольца C. Наиболее распространены смешанные лигандные комплексы, например [Co (C2О4) (NH3)4]κ +.[3]
Гомолептические комплексы типа [M (κ2-C2О4)3]н- известны для M = V (III), Mn (III),[4] Cr (III), Tc (IV), Fe (III), Ru (III), Co (III), Rh (III), Ir (III). Эти анионы хиральные (D3 симметрия), и многие из них были разделены на составляющие их энантиомеры. Некоторые ранние металлы образуют тетракисные комплексы типа [M (κ2-C2О4)4]3- M = Nb (V),[5] Zr (IV),[6] Hf (IV),[7] Та (В),[8] Оксалат стабилизирует многие биядерные и полиядерные комплексы с (κ2, κ '2-C2О4) M2 ядра. Гомолептические биядерные комплексы иллюстрируются [M2(C2О4)5]2- M = Fe (II)[9] и Cr (III)[10]
Оксалатные комплексы металлов являются фотоактивными, разлагаются с потерей углекислый газ. Эта реакция используется в технике, называемой актинометрия, в котором используется ферриоксалат. УФ-облучение Pt (C2О4) (PPh3)2 дает производные от Pt (0) (PPh3)2.
Бензолди- и трикарбоксилаты
Металлоорганические каркасы представляют собой пористые трехмерные координационные полимеры, состоящие из кластеров карбоксилатов металлов. Эти кластеры, называемые вторичными связующими звеньями (SBU), часто связаны конъюгированными основаниями бензолди- и трикарбоновых кислот.[11]
Аминополикарбоксилаты
- Избранные комплексы карбоксилатов
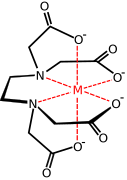
металлический комплекс с EDTA анион
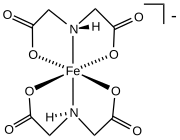
Бис (иминодиацетат) железа

Активный сайт гемеритрина, O2-содержащий карбоксилат железа
Коммерчески важным семейством карбоксилатов являются аминополикарбоксилаты, наиболее известные комплексы EDTA 4-. С этими синтетическими хелатирующими агентами связаны аминокислоты которые образуют большие семьи аминокислотные комплексы. Две аминокислоты, глутамат и аспартат, имеют боковые цепи карбоксилата. Эти боковые цепи функционируют как лиганды железа в некоторых негемовых белках железа, таких как гемеритрин.[12]
использованная литература
- ^ Brignole, Alicia B .; Коттон, Ф. А. (1972). «Соединения рения и молибдена, содержащие четверные связи». Неорганические синтезы. 13: 81–89. Дои:10.1002 / 9780470132449.ch15.
- ^ Каттерик, Джанет; Торнтон, Питер (1977). Строение и физические свойства полиядерных карбоксилатов.. Успехи неорганической химии и радиохимии. 20. С. 291–362. Дои:10.1016 / S0065-2792 (08) 60041-2. ISBN 9780120236206.
- ^ Бернал, Иван; Четрулло, Джеймс (1990). «Явление кристаллизации конгломератов. XIX. Клавишная диссимметрия в координационных соединениях. XVII». Структурная химия. 1 (2–3): 235–243. Дои:10.1007 / BF00674267. S2CID 96021604.
- ^ Лис, Т .; Матушевский, J. (1980). «Структура тригидрата трис (оксалато) манганата (III) калия». Acta Crystallographica Раздел B Структурная кристаллография и кристаллохимия. 36 (8): 1938–1940. Дои:10.1107 / S0567740880007558.
- ^ Cotton, F. A .; Диболд, Майкл П .; Рот, В. Дж. (1987). «Переменная стереохимия восьмикоординатного тетракис (оксалато) ниобата (IV), Nb (C2О4)44-". Неорганическая химия. 26 (17): 2889–2893. Дои:10.1021 / ic00264a035.
- ^ Фу, Юнь-Лун; Рен, Цзя-Линь; Сюй, Чжи-Вэй; Нг, Сейк Вен (2005). «Бис (4,4'-бипиридиний) Тетракис (оксалато-κ2O, O ') цирконат (IV)». Acta Crystallographica Section e Отчеты о структуре онлайн. 61 (11): m2397 – m2399. Дои:10.1107 / S1600536805033829.
- ^ Tranqui, D .; Boyer, P .; Laugier, J .; Вуллиет, П. (1977). "Структура кристаллического дю-тетракизоксалатогафниата пентагидрата калия [K4Hf (C2O4) 4.5H2O]". Acta Crystallographica Раздел B Структурная кристаллография и кристаллохимия. 33 (10): 3126–3133. Дои:10.1107 / S0567740877010395.
- ^ Перич, Берислав; Брничевич, Невенка; Юрич, Марияна; Планинич, Павица; Маткович-Чалогович, Дубравка (2009). "[NH4] [(CH3)2NH2] 2 [Ta (C2О4)4] · 2H2O: Первый структурно охарактеризованный комплекс (оксалато) танталата (V) ". Структурная химия. 20 (5): 933–941. Дои:10.1007 / s11224-009-9494-0. S2CID 96838371.
- ^ Арментано, Донателла; Де Мунно, Джованни; Льорет, Франсеск; Джульве, Мигель (2005). «Бис- и трис (оксалато) феррат (III) комплексы как предшественники полиядерных соединений». CrystEngComm. 7 (7): 57. Дои:10.1039 / b417251e.
- ^ Мастерс, Ванесса М .; Шаррад, Клинт А .; Bernhardt, Paul V .; Gahan, Lawrence R .; Мубараки, Бужемаа; Мюррей, Кейт С. (1998). "Синтез, структура и магнетизм оксалато-мостикового комплекса хрома (III) [NBun4] 4 [Cr2(бык)5] · 2CHCl3". Журнал химического общества, Dalton Transactions (3): 413–416. Дои:10.1039 / a705265k.
- ^ Tranchemontagne, David J .; Мендоса-Кортес, Хосе Л .; о'Киф, Майкл; Яги, Омар М. (2009). «Вторичные строительные элементы, сетки и связующие в химии металлоорганических каркасов». Обзоры химического общества. 38 (5): 1257. Дои:10.1039 / b817735j. PMID 19384437.
- ^ Ясневски, Эндрю Дж .; Ку, Лоуренс (2018). «Активация диоксида с помощью ферментов Nonheme Diiron: различные аддукты диоксида, промежуточные соединения с высоким валентным давлением и родственные модельные комплексы». Химические обзоры. 118 (5): 2554–2592. Дои:10.1021 / acs.chemrev.7b00457. ЧВК 5920527. PMID 29400961.