Металлический углекислый комплекс - Википедия - Metal carbon dioxide complex
Углекислотные комплексы металлов координационные комплексы, содержащие углекислый газ лиганды. Помимо фундаментального интереса к координационная химия простых молекул, исследования в этой области мотивированы возможностью того, что переходные металлы могут катализировать полезные превращения CO2. Это исследование актуально как для органический синтез и производству «солнечного топлива», которое позволит избежать использования топлива на основе нефти.[1]
Структурные тенденции
 Иллюстративные структуры комплексов диоксида углерода переходных металлов, слева: Ni (η2-CO2) (PCy3)2, Rh (η1-CO2) ClL4 (L4 = (дневники )2), сложный эфир металлакарбоновой кислоты CpFe (CO)2(η1: η1-CO2) Re (CO)5и другой диметалла-сложный эфир.
Иллюстративные структуры комплексов диоксида углерода переходных металлов, слева: Ni (η2-CO2) (PCy3)2, Rh (η1-CO2) ClL4 (L4 = (дневники )2), сложный эфир металлакарбоновой кислоты CpFe (CO)2(η1: η1-CO2) Re (CO)5и другой диметалла-сложный эфир.
Двуокись углерода связывается с металлами только несколькими способами. Режим связывания зависит от электрофильности и основности металлического центра.[2] Наиболее распространенным является η2-CO2 режим координации, показанный на примере комплекса Ареста, Ni (CO2)(PCy3 )2, который был первым описанным комплексом CO2.[3][4] Этот квадратно-планарное соединение является производным Ni (II) с восстановленным CO2 лиганд. В редких случаях CO2 связывается с металлами как База Льюиса через его кислородные центры, но такие аддукты слабые и представляют в основном теоретический интерес. Также известны различные многоядерные комплексы, часто включающие основание Льюиса и Льюис кислый металлы, например металлакарбоксилатные соли (C5ЧАС2) Fe (CO)2CO2−K+. В многоядерных случаях (соединения, содержащие более одного металла) наблюдаются более сложные и разнообразные координационные геометрии. Одним из примеров является несимметричное соединение, содержащее четыре рений центры, [(CO)5ReCO2Re (CO)4]2.[нужна цитата ] Двуокись углерода также может связываться с лигандами на металлическом комплексе (а не только с металлом), например путем превращения гидроксильных лигандов в карбонатные лиганды.[нужна цитата ]
Реакции
Переходный металл комплексы диоксида углерода претерпевают множество реакций. Металлакарбоновые кислоты протонируют при кислороде и в конечном итоге превращаются в карбонил металла комплексы:
- [LпMCO2]− + 2 часа+ → [LпMCO]+ + H2О
Эта реакция имеет отношение к потенциальной каталитической конверсии CO2 к топливу.[5]
Карбонизация связей металл-углерод
Вставка в связи Cu-C
N-гетероциклический карбен (NHC) поддерживает Cuя комплексы катализируют карбоксилирование борорганических эфиров.[6] Катализатор образует на месте из CuCl, лиганда NHC, и KOтБу. Медь терт-бутоксид может трансметаллат с борорганический эфир для создания Cuя-С связь, которую промежуточное соединение может вставлять в СО2 плавно, чтобы получить соответствующий карбоксилат. Метатезис солей с КОтBu выделяет продукт и регенерирует катализатор (схема 2).

Помимо трансметаллирования, существуют другие подходы к образованию связи Cu-C. Функционализация C-H - простой и экономичный метод. Основание может помочь депротонировать кислотные протоны C-H и образовать связь Cu-C. [(Фенантролин ) Cu (PR3)] катализатор влияет на карбоксилирование C-H на концевые алкины вместе с Cs2CO3.[7] Соединения NHC-Cu-H депротонируют кислотный протон для карбоксилирования концевых алкинов.[8] Частицы Cu-H были получены из Cu-F и органосиланы. Карбоксилатный продукт улавливали силилфторидом с получением силилового эфира. Для некислотных связей C-H направленное металлирование с яБу3Применяется Al (TMP) Li с последующим трансметаллированием медью для получения связи Cu-C. Аллильный C-H связи и фенил C-H-связи карбоксилировали с помощью этого подхода Хоу и его сотрудников:[9][10]

Карбометаллирование до алкинов и аллены с помощью цинкорганический и алюминийорганический реагенты с последующим трансметаллированием до меди также являются стратегией инициирования карбоксилирования. Триметилалюминий способен вставляться в несмещенные алифатические внутренние алкины с синхронизацией, управляемой группой, управляющей эфиром. Комплексы винил с медью образуются путем трансметаллирования, и карбоксилирование осуществляется аналогичным путем с образованием тетразамещенных алифатических винилкарбоновых кислот.[11] В этом случае региоселективность контролируется образованием шестичленного алюминиевого кольца. Кроме того, карбоксилирование инамидов и алленамидов может быть достигнуто с использованием менее реакционноспособного диметилцинка с помощью аналогичного подхода.[12][13]
Вставка в связи Pd-C
В присутствии ацетат палладия под 1-30 бар CO2простые ароматические соединения превращаются в ароматические карбоновые кислоты.[14][15][16][17][18] Лиганд PSiP-клещи (5) способствует карбоксилированию аллена без использования предварительно функционализированных субстратов.[19] Регенерация катализатора, Et3Al был добавлен для трансметаллирования палладием. Катализатор регенерируется следующими способами удаление β-H. Помимо концевых алленов, некоторые из внутренних алленов также допускаются в этой реакции, образуя аллилкарбоновую кислоту с выходом от 54% до 95%. Эта система также была применена к 1,3-диену, образуя карбоновую кислоту путем 1,2-присоединения.[20] В 2015 году Ивасава и другие. сообщил о германий аналог (6) и комбинированный CO2 источник вместе с источником гидрида для формиата солей.[21]
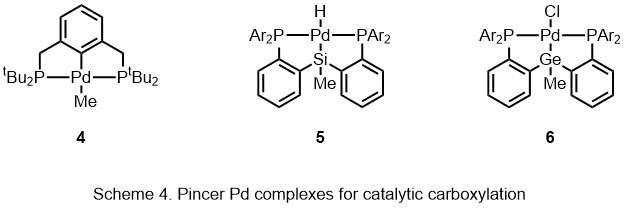
Палладий продемонстрировал огромную способность катализировать C-H функционализация. Если промежуточное соединение Pd-C в реакции карбоксилирования происходит в результате активации C-H, такая методология должна способствовать карбоксилированию, катализируемому металлами, до гораздо более высокого уровня полезности. Ивасава с соавторами сообщили о прямом карбоксилировании путем активации стиренил C-H с образованием производных кумарина.[22] Бензольные кольца с разными электронными свойствами и некоторые гетероароматический кольца допустимы в этой реакции с выходом от 50% до 90%. Активация C-H была продемонстрирована кристаллография изучать.
Вставка связями Rh-C
Подобно химии Cu (I), упомянутой выше, комплексы Rh (I) также могут трансметаллировать с арилбороновыми эфирами с получением промежуточных арилродиевых соединений, в которые CO2 вставлен, давая карбоновые кислоты.[23] Позже Ивасава и другие. описал стратегию карбоксилирования C-H. Rh (I) подвергается окислительному присоединению к арильной C-H связи с последующим трансметаллированием с помощью соединений алкилалюминия. Ar-Rh (I) регенерируется путем восстановительного удаления с высвобождением метана. Ar-Rh (I) атакует CO2 затем трансметаллатов с арилбороновой кислотой с высвобождением бороновой кислоты продукта с образованием конечной карбоновой кислоты путем гидролиза. Достигаются как направленные, так и ненаправленные версии.[24][25][26]
Ивасава и его сотрудники разработали реакцию карбонизации, катализируемую Rh (I), инициированную введением Rh-H в виниларены. Чтобы регенерировать реактивный Rh-H после нуклеофильного добавления к CO2, фотокаталитический перенос электронов с протонами подход был принят.[27] В этой системе избыточное количество диэтилпропилэтиламина работает как жертвенный донор электронов (схема 5).

Вставка Ni-C связкой
Сообщалось о карбоксилировании бензилгалогенидов.[28] Предполагается, что механизм реакции включает окислительное присоединение бензилхлорида к Ni (0). Бензильный комплекс Ni (II) восстанавливается до Ni (I), например, цинком, который вводит CO2 доставка карбоксилата никеля. Восстановление карбоксилата Ni (I) до Ni (0) высвобождает карбоксилат цинка (схема 6). Подобным образом такое карбоксилирование было достигнуто для арила и бензилпивалата,[29] алкилгалогениды,[30][31] и аллиловые эфиры.[32]

Рекомендации
- ^ «Двуокись углерода как химическое сырье» под редакцией Микеле Ареста. Wiley-VCH, Weinheim, 2010. ISBN 978-3-527-32475-0.
- ^ Гибсон, Дороти Х. (1996). "Металлоорганическая двуокись углерода химии". Chem. Rev. 96 (6): 2063–2095. Дои:10.1021 / cr940212c.
- ^ Ареста, Микеле; Гобетто, Роберто; Каранта, Эухенио; Tommasi, Immacolata (октябрь 1992 г.). «Связь-реакционная способность для (диоксида углерода) бис (трициклогексилфосфин) никеля: сравнительное исследование ядерного магнитного резонанса в твердом растворе (фосфор-31, углерод-13) в качестве диагностического инструмента для определения режима связывания диоксида углерода. к металлическому центру ». Неорганическая химия. 31 (21): 4286–4290. Дои:10.1021 / ic00047a015.
- ^ Юнг, Чарльз С .; Донг, Вай М. (июнь 2008 г.). «За пределами комплекса Aresta: цинковоорганическое соединение, катализируемое никелем и палладием, с CO». Журнал Американского химического общества. 130 (25): 7826–7827. Дои:10.1021 / ja803435w.
- ^ Бенсон, Эрик Э .; Kubiak, Clifford P .; Сатрам, Аарон Дж .; Смейджа, Джонатан М. (2009). «Электрокаталитический и гомогенный подходы к конверсии CO2 на жидкое топливо ». Chem. Soc. Rev. 38 (1): 89–99. Дои:10.1039 / b804323j.
- ^ Охиси, Такеши; Нисиура, Масаёши; Хоу, Чжаомин (21 июля 2008 г.). «Карбоксилирование борорганических эфиров, катализируемое комплексами N-гетероциклического карбена и меди (I)». Angewandte Chemie International Edition. 47 (31): 5792–5795. Дои:10.1002 / anie.200801857.
- ^ Gooßen, Lukas J .; Родригес, Нурия; Манджолиньо, Филипе; Ланге, Пол П. (22 ноября 2010 г.). «Синтез пропиоловых кислот посредством катализируемого медью введения диоксида углерода в связь C-H концевых алкинов». Расширенный синтез и катализ. 352 (17): 2913–2917. Дои:10.1002 / adsc.201000564.
- ^ Фуджихара, Тецуаки; Сюй, Тинхуа; Семба, Кадзухико; Терао, июн; Цудзи, Ясуши (10 января 2011 г.). «Катализируемое медью гидрокарбоксилирование алкинов с использованием диоксида углерода и гидросиланов». Angewandte Chemie International Edition. 50 (2): 523–527. Дои:10.1002 / anie.201006292.
- ^ Уэно, Ацуши; Такимото, Масанори; O, Wylie W. N .; Нисиура, Масаёши; Икария, Такао; Хоу, Чжаомин (апрель 2015 г.). «Катализируемое медью формальное C-H карбоксилирование ароматических соединений диоксидом углерода через промежуточные арилалюминий». Химия: азиатский журнал. 10 (4): 1010–1016. Дои:10.1002 / asia.201403247.
- ^ Уэно, Ацуши; Такимото, Масанори; Хоу, Чжаомин (2017). «Синтез 2-арилоксибутеноатов катализированным медью аллильным C – H-карбоксилированием аллилариловых эфиров диоксидом углерода». Орг. Biomol. Chem. 15 (11): 2370–2375. Дои:10.1039 / C7OB00341B.
- ^ Такимото, Масанори; Хоу, Чжаомин (19 августа 2013). «Меди-катализируемое формальное метилирование и гидрогенизирующее карбоксилирование алкинов углекислым газом: эффективный синтез α, β-ненасыщенных карбоновых кислот». Химия - Европейский журнал. 19 (34): 11439–11445. Дои:10.1002 / chem.201301456.
- ^ Голап, Сандип Сурьябхан; Такимото, Масанори; Хоу, Чжаомин (13 июня 2016 г.). «Региоселективное алкилирующее карбоксилирование алленамидов диоксидом углерода и диалкилцинковыми реагентами, катализируемое комплексом N-гетероциклический карбен-медь». Химия - Европейский журнал. 22 (25): 8547–8552. Дои:10.1002 / chem.201601162.
- ^ Такимото, Масанори; Голап, Сандип Сурьябхан; Хоу, Чжаомин (19 октября 2015). "Катализируемое медью алкилирование карбоксилирования инамидов диалкилцинковыми реагентами и диоксидом углерода". Химия - Европейский журнал. 21 (43): 15218–15223. Дои:10.1002 / chem.201502774.
- ^ Сугимото, Хироши; Кавата, Итару; Танигучи, Хироши; Фудзивара, Юзо (май 1984 г.). «Предварительное сообщение: Карбоксилирование ароматических соединений, катализируемое палладием, диоксидом углерода». Журнал металлоорганической химии. 266 (3): c44 – c46. Дои:10.1016 / 0022-328X (84) 80150-3.
- ^ Ши, Мин; Николас, Кеннет М. (май 1997 г.). «Карбоксилирование аллилстаннанов, катализируемое палладием». Журнал Американского химического общества. 119 (21): 5057–5058. Дои:10.1021 / ja9639832.
- ^ Йоханссон, Роджер; Джаренмарк, Мартин; Вендт, Ола Ф. (сентябрь 2005 г.). «Введение двуокиси углерода в связи (PCP) Pd-II-Me». Металлоорганические соединения. 24 (19): 4500–4502. Дои:10.1021 / om0505561.
- ^ Йоханссон, Роджер; Вендт, Ола Ф. (2007). «Введение CO2 в аллильную связь палладия и карбоксилирование аллилстаннанов, катализируемое Pd (II)». Dalton Trans. (4): 488–492. Дои:10.1039 / B614037H. PMID 17213935.
- ^ Джонсон, Магнус Т .; Йоханссон, Роджер; Кондрашов, Михаил В .; Стейл, Гидеон; Ahlquist, Mårten S.G .; Рудт, Андреас; Вендт, Ола Ф. (23 августа 2010 г.). "= Механизмы внедрения CO2 в (PCP) палладий аллил и метил сигма-связи. Кинетические и вычислительные исследования". Металлоорганические соединения. 29 (16): 3521–3529. Дои:10.1021 / om100325v.
- ^ Такая, Джун; Ивасава, Нобухару (19 ноября 2008 г.). "Гидрокарбоксилирование алленов CO2, катализируемое комплексом палладия силилового клещевого типа". Журнал Американского химического общества. 130 (46): 15254–15255. Дои:10.1021 / ja806677w. PMID 18942785.
- ^ Такая, Джун; Сасано, Кота; Ивасава, Нобухару (апрель 2011 г.). «Эффективное взаимно-однозначное связывание легко доступных 1,3-диенов с диоксидом углерода». Органические буквы. 13 (7): 1698–1701. Дои:10.1021 / ol2002094.
- ^ Чжу, Чуань; Такая, Джун; Ивасава, Нобухару (3 апреля 2015 г.). «Использование формиатных солей в качестве гидрида и источника со2 в гидрокарбоксилировании алленов, катализируемом комплексом PGeP-палладий». Органические буквы. 17 (7): 1814–1817. Дои:10.1021 / acs.orglett.5b00692. PMID 25794110.
- ^ Сасано, Кота; Такая, Джун; Ивасава, Нобухару (31 июля 2013 г.). «Катализируемое палладием (II) прямое карбоксилирование алкенильных связей C – H с помощью CO2». Журнал Американского химического общества. 135 (30): 10954–10957. Дои:10.1021 / ja405503y.
- ^ Укай, Кадзутоши; Аоки, Масао; Такая, Джун; Ивасава, Нобухару (01.07.2006). "Катализируемое родием (I) карбоксилирование арил- и алкенилбороновых эфиров с помощью CO2". Журнал Американского химического общества. 128 (27): 8706–8707. Дои:10.1021 / ja061232m. ISSN 0002-7863.
- ^ Мизуно, Хадзиме; Такая, Джун; Ивасава, Нобухару (09.02.2011). "Катализируемое родием (I) прямое карбоксилирование аренов с помощью CO2 посредством активации связи C-H с помощью хелатирования". Журнал Американского химического общества. 133 (5): 1251–1253. Дои:10.1021 / ja109097z. ISSN 0002-7863.
- ^ Шуга, Такуя; Мизуно, Хадзиме; Такая, Джун; Ивасава, Нобухару (23.10.2014). «Прямое карбоксилирование простых аренов с помощью CO2 через активацию связи C – H, катализируемую родием». Химические коммуникации. 50 (92): 14360–14363. Дои:10.1039 / C4CC06188H. ISSN 1364-548X.
- ^ Шуга, Такуя; Сайто, Таканобу; Такая, Джун; Ивасава, Нобухару (30 января 2017 г.). «Механистическое исследование катализируемого родием карбоксилирования простых ароматических соединений диоксидом углерода». Химическая наука. 8 (2): 1454–1462. Дои:10.1039 / C6SC03838G. ISSN 2041-6539. ЧВК 5460598. PMID 28616144.
- ^ Мурата, Кей; Нумасава, Нобуцугу; Шимомаки, Кацуя; Такая, Джун; Ивасава, Нобухару (09.03.2017). «Построение управляемого видимым светом цикла гидрококсилирования алкенов путем комбинированного использования Rh (I) и фотоокислительных катализаторов». Химические коммуникации. 53 (21): 3098–3101. Дои:10.1039 / C7CC00678K. ISSN 1364-548X. PMID 28243662.
- ^ Леон, Тьерри; Корреа, Аркаитц; Мартин, Рубен (30 января 2013 г.). «Катализируемое никелем прямое карбоксилирование бензилгалогенидов с помощью CO2». Журнал Американского химического общества. 135 (4): 1221–1224. Дои:10.1021 / ja311045f. ISSN 0002-7863. PMID 23301781.
- ^ Корреа, Аркаитц; Леон, Тьерри; Мартин, Рубен (22 января 2014 г.). «Катализируемое никелем карбоксилирование связей C (sp2) - и C (sp3) –O с помощью CO2». Журнал Американского химического общества. 136 (3): 1062–1069. Дои:10.1021 / ja410883p. HDL:2072/305833. ISSN 0002-7863. PMID 24377699.
- ^ Лю, Ю; Корнелла, Хосеп; Мартин, Рубен (13 августа 2014 г.). «Катализируемое никелем карбоксилирование неактивированных первичных алкилбромидов и сульфонатов с помощью CO2» (PDF). Журнал Американского химического общества. 136 (32): 11212–11215. Дои:10.1021 / ja5064586. HDL:2072/305831. ISSN 0002-7863. PMID 25068174.
- ^ Бёрьессон, Марино; Морагас, Тони; Мартин, Рубен (22.06.2016). «Катализируемое никелем карбоксилирование неактивированных алкилхлоридов с помощью CO2». Журнал Американского химического общества. 138 (24): 7504–7507. Дои:10.1021 / jacs.6b04088. HDL:2072/305936. ISSN 0002-7863. PMID 27269443.
- ^ Морагас, Тони; Корнелла, Хосеп; Мартин, Рубен (24 декабря 2014 г.). "Региодивергентное катализируемое никелем восстановительное карбоксилирование аллиловых эфиров с контролируемым лигандом с помощью CO2". Журнал Американского химического общества. 136 (51): 17702–17705. Дои:10.1021 / ja509077a. HDL:2072/305832. ISSN 0002-7863. PMID 25473825.

