Ацетилацетонаты металлов - Metal acetylacetonates
Ацетилацетонаты металлов находятся координационные комплексы полученный из ацетилацетонат-анион (CH
3COCHCOCH−
3) и ионов металлов, обычно переходные металлы. В двузубый лиганд ацетилацетонат часто сокращенно называют акас. Обычно оба атома кислорода связываются с металлом с образованием шестичленного хелатного кольца. Простейшие комплексы имеют формулу M (acac)3 и M (acac)2. Комплексы со смешанными лигандами, например VO (acac)2, также многочисленны. Также были разработаны варианты ацетилацетоната с множеством заместителей вместо метила (RCOCHCOR ′−).[1] Многие такие комплексы растворимы в органических растворители, в отличие от родственных галогенидов металлов. Благодаря этим свойствам комплексы acac иногда используются в качестве катализатор прекурсоры и реагенты. Приложения включают их использование в качестве ЯМР «реагенты сдвига» и как катализаторы для органический синтез, и предшественники промышленных гидроформилирование катализаторы. C
5ЧАС
7О−
2 в некоторых случаях также связывается с металлами через центральный атом углерода; этот способ связывания более характерен для переходных металлов третьего ряда, таких как платина (II) и иридий (III).
Синтез
Общий метод синтеза - обработка соли металла ацетилацетоном, acacH:[2]
- Mz+ + z Hacac ⇌ M (acac)z + z ЧАС+
Добавление основания способствует удалению протона из ацетилацетона и сдвигает равновесие в пользу комплекса. Оба кислородных центра связываются с металлом с образованием шестичленного хелатного кольца. В некоторых случаях хелатный эффект настолько прочен, что для образования комплекса не требуется никакой дополнительной основы. Некоторые комплексы получают путем метатезиса с использованием Tl (акас).
Классификация по триаде
Титановая триада
Лечение TiCl4 с ацетилацетоном дает СНГ -TiCl2(acac)2, красный октаэдрический комплекс с C2 симметрия:
- TiCl4 + 2 Hacac → TiCl2(acac)2 + 2 HCl
Эта реакция не требует основания. Комплекс TiCl2(acac)2 является флюсионным в растворе, спектр ЯМР демонстрирует единственный метильный резонанс при комнатной температуре.[3]
В отличие от Ti (IV), Zr (IV) и Hf (IV) связывают четыре бидентатных ацетилацетоната, отражая больший радиус этих металлов. Гафния ацетилацетонат и ацетилацетонат циркония принять квадратные антипризматические конструкции.
Ванадиевая триада

Ванадил ацетилацетонат синий комплекс с формулой V (O) (acac)2. В этом комплексе есть ванадил (IV) группа и многие родственные соединения известны. Молекула квадратно-пирамидальная, с идеализированным C2v симметрия. Комплекс катализирует эпоксидирование аллиловых спиртов пероксидами. Ацетилацетонат ванадия (III) представляет собой твердое вещество темно-коричневого цвета. Комплексы β-дикетоната ванадия используются в качестве предкатализаторов при промышленном производстве этилен-пропилен-диеновых эластомеров (EPDM). Их часто оценивают для других приложений, связанных с проточными батареями окислительно-восстановительного потенциала, диабетом и повышением активности инсулина, а также в качестве предшественников неорганических материалов при сердечно-сосудистых заболеваниях.[4].
Хромовая триада
Ацетилацетонат хрома (III), Cr (acac)3, представляет собой типичный октаэдрический комплекс, содержащий три ака− лиганды. Как и большинство таких соединений, он хорошо растворяется в неполярных органических растворителях. Этот конкретный комплекс, который имеет три неспаренных электрона, используется в качестве агента спиновой релаксации для улучшения чувствительности в количественном отношении. углерод-13 ЯМР спектроскопия.[5] Ацетилацетонат хрома (II) это очень чувствительное к кислороду соединение светло-коричневого цвета. В комплексе применен квадратная планарная структура, слабо связанные в стопки в твердом состоянии. Изоморфен Pd (acac)2 и Cu (acac)2.[6]
Марганцевая триада

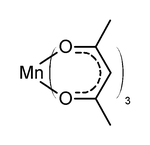
Он был подготовлен соразмерность соединения марганца (II) Mn (acac)2 с перманганат калия в присутствии дополнительного ацетилацетона.[7] Альтернативно прямая реакция ацетилацетона с перманганат калия.[8] С точки зрения электронной структуры Mn (acac)3 является высокое вращение. Его искаженная октаэдрическая структура отражает геометрические искажения из-за Эффект Яна – Теллера. Две наиболее распространенные структуры для этого комплекса включают одну с тетрагональным удлинением и одну с тетрагональным сжатием. Для удлинения две связи Mn – O имеют длину 2,12 Å, а остальные четыре - 1,93 Å. Для сжатия две связи Mn – O имеют длину 1,95 Å, а остальные четыре - 2,00 Å. Эффекты тетрагонального удлинения заметно более значительны, чем эффекты тетрагонального сжатия.[9]
Mn (acac)3одноэлектронный окислитель используется для сочетания фенолов.[10]
Железная триада
Ацетилацетонат железа (III), Fe (acac)3, это красный крутой комплекс, хорошо растворимый в органических растворителях. Это конфигурационно лабильный высокоспиновый комплекс с пятью неспаренными электронами. Иногда он используется в качестве предшественника катализатора.[11] Хотя конфигурационно лабильный, Fe (acac)3 частично разложился на Δ и Λ изомеры.[12] Железный комплекс Fe (acac)2 олигомерный.
Как и железо, Ru (III) образует очень стабильный трис (ацетилацетонат). Восстановление этого производного Ru (III) в присутствии других лигандов дает смешанные лигандные комплексы, например Ru (acac)2(алкен)2.[13]
Кобальтовая триада

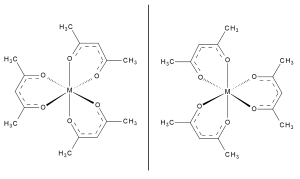
Co (acac)3 низкоспиновый диамагнитный комплекс. Как и другие соединения типа M (acac)3, этот комплекс хиральный (имеет неперекрывающееся зеркальное отображение). Многие такие комплексы были разрешены, но главный пример - Co (acac)3.[12]
Комплекс Co (acac)2, как и родственный никелевый комплекс, существуют октаэдрические комплексы с двумя дополнительными лигандами. Безводная форма существует как тетрамер [Co (acac)2]4. Подобно тримерному комплексу никеля, этот тетрамер проявляет ферромагнитные взаимодействия при низких температурах.[14]
Синтез Co (acac)3 предполагает использование окислителя:
- 2 CoCO3 + 6 Hacac + H2О2 → 2 Co (acac)3 + 4 часа2O + 2 CO2
Двумя наиболее популярными ацетилацетонатами родия являются: дикарбонил (ацетилацетонато) родий (I) и Rh (acac)3. Первый является обычным предшественником гомогенных катализаторов.
Ir (acac)3 и Rh (acac)3 известны. Известен второй связывающий изомер иридиевого комплекса, транс-Ir (acac)2(CH (COMe)2)(ЧАС2О). Этот C-связанное производное является предшественником гомогенных катализаторов для C – H активация и родственные химии.[15][16][17][18] Производные иридия (I) включают плоскоквадратный Ir (acac) (CO)2 (C2v симметрия).
Никелевая триада

Никель (II) бис (ацетилацетонат) существует как триметаллический комплекс [Ni (acac)2]3. Он реагирует с водой, давая октаэдрический аддукт [Ni (acac)2(ЧАС2O)2], мелово-зеленый монометаллический комплекс. Объемные бета-дикетонаты образуют красные, мономерные, квадратно-плоские комплексы.[19]
В отличие от сложного магнетизма и структур Ni (acac)2, бис (ацетилацетонат) платины (II) и бис (ацетилацетонат) палладия (II) являются диамагнитными монометаллическими частицами.
Медная триада
Cu (acac)2 готовится обработкой ацетилацетона водным Cu (NH
3)2+
4. Он коммерчески доступен, катализирует реакции сочетания и переноса карбена.
В отличие от производного меди (II) ацетилацетонат меди (I) является чувствительный к воздуху олигомерные виды. Он используется, чтобы катализировать Майкл дополнения.[20]
Цинковая триада
Моново-комплекс Zn (acac)2ЧАС2O (m.p. 138–140 ° C) является пятикоординатным, принимая квадратно-пирамидальную структуру.[21] Комплекс находит применение в органический синтез.[22] Дегидратация этого вида дает гигроскопичное безводное производное (т.пл. 127 ° C).[23] Это более летучее производное использовалось в качестве предшественника пленок ZnO.
Ацетилацетонаты других элементов
Бесцветный, диамагнитный Al (acac)3 структурно подобен другим трис-комплексам, например [Fe (acac)3]. Трисацетилацетонаты лантаноиды часто принимают координационные числа выше 8. В таких случаях производные acac− встречаются чаще.
Варианты acac
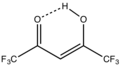
Многие варианты ацетилацетонатов хорошо разработаны. Гексафторацетилацетонаты и трифторацетилацетонаты образуют комплексы, которые часто структурно связаны с обычными ацетилацетонатами, но являются более кислотными по Льюису и более летучими. Комплекс Eufod, Европа (OCC (CH3)3CHCOC3F7)3, имеет сложный частично фторированный лиганд. Этот комплекс представляет собой кислоту Льюиса, образующую аддукты с множеством жесткий базы.
Один или оба кислородных центра в ацетилацетонате могут быть заменены группами RN, что приводит к образованию Nacac и Накнак лиганды.
C-связанные ацетилацетонаты
C
5ЧАС
7О−
2 в некоторых случаях также связывается с металлами через центральный атом углерода (C3); этот способ связывания более характерен для переходных металлов третьего ряда, таких как платина (II) и иридий (III). Комплексы Ir (acac)3 и соответствующие аддукты основания Льюиса Ir (acac)3L (L = an амин ) содержат один связанный углеродом лиганд acac. ИК-спектры О-связанные ацетилацетонаты характеризуются относительно низкой энергией νCO полосы 1535 см−1, тогда как в ацетилацетонатах с углеродными связями колебание карбонила происходит ближе к нормальному диапазону для кетонной C = O, то есть 1655 см−1.
Рекомендации
- ^ Альбрехт, М .; Schmid, S .; De Groot, M .; Weis, P .; Фрёлих, Р. (2003). «Самосборка неполярного энантиомерно чистого геликатного типа Metalla-cryptand». Chem. Comm. 2003 (20): 2526–2527. Дои:10.1039 / b309026d. PMID 14594263.
- ^ Р. К. Мехротра; Р. Бора; Д. П. Гаур (1978). Бета-дикетоны металлов и родственные производные. Академическая пресса. ISBN 0124881505.
- ^ Wilkie, C.A .; Lin, G .; Хаворт, Д. Т. (1979). СНГ- [Дигалобис (2,4-пентадионато) титана (IV)] комплексы. Неорг. Synth. Неорганические синтезы. 19. С. 145–148. Дои:10.1002 / 9780470132500.ch33. ISBN 9780470132500.
- ^ Махаев В.Д., Петрова Л.А. (2017). «Механохимический синтез β-дикетонатов ванадия (III)». Журнал общей химии (Русский журнал общей химии). 87: 1105–1109.CS1 maint: использует параметр авторов (связь)
- ^ Кайтан, Эльза; Ремод, Джеральд С .; Тенайло, Ева; Акока, Серж (2007). "Точные и точные количественные 1313 C ЯМР с уменьшенным временем эксперимента ». Таланта. 71 (3): 1016–1021. Дои:10.1016 / j.talanta.2006.05.075. PMID 19071407.
- ^ Cotton, F. A .; Rice, C.E .; Райс, Г. В. (1977). «Кристаллическая и молекулярная структура бис (2,4-пентандионато) хрома». Неорг. Чим. Acta. 24: 231–234. Дои:10.1016 / S0020-1693 (00) 93880-5.
- ^ Чарльз, Р. Г. (1963). Ацетилацетонат марганца (III). Неорг. Synth. Неорганические синтезы. 7. С. 183–184. Дои:10.1002 / 9780470132388.ch49. ISBN 9780470132388.
- ^ Girolami, G .; Rauchfuss, T .; Анджеличи, Р. Синтез и техника в неорганической химии, 3-е изд .; Научные книги университета: Саусалито, Калифорния, 1999; С. 85-92. ISBN 0-935702-48-2
- ^ Коттон, Ф. Альберт; Уилкинсон, Джеффри; Мурильо, Карлос А .; Бохманн, Манфред (1999), Продвинутая неорганическая химия (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Снайдер, Б. Б. (2001). «Ацетилацетонат марганца (III)». В пакете, Л. (ред.). Энциклопедия реагентов для органического синтеза. Нью-Йорк, штат Нью-Йорк: J. Wiley & Sons. Дои:10.1002 / 047084289X.rm022. ISBN 0471936235.
- ^ Richert, S.A .; Цанг, П. К. С .; Сойер, Д. Т. (1989). «Лиганд-центрированные окислительно-восстановительные процессы для марганца, железа и кобальта, MnL3, FeL3, и CoL3, комплексы (L = ацетилацетонат, 8-хинолинат, пиколинат, 2,2'-бипиридил, 1,10-фенантролин) и их тетракис (2,6-дихлорфенил) порфинатокомплексы [M (Por)] ". Неорг. Chem. 28 (12): 2471–2475. Дои:10.1021 / ic00311a044.
- ^ а б Леннартсон, Андерс (2011). "Оптическое разрешение и рацемизация [Fe (acac)3]". Неорг. Чим. Acta. 365: 451–453. Дои:10.1016 / j.ica.2010.07.066.
- ^ Bennett, M.A .; Heath, G.A .; Hockless, D. C. R .; Ковачик, И .; Уиллис, А. С. (1998). «Алкеновые комплексы двухвалентного и трехвалентного рутения, стабилизированные хелатированием. Зависимость согласованной ориентации алкенов от состояния окисления металла». Варенье. Chem. Soc. 120 (5): 932–941. Дои:10.1021 / ja973282k.
- ^ Врещ, В. Д .; Х. Чжан, Ж.-Х. Ян; Филатов, А. С .; Дикарев, Э. В. (2010). «Мономерный квадратно-плоский ацетилацетонат кобальта (II): загадка или ошибка?». Неорг. Chem. 49 (18): 8430–8434. Дои:10.1021 / ic100963r. PMID 20795642.
- ^ Bennett, M.A .; Митчелл, Т. Р. Б. (1976). «2,4-пентандионатные комплексы трехвалентного иридия с γ-углеродными связями». Неорг. Chem. 15 (11): 2936–8. Дои:10.1021 / ic50165a079.
- ^ Bhalla, G .; Oxgaard, J .; Годдард, У. А .; Периана, Рой А. (2005). «Гидровинилирование олефинов, катализируемое иридиевым комплексом посредством активации CH» (PDF). Металлоорганические соединения. 24 (23): 5499–5502. Дои:10.1021 / om050614i.
- ^ Wong-Foy, A.G .; Bhalla, G .; Лю, X. Y .; Периана, Р.А. (2003). «Активация алкана C – H и катализ комплексом лигированного иридия с донором O». Варенье. Chem. Soc. 125 (47): 14292–14293. Дои:10.1021 / ja037849a. PMID 14624574.
- ^ Тенн, Уильям Дж .; Янг, Кеннет Дж. Х .; Бхалла, Гаурав; Оксгаард, Йонас; Годдард, Уильям А .; Периана, Рой А. (2005). «Активация CH с O-донорным комплексом иридий-метоксо» (PDF). Варенье. Chem. Soc. 127 (41): 14172–14173. Дои:10.1021 / ja051497l. PMID 16218597.
- ^ Деринг, А .; Goddard, R .; Jolly, P.W .; Krüger, C .; Поляков, В. Р. (2007). «Изомерия мономера и тримеров в 3-замещенных пентан-2,4-дионовых производных никеля (II)». Неорг. Chem. 36 (2): 177–183. Дои:10.1021 / ic960441c.
- ^ Parish, E.J .; Ли, С. (2004). «Ацетилацетонат меди (I)». В пакете, Л. (ред.). Энциклопедия реагентов для органического синтеза, 8 томов. Энциклопедия реагентов для органического синтеза. Нью-Йорк, штат Нью-Йорк: J. Wiley & Sons. Дои:10.1002 / 047084289X.rc203. ISBN 0471936235.
- ^ Montgomery, H .; Лингафельтер, Э. К. (1963). «Кристаллическая структура моноаквобисацетилацетонатоцинка». Acta Crystallographica. 16 (8): 748–752. Дои:10.1107 / S0365110X6300195X.
- ^ Барта, Н. (2004). «Бис (ацетилацетонато) цинк (II)». В пакете, Л. (ред.). Энциклопедия реагентов для органического синтеза, 8 томов. Энциклопедия реагентов для органического синтеза. Нью-Йорк, штат Нью-Йорк: J. Wiley & Sons. Дои:10.1002 / 047084289X.rb097. ISBN 0471936235.
- ^ Рудольф, G .; Генри, М. К. (1967). «Бис (2,4-пентандионато) цинк (ацетилацетонат цинка)». Неорг. Synth. 10: 74–77. Дои:10.1002 / 9780470132418.ch14.