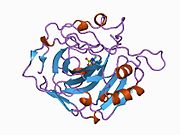
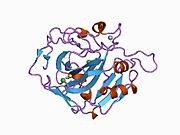
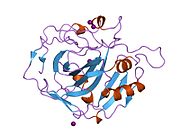
CA1 (ген) - CA1 (gene)
Карбоангидраза 1 является фермент что у людей кодируется CA1 ген.[5][6]
Карбоангидразы (CA) представляют собой большое семейство металлоферментов цинка, которые катализируют обратимую гидратацию углекислый газ. Они участвуют во множестве биологических процессов, в том числе клеточное дыхание, кальцификация, кислотно-щелочной баланс, резорбция костей и образование водянистой влаги, спинномозговая жидкость, слюна, и Желудочный сок.
Они демонстрируют большое разнообразие в распределении тканей и их субклеточной локализации. CA1 тесно связан с генами CA2 и CA3 на хромосома 8, и он кодирует цитозольный белок, который находится на самом высоком уровне в эритроциты. В литературе описаны варианты транскриптов CA1, использующие альтернативные polyA_sites.[6]
Структура
Белок CA1 человека содержит N-конец активный сайт, сайт связывания цинка и сайт связывания субстрата.[7] В Кристальная структура человеческого CA1-бикарбонат анионный комплекс обнаруживает геометрию двух Водородные связи между Glu 106-Thr 199 и Glu117-Его 119 пар и одна пи-Н-связь между молекулой воды и фенильное кольцо из Тюр 114 остатков. В ингибирование продукта CA1 через бикарбонат анионы коррелирует с изменением локализации протона на His119. Таким образом, считается, что Н-связь Glu117-His119 регулирует ионность иона цинка и силу связывания бикарбонат-аниона.[8]
Механизм
Реакция, катализируемая CA1, такая же, как и у других белков семейства карбоангидразы:
(в ткани - высокий CO2 концентрация)[9]
Реакция, катализируемая СА1, имеет относительно низкую сродство реакции (км) 4,0 мМ для CO2,[7][10] номер оборота (Kcat) из 2×105 s−1, и каталитическая эффективность (Kcat / Km) из 5×107 M−1s−1 по сравнению с другими изоферменты семейства α-КА карбоангидраз. Скорость оборота и каталитическая скорость CA1 составляет всего около 10% от CA2 (Kcat: 1.4×106 s−1, Kcat / км: 1.5×108 M−1s−1).[11]
Функция
Карбоангидраза 1 принадлежит к подсемейству α-CA и локализована в цитозоль из Красная кровяная клетка, Желудочно-кишечный тракт, сердечные ткани и другие органы или ткани.[12] Трансмембранный транспорт бикарбоната, продуцируемого КА, вносит значительный вклад в клеточную pH регулирование.[13]
В активированном цинком человеке вариант CA1, Мичиганский вариант, сингл точечная мутация изменения Его 67 к Arg в критической области активного сайта. Этот вариант цинка металлофермент По-видимому, уникален тем, что обладает активностью эстеразы, которая особенно усиливается добавлением свободных ионов цинка.[14]
Клиническое значение
Активация CA1 связана с ухудшением патологического ремоделирования у человека. ишемический диабетик кардиомиопатия.[12] В сахарный диабет 2 типа пациенты с постинфарктная сердечная недостаточность кто перенес хирургическое коронарное вмешательство реваскуляризация уровни CA1 в миокарде были в шесть раз выше, чем у пациентов без диабета. Повышенная экспрессия CA1 в основном локализовалась в сердечный интерстиций и эндотелиальный клетки. Кроме того, высокое индуцированное глюкозой повышение уровня CA1 препятствует эндотелиальным клеткам. проницаемость и определяет эндотелиальные клетки апоптоз in vitro.[12]
CA1 также является посредником геморрагический сетчатка и сосуды головного мозга проницаемость через прекалликреин активация и фактор сериновой протеазы XIIa поколение. Эти явления вызывают пролиферативную диабетическую ретинопатия и диабетический макулярный отек прогрессирования, которые представляют собой основные причины потери зрения.[15]
Поскольку CA1 является важной терапевтической мишенью, разработка его ингибиторов будет способствовать лечению заболевания. По сравнению с другими членами семейства CA, CA1 имеет относительно низкое сродство к обычным ингибиторам CA.[16] Тем не менее, он имеет среднее сродство к ингибитору СА. сульфаниламиды.[нужна цитата ]
Взаимодействия
Было показано, что CA1 взаимодействует с:
Эти взаимодействия были подтверждены с помощью высокопроизводительный метод (один удар)
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000133742 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000027556 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Лоу Н., Эдвардс YH, Эдвардс М., Баттерворт PH (август 1991 г.). «Физическое картирование кластера гена карбоангидразы человека на хромосоме 8». Геномика. 10 (4): 882–8. Дои:10.1016 / 0888-7543 (91) 90176-Ф. PMID 1916821.
- ^ а б «Ген Entrez: карбоангидраза CA1 I».
- ^ а б «CA1 - Карбоангидраза 1 - Homo sapiens (человек) - ген и белок CA1». www.uniprot.org. Получено 2016-03-23.
- ^ Кумар В., Каннан К.К. (август 1994 г.). «Фермент-субстратные взаимодействия. Структура человеческой карбоангидразы I в комплексе с бикарбонатом». Журнал молекулярной биологии. 241 (2): 226–32. Дои:10.1006 / jmbi.1994.1491. PMID 8057362.
- ^ Угольная кислота имеет pKа около 6,36 (точное значение зависит от среды), поэтому при pH 7 протонируется небольшой процент бикарбоната. Увидеть угольная кислота для получения подробной информации о равновесии HCO−
3 + H+ ⇌ H2CO3 и H2CO3 ⇌ CO2 + H2О - ^ Briganti F, Mangani S, Scozzafava A, Vernaglione G, Supuran CT (октябрь 1999 г.). «Карбоангидраза катализирует гидратацию цианамида до мочевины: имитирует ли она физиологическую реакцию?». Журнал биологической неорганической химии. 4 (5): 528–36. Дои:10.1007 / s007750050375. PMID 10550681. S2CID 25890428.
- ^ Сильверман Д.Н., Линдског С (01.05.2002). «Каталитический механизм карбоангидразы: последствия лимитирующего протолиза воды». Отчеты о химических исследованиях. 21 (1): 30–36. Дои:10.1021 / ar00145a005.
- ^ а б c Торелла Д., Эллисон ГМ, Торелла М., Вичинанца С, Акила I, Иаконетти С., Скализ М., Марино Ф., Хеннинг Б.Дж., Льюис ФК, Гарри С., Ласкар Н., Куда Дж., Сальваторе Т., Наппи Дж., Индольфи К., Торелла Р. , Cozzolino D, Sasso FC (01.01.2014). «Активация карбоангидразы связана с ухудшением патологического ремоделирования при ишемической диабетической кардиомиопатии человека». Журнал Американской кардиологической ассоциации. 3 (2): e000434. Дои:10.1161 / JAHA.113.000434. ЧВК 4187518. PMID 24670789.
- ^ Альварес Б.В., Куон А.Л., Маллен Дж., Кейси-младший (01.01.2013). «Количественная оценка экспрессии гена карбоангидразы в желудочке гипертрофированного сердца и сердечной недостаточности». BMC Сердечно-сосудистые заболевания. 13: 2. Дои:10.1186/1471-2261-13-2. ЧВК 3570296. PMID 23297731.
- ^ Феррарони М., Тилли С., Бриганти Ф., Чегвидден В. Р., Супуран С. Т., Вибауэр К. Э., Ташиан Р. Э., Скоццафава А. (май 2002 г.). «Кристаллическая структура цинк-активированного варианта человеческой карбоангидразы I, Калифорния I, штат Мичиган 1: свидетельство наличия второго сайта связывания цинка, включающего координацию аргинина». Биохимия. 41 (20): 6237–44. Дои:10.1021 / bi0120446. PMID 12009884.
- ^ Гао ББ, Клермон А., Ладья С., Фонда С.Дж., Сринивасан В.Дж., Войтковски М., Фудзимото Дж.Г., Эйвери Р.Л., Арригг П.Г., Берселл С.Е., Айелло Л.П., Финер EP (февраль 2007 г.). «Внеклеточная карбоангидраза опосредует геморрагическую проницаемость сетчатки и церебральных сосудов посредством активации прекалликреина». Природа Медицина. 13 (2): 181–8. Дои:10,1038 / нм 1534. PMID 17259996. S2CID 14404913.
- ^ Supuran CT (февраль 2008 г.). «Карбоангидразы: новые терапевтические применения ингибиторов и активаторов». Обзоры природы. Открытие наркотиков. 7 (2): 168–81. Дои:10.1038 / nrd2467. PMID 18167490. S2CID 3833178.
- ^ Роллан Т., Ташан М., Шарлото Б., Певзнер С.Дж., Чжун К., Сахни Н. и др. (Ноябрь 2014 г.). "Карта человеческого взаимодействия в масштабе протеома". Ячейка. 159 (5): 1212–26. Дои:10.1016 / j.cell.2014.10.050. ЧВК 4266588. PMID 25416956.
- ^ Ван Дж, Хо К., Ма Л., Тан Л., Ли Д., Хуанг Х и др. (01.01.2011). «К пониманию сети взаимодействия белков в печени человека». Молекулярная системная биология. 7: 536. Дои:10.1038 / msb.2011.67. ЧВК 3261708. PMID 21988832.
- ^ Vinayagam A, Stelzl U, Foulle R, Plassmann S, Zenkner M, Timm J, Assmus HE, Andrade-Navarro MA, Wanker EE (сентябрь 2011 г.). «Направленная сеть взаимодействия белков для исследования внутриклеточной передачи сигнала». Научная сигнализация. 4 (189): RS8. Дои:10.1126 / scisignal.2001699. PMID 21900206. S2CID 7418133.
внешние ссылки
- Человек CA1 расположение генома и CA1 страница сведений о генах в Браузер генома UCSC.
дальнейшее чтение
- Ташиан Р. Э., Картер Н. Д. (1977). «Биохимическая генетика карбоангидразы». Достижения в генетике человека. 7: 1–56. Дои:10.1007/978-1-4757-0659-8_1. ISBN 978-1-4757-0661-1. PMID 827930.
- Хитрый WS, Ху PY (1995). «Карбоангидразы человека и дефицит карбоангидразы». Ежегодный обзор биохимии. 64 (1): 375–401. Дои:10.1146 / annurev.bi.64.070195.002111. PMID 7574487.
- Kendall AG, Tashian RE (июль 1977 г.). «Карбоангидраза I эритроцитов: наследственная недостаточность у человека». Наука. 197 (4302): 471–2. Дои:10.1126 / science.406674. PMID 406674.
- Каннан К.К., Нотстранд Б., Фридборг К., Левгрен С., Олссон А., Петеф М. (январь 1975 г.). «Кристаллическая структура карбоангидразы эритроцитов человека B. Трехмерная структура при номинальном разрешении 2,2-A» (PDF). Труды Национальной академии наук Соединенных Штатов Америки. 72 (1): 51–5. Дои:10.1073 / pnas.72.1.51. ЧВК 432238. PMID 804171.
- Доусон С.Дж., Белый Лос-Анджелес (май 1992 г.). «Лечение эндокардита Haemophilus aphrophilus ципрофлоксацином». Журнал инфекции. 24 (3): 317–20. Дои:10.1016 / S0163-4453 (05) 80037-4. PMID 1602151.
- Лоу Н., Брэди Х. Дж., Барлоу Дж. Х., Соуден Дж. С., Эдвардс М., Баттерворт PH (сентябрь 1990 г.). «Структура и паттерны метилирования гена, кодирующего карбоангидразу I человека». Ген. 93 (2): 277–83. Дои:10.1016 / 0378-1119 (90) 90236-К. PMID 2121614.
- Нода Ю., Сумитомо С., Хикосака Н., Мори М. (апрель 1986 г.). «Иммуногистохимические наблюдения за карбоангидразами I и II в слюнных железах человека и подчелюстном обструктивном адените». Журнал оральной патологии. 15 (4): 187–90. Дои:10.1111 / j.1600-0714.1986.tb00604.x. PMID 3088232.
- Барлоу Дж. Х., Лоу Н., Эдвардс Ю. Х., Баттерворт PH (март 1987 г.). "КДНК карбоангидразы I человека". Исследования нуклеиновых кислот. 15 (5): 2386. Дои:10.1093 / nar / 15.5.2386. ЧВК 340641. PMID 3104879.
- Эдвардс YH, Барлоу JH, Konialis CP, Povey S, Баттерворт PH (май 1986). «Присвоение гена, определяющего карбоангидразу человека, CAI, хромосоме 8». Анналы генетики человека. 50 (Пт 2): 123–9. Дои:10.1111 / j.1469-1809.1986.tb01030.x. PMID 3124707. S2CID 44919686.
- Lin KT, Deutsch HF (апрель 1974 г.). «Углекислые ангидразы человека. XII. Полная первичная структура изофермента C». Журнал биологической химии. 249 (8): 2329–37. PMID 4207120.
- Giraud N, Marriq C, Laurent-Tabusse G (1975). «[Первичная структура карбоангидразы эритроцитов человека B. 3. Последовательность фрагментов I и III CNBr (остатки 149-260)]». Биохимия. 56 (8): 1031–43. Дои:10.1016 / S0300-9084 (74) 80093-3. PMID 4217196.
- Андерссон Б., Найман П.О., Стрид Л. (август 1972 г.). «Аминокислотная последовательность карбоангидразы В эритроцитов человека». Сообщения о биохимических и биофизических исследованиях. 48 (3): 670–7. Дои:10.1016 / 0006-291X (72) 90400-7. PMID 4625868.
- Lin KT, Deutsch HF (март 1973 г.). «Карбоангидразы человека. XI. Полная первичная структура карбоангидразы B». Журнал биологической химии. 248 (6): 1885–93. PMID 4632246.
- Омото К., Уэда С., Горики К., Такахаши Н., Мисава С., Пагаран И.Г. (январь 1981 г.). «Популяционные генетические исследования филиппинских негритосов. III. Идентификация варианта карбоангидразы-1 с CA1 Гуам». Американский журнал генетики человека. 33 (1): 105–11. ЧВК 1684865. PMID 6781336.
- Chegwidden WR, Wagner LE, Venta PJ, Bergenhem NC, Yu YS, Tashian RE (1995). «Заметная активация цинком гидролиза сложного эфира путем мутации 67-His (CAT) в Arg (CGT) в активном центре карбоангидразы I человека». Человеческая мутация. 4 (4): 294–6. Дои:10.1002 / humu.1380040411. PMID 7866410. S2CID 21458184.
- Бекку С., Мотидзуки Х., Такаяма Э., Шиномия Н., Фукамачи Х., Ичиносе М., Тадакума Т., Ямамото Т. (декабрь 1998 г.). «Карбоангидраза I и II как маркер дифференциации энтероцитов толстой кишки человека и крысы». Исследования в области экспериментальной медицины. Zeitschrift für die Gesamte Experimentelle Medizin Einschliesslich Experimenteller Chirurgie. 198 (4): 175–85. Дои:10.1007 / s004330050101. PMID 9879596. S2CID 11297322.
- Puscas I, Coltau M, Baican M, Pasca R, Domuta G, Hecht A (2001). «Сосудосуживающие препараты повышают уровень карбоангидразы I в гладких мышцах сосудов, в то время как вазодилатирующие препараты снижают активность этого изофермента за счет прямого механизма действия». Лекарства, находящиеся в стадии экспериментальных и клинических исследований. 27 (2): 53–60. PMID 11392054.








![{displaystyle {ce {{CO2} + H2O -> [{} поверх {ce {карбоновой ~ ангидразы}}] H2CO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5dc04cbaad8785a9a141ee4bcf2beaca7d736863)