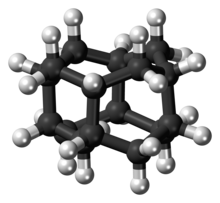
Диамантан - Diamantane
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Пентацикло [7.3.1.14,12.02,7.06,11] тетрадекан | |
| Другие имена Конгрессан, диадамантан, декагидро-3,5,1,7- [1,2,3,4] бутантетраилнафталин | |
| Идентификаторы | |
3D модель (JSmol ) | |
| 1904934 | |
| ChemSpider | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C14ЧАС20 | |
| Молярная масса | 188.314 г · моль−1 |
| Внешность | твердый белый кристалл |
| Плотность | 1,092 ± 0,06 г см−3 |
| Температура плавления | 244,73 ° С (472,51 ° F, 517,88 К) |
| Точка кипения | 269,5 ± 7,0 ° С |
| умеренно растворим (8,1 х 10−4 г L−1) | |
| Растворимость в диэтиловый эфир | растворимый |
| бревно п | 5.556 ± 0.228 |
| Давление газа | 0,0120 торр |
| Опасности | |
| Главный опасности | раздражающий, острая токсичность для водных организмов |
| Паспорт безопасности | Внешний паспорт безопасности материалов |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 98,1 ° С (208,6 ° F, 371,2 К) |
| Структура | |
| D3D | |
| 0 D | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Диамантан (также называемый конгрессмен) является органическое соединение это член алмазоиды. Это каркасные углеводороды со структурой, подобной субъединице решетки алмаза. Это бесцветное твердое вещество, которое было предметом исследований с момента его обнаружения в нефти и отделения от глубоких конденсатов природного газа. Алмазоиды, такие как диамантан, обладают необычными свойствами, включая низкую поверхностную энергию, высокую плотность, высокую гидрофобность и стойкость к окислению.[1]
Возникновение и история
Диамантан в природе встречается в сырой нефти. В настоящее время предполагается, что адамантаны и диамантаны образовались в результате каталитических перегруппировок полициклических нафтеновых углеводородов. Хотя алмазоиды, такие как диамантан, присутствуют в типичных нефтях только в следовых концентрациях, из-за их высокой термодинамической стабильности, они естественным образом концентрируются в результате катагенеза, становясь важными составляющими некоторых конденсатов природного газа, включая конденсаты из формации Норфлет, Мексиканского залива США и Западной Канадский бассейн.[2]
 Диамантан - второй член этого ряда алмазоидных углеводородов.
Диамантан - второй член этого ряда алмазоидных углеводородов.
Диамантан был выбран в качестве эмблемы Конгресса на встрече IUPAC в Лондоне в 1963 году и использовался в качестве украшения на обложках рефератов, программ и рекламных материалов. Перед участниками конгресса была поставлена задача синтезировать диамантан. Первое получение этого химического вещества было получено в 1965 году с выходом 1% путем катализируемой галогенидом алюминия изомеризации смеси фотодимеров норборнена. Адамантан был первым, а «конгрессан», как стали называть диамантан, был лишь вторым членом целого семейства соединений, известных как диамандоиды. Синтез третьего члена ряда в 1969 г. подчеркнул необходимость более общей схемы полутривиальной номенклатуры. Соединение было переименовано в «диамантан», а третий член был назван «триамантаном».[3]
1966 год также ознаменовался выделением диамантана из высококипящих фракций сырой нефти Годонина (из которого был открыт адамантан) и достижением значительного повышения его выхода (до 10%). Хотя это позволило начать изучение химического состава диамантана, углеводород по-прежнему было трудно получить в больших количествах. Затем диамантан стал таким же доступным, как и адамантан, и его химию стало легче изучать.[3]
Производство
Диамантан может быть получен перегруппировкой различных пентациклических тетрадеканов, катализируемой кислотой Льюиса. Наилучший выход (84%) может быть получен с транс-тетрагидро-Binor-S. Удобная процедура синтеза включает перегруппировку гидрированного соединения Binor-S, которая дает диамантан с выходом ~ 70%. Другие более деформированные предшественники дают диамантан с более низким выходом (1-47%) из-за диспропорционирования.[3]
Удобный синтетический путь начинается с димеризации норборнадиен (1) катализируемый смесью бромид кобальта -трифенилфосфин и эфират трифторида бора. Полученный димер (2) гидрируется с образованием тетрагидробинор-S-изомеров (3a – 3d). В результате стерического взаимодействия в основном 3а и 3b даны. Следующим этапом является перегруппировка, которая происходит в горячем растворе циклогексана или сероуглерода с бромидом алюминия и образует основной продукт диамантан (4).[4][5][6]

Диамантан можно получить термическим треск длинных цепей п-алканы. Считается, что механизм этого превращения - присоединение свободных радикалов. Хотя этот метод действительно дает диамантан, который был алкилирован (то есть монозамещенный, дизамещенный и тризамещенный метильными группами), производные адамантана также производятся в больших количествах из-за его большей термодинамической стабильности. Этот метод также дает гомологический ряд п-алканы с содержанием углерода до 35, а также кокс. Предположение о том, что диамандоидные соединения могут быть синтезированы путем термического крекинга, требует дополнительной проверки.[7]
Характеристики
Диамантан входит в состав диамандоидное семейство. Структуры этих элементов представляют собой сегменты кристаллической решетки алмаза:

Из-за его особой структуры температура плавления диамантана выше по сравнению с другими углеводородами. Другой результат - его высокая химическая и термическая стабильность.
| Энтальпия образования | Источник |
|---|---|
| [8] | |
| [8] |
Реакции
Диамантан можно нитровать путем обработки тетрафторборат нитрония (в нитрильном нитрометане) с получением смеси двух изомерных нитродиамантанов.[9]
Хлорирование хлорид алюминия и ацетилхлорид дает равные количества 1- и 4-хлордиамантана, тогда как использование хлорсульфоновая кислота дает в основном изомер 1-хлора. Гидролиз хлоридов дает соответствующие спирты, которые можно разделить с помощью колоночной хроматографии на оксиде алюминия.[10]
Рекомендации
- ^ Шрайнер, Питер; Фокин Андрей; Фокина Натали; Ткаченко, Борислав; Даль, Джереми; Карлсон, Роберт (2011). «Синтез диамондоидных карбоновых кислот». Синтез. 2012 (2): 259. Дои:10.1055 / с-0031-1289617.
- ^ Dahl, J. E .; Лю, SG; Карлсон, Р.М. (2002). «Выделение и структура высших диамондоидов, нанометровых молекул алмаза». Наука. 299 (5603): 96–9. Дои:10.1126 / science.1078239. PMID 12459548.
- ^ а б c Гунд, Тамара М .; Осава, Эйдзи; Уильямс, Ван Зандт; Шлейер, Пол В. Р. (1974). «Диамантан. I. Получение диамантана. Физические и спектральные свойства». Журнал органической химии. 39 (20): 2979. Дои:10.1021 / jo00934a009.
- ^ Gund, T. M .; Osawa, E .; Van Zandt, W. Jr .; Schleyer, P. v. R .: Диамантан. 1. Получение диамантана. Физические и спектральные свойства. В: Журнал органической химии, Band 39, Nr. 20, 1974, с. 2979–2987, DOI: 10.1021 / jo00934a009.
- ^ Gund, T. M .; Osawa, E .; Van Zandt, W. Jr .; Schleyer, P. v. R .: Удобный высокодоходный препарат диамантана (конгрессана). В: Буквы Тетраэдра, 1970, группа 11, № 44, С. 3877–3880, DOI: /10.1016/S0040-4039 (01) 98613-7.
- ^ Gund, T. M .; Thielecke, W .; Schleyer, P. v. R .: Диамантан: ПЕНТАЦИКЛО [7.3.1.14,12.02,7.06,11] ТЕТРАДЕКАН [бутантетраилнафталин, 3,5,1,7- [1,2,3,4] -декагидро-]. В: Органический синтез, Band 53, 1973, с. 30, DOI: 10.15227 / orgsyn.053.0030.
- ^ Гордадзе, Г. Н .; Гируц, М. В. (2008). «Синтез адамантановых и диамантановых углеводородов высокотемпературным крекингом высших н-алканов». Нефтехимия. 48 (6): 414. Дои:10.1134 / S0965544108060029.
- ^ а б Clark, T .; Knox, T. M .; McKervey, M.A .; Mackle, H .; Руни, Дж. Дж .:Термохимия мостиковых веществ. Энтальпии образования некоторых алмазоидных углеводородов и пергидрохинацена. Сравнение с данными эмпирических расчетов силового поля. В: Журнал Американского химического общества, Band 101, Nr. 9, 1979, С. 2404–2410, DOI: 10.1021 / ja00503a028.
- ^ Olah, G. A; Ramaiah, P .; Rao, C.B .; Sandford, G .; Golam, R .; Триведи, Н. Дж .; Олах, Дж. А. (1993). «Нитрование адамантана и диамантана тетрафторборатом нитрония». Варенье. Chem. Soc. 115 (16): 7246–7249. Дои:10.1021 / ja00069a024.
- ^ Т. Кортни; Д. Э. Джонстон; М. А. МакКервей; Дж. Дж. Руни (1972). «Химия диамантана: синтез и некоторые реакции функционализации». J. Chem. Soc. (1): 2691–2696. Дои:10.1039 / P19720002691.





