Реакция гидроборирования – окисления - Hydroboration–oxidation reaction
В органическая химия, то реакция гидроборирования – окисления это двухступенчатый реакция гидратации что превращает алкен в алкоголь.[1] Результатом процесса является синхронное дополнение водорода и гидроксил группа, где двойная связь был. Гидроборирование – окисление - это антимарковников реакция, при которой гидроксильная группа присоединяется к менее замещенному атому углерода. Таким образом, реакция дает больше стереоспецифический и дополнительные региохимический альтернатива другим реакциям гидратации, таким как кислотно-катализированный дополнение и оксимеркурация – восстановление процесс. О реакции впервые сообщил Герберт С. Браун в конце 1950-х[2] и это было признано в получении им Нобелевская премия по химии в 1979 г.
Общий вид реакции следующий:

Тетрагидрофуран (THF) является архетипом растворитель используется для гидроборирования.
Механизм и сфера применения
Стадия гидроборирования
На первом этапе боран (BH3) добавляет к двойная связь, перенося один из атомов водорода на углерод, соседний с тем, который становится связанным с бор. Этот гидроборирование повторяется еще два раза, последовательно реагируя на каждую связь B – H, так что три алкена добавляют к каждой BH3. Полученный триалкилборан обрабатывают перекисью водорода на второй стадии. В этом процессе связи B-C заменяются связями HO-C. Реагент бора превращается в борная кислота. Реакция была первоначально описана H.C. коричневый в 1957 г. для переоборудования 1-гексен в 1-гексанол.[3]

Зная, что группа, содержащая бор, будет заменена гидроксильной группой, можно видеть, что начальная стадия гидроборирования определяет региоселективность. Гидроборирование происходит в антимарковников манера. Последовательность реакций также стереоспецифический, давая синхронное дополнение (на той же стороне алкена): гидроборирование является син-селективным, а окисление заменяет бор гидроксилом, имеющим такое же геометрическое положение. Таким образом, 1-метилциклопентен реагирует с дибораном преимущественно с образованием транс-1-гидрокси-2-метилциклопентан[4]- вновь добавленные H и OH СНГ друг другу.
Пока все водороды, связанные с бором, не будут удалены, группа бора BH2 будет продолжать добавлять к большему количеству алкенов. Это означает, что один моль гидроборана вступит в реакцию с тремя молями алкена. Кроме того, гидроборан не обязательно должен иметь более одного водорода. Например, реагенты типа R2Обычно используются BH, где R может представлять собой остаток молекулы. Такие модифицированные реагенты гидроборирования включают: 9-BBN, катехолборан, и дизиамилборан.
Стадия окисления
На втором этапе последовательности реакций нуклеофильный гидропероксид анион атакует атом бора. Миграция алкила в кислород дает алкилборан с удержание стереохимии (в действительности реакция происходит через триалкил борат B (ИЛИ)3, а не моноалкилборный эфир BH2ИЛИ ЖЕ).

Атом H в реакции происходит от B2ЧАС6, атом 'O' происходит от перекиси водорода (H2О2), тогда как присоединенный к O атом 'H' происходит из растворителя (см. механизм).
Гидроборирование алкинов
Реакция гидроборирования также протекает на алкины. Опять же, способ действия син и вторичные продукты реакции альдегиды из концевых алкинов и кетоны из внутренних алкинов. Чтобы предотвратить гидроборирование обеих пи-связей, объемный боран, подобный дизиамил (ди-втор-изо-амил) боран используется.[5]
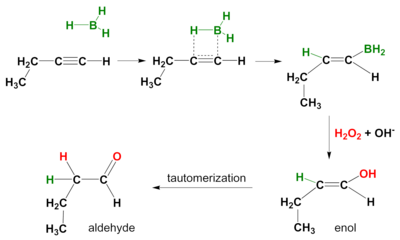
Альтернативные окисления
Использование других окислителей вместо перекиси водорода может привести к образованию карбонильных продуктов, а не спиртов из алкенов. N-Метилморфолин N-окись с каталитическим перрутенат тетрапропиламмония превращает алкилборан в карбонил, таким образом, кетон или альдегид продукт в зависимости от того, какие другие группы были присоединены к этому атому углерода в исходном алкене.[6] Разные дихроматы или связанные хром (VI) реагенты также дают кетоны, но дают карбоновые кислоты вместо альдегидов для концевых алкенов.[7]
Рекомендации
- ^ Лаудон, Марк Г. (2002). «Реакции присоединения алкенов». Органическая химия (Четвертое изд.). Нью-Йорк: Издательство Оксфордского университета. С. 168–172. ISBN 0-19-511999-1.
- ^ Brown, H.C .; Цвайфель, Г. (1959). «СТЕРЕОСПЕЦИФИЧЕСКОЕ УВЛАЖНЕНИЕ ДВОЙНОЙ СВЯЗИ CIS В ЦИКЛИЧЕСКИХ ПРОИЗВОДНЫХ». Журнал Американского химического общества. 81: 247. Дои:10.1021 / ja01510a059.
- ^ Brown, H .; Рао, Б. С. (1957). «Коммуникации - Селективное превращение олефинов в органобораны посредством конкурентных реакций гидроборирования, изомеризации и замещения». Журнал органической химии. 22 (9): 1137. Дои:10.1021 / jo01360a626.
- ^ Хоторн, М. Ф. (1961). "Амин бораны. VIII. Гидроборирование концевых олефинов, диенов и концевых ацетиленов с помощью триметиламин-трет-бутилборана". Журнал Американского химического общества. 83 (11): 2541–2544. Дои:10.1021 / ja01472a027.
- ^ Brown, H.C .; Гупта, С. К. (1972). «Катехолборан (1,3,2-бензодиоксаорол) как новый общий реагент моногидроборирования для алкинов. Удобный синтез эфиров алкенборной кислоты и кислот из алкинов посредством гидроборирования». Журнал Американского химического общества. 94 (12): 4370. Дои:10.1021 / ja00767a072.
- ^ Йейтс, Мэтью Х. (1997). «Однореакторное превращение олефинов в карбонильные соединения путем гидроборирования / окисления NMO – TPAP». Tetrahedron Lett. 38: 2813–2816. Дои:10.1016 / S0040-4039 (97) 00476-0.
- ^ Браун, Герберт С .; Кулкарни, Шекхар В .; Khanna, Vijay V .; Патил, Вирендра Д .; Рахерла, Удай С. (1992). «Органобораны для синтеза. 14. Удобные процедуры прямого окисления органоборанов от концевых алкенов до карбоновых кислот». J. Org. Chem. 57 (23): 6173–6177. Дои:10.1021 / jo00049a024.
внешняя ссылка
- Портал органической химии. Гидроборация (включая недавнюю литературу). https://www.organic-chemistry.org/ namedreactions/brown-hydroboration.shtm
