Лизин-2,3-аминомутаза - Википедия - Lysine 2,3-aminomutase
| Лизин-2,3-аминомутаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 5.4.3.2 | ||||||||
| Количество CAS | 9075-20-1 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Лизин-2,3-аминомутаза (КАМ или ЛАМ) (ЕС 5.4.3.2 ) это радикальный SAM фермент что облегчает преобразование аминокислота лизин к бета-лизин.[1][2][3][4] Это взаимное преобразование выполняется с помощью трех кофакторы и 5'-дезоксиаденозил радикал образовался в S-аденозил метионин (SAM) активировал радикальный путь реакции.[1] Обобщенная реакция показана ниже:

Структура
Справа показана трехмерная структура белка лизин-2,3-аминомутазы. Структура была определена Рентгеновская кристаллография до разрешения 2,1 Ангстрема и кристаллизовался в виде гомотетрамера.[2] КАМ был впервые очищен и охарактеризован в Clostridium субтерминал для изучения метаболизма лизина.
Кофакторы
Для реакции, катализируемой ферментом лизин-2,3-аминомутаза, необходимы четыре ключевых кофактора. Они есть:
- S-аденозил метионин (SAM): Помогает генерировать радикальный промежуточный продукт, заимствуя электрон.[5]
- Пиридоксальфосфат (PLP): отвечает за связывание аминокислоты во время реакции. Пи-система этой молекулы способствует радикальной делокализации при образовании азиридинильного радикала. Структура представлена ниже:
- Цинк металлический: Требуется для координации между димерами в белке.
- Железно-серный кластер: Кластер 4 железо-4 серы необходим для образования 5'-дезоксиаденозильного радикала. Затем этот радикал действует как «стабильный» радикальный носитель в механизме реакции, который передает радикал аминокислоте.
Механизм реакции
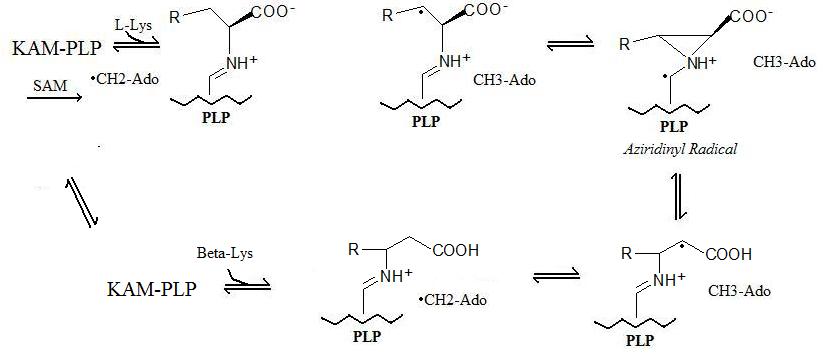
Обобщенная реакция проходит в 5 шагов:
- Радикальное образование: «Стабильный» радикал образуется через радикальный SAM механизм, в котором S-аденозилметионин образует 5'-дезоксиаденозильный радикал.
- Связывание ферментов: Лизин-2,3-аминомутаза связывается с пиридоксальфосфатом (PLP).
- Связывание аминокислот: Аминокислота (лизин или бета-лизин в зависимости от прямой или обратной реакции) связывается с пиридоксальфосфатом.
- Радикальный перенос: 5'-дезоксиаденозильный радикал переносится на аминокислоту и образуется азиридинильный радикал. В этой конфигурации радикал стабилизирован пи-системой пиридоксальфосфата.
- Конверсия аминокислот: На заключительном этапе образуется новая аминокислота, и радикал возвращается в более стабильное состояние на 5'-дезоксиаденозиле.
Описанный выше механизм реакции показан ниже:
Рекомендации
- ^ Фрей П.А. (май 1993 г.). «Лизин-2,3-аминомутаза: аденозилметионин - аденозилкобаламин для бедняков?». Журнал FASEB. 7 (8): 662–70. Дои:10.1096 / fasebj.7.8.8500691. PMID 8500691. S2CID 33374466.
- ^ Lepore BW, Ruzicka FJ, Frey PA, Ringe D (сентябрь 2005 г.). «Рентгеновская кристаллическая структура лизин-2,3-аминомутазы из Clostridium subterminale». Труды Национальной академии наук Соединенных Штатов Америки. 102 (39): 13819–24. Bibcode:2005PNAS..10213819L. Дои:10.1073 / pnas.0505726102. ЧВК 1236562. PMID 16166264.
- ^ Аберхарт DJ, Гулд SJ, Лин HJ, Thiruvengadam TK, Weiller BH (1981). «Стереохимия лизин-2,3-аминомутазы». Варенье. Chem. Soc. 103 (22): 6750–6752. Дои:10.1021 / ja00412a040.
- ^ Заппиа В., Баркер Х.А. (июнь 1970 г.). «Исследования лизин-2,3-аминомутазы. Субъединичная структура и сульфгидрильные группы». Biochimica et Biophysica Acta. 207 (3): 505–13. Дои:10.1016 / с0005-2795 (70) 80013-7. PMID 5452674.
- ^ Бхандари Д.М., Федосеенко Д., Бегли Т.П. (2018). "Механистические исследования радикального SAM-фермента триптофан-лиазы (NosL)". Радикальные ферменты SAM. Методы в энзимологии. 606. С. 155–178. Дои:10.1016 / bs.mie.2018.06.008. ISBN 9780128127940. PMID 30097091.
внешняя ссылка
- Лизин + 2,3-аминомутаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)

