ПОТЕБ - POTEB
| ПОТЕБ | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||
| Псевдонимы | ПОТЕБ, A26B1, CT104.5, POTE-15, POTE15, POTE член семейства анкириновых доменов B, POTEB2 | ||||||||||||||||||||||||
| Внешние идентификаторы | OMIM: 608912 ГомолоГен: 136720 Генные карты: ПОТЕБ | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ортологи | |||||||||||||||||||||||||
| Виды | Человек | Мышь | |||||||||||||||||||||||
| Entrez |
| ||||||||||||||||||||||||
| Ансамбль |
| ||||||||||||||||||||||||
| UniProt |
| ||||||||||||||||||||||||
| RefSeq (мРНК) |
| ||||||||||||||||||||||||
| RefSeq (белок) |
| ||||||||||||||||||||||||
| Расположение (UCSC) | Chr 15: 21,85 - 21,88 Мб | н / д | |||||||||||||||||||||||
| PubMed поиск | [2] | н / д | |||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Семейство доменов анкирина POTE, член B это белок у людей это кодируется ПОТЕБ ген.[3](Простата, Яичник, Семенники Выражено анкирин член семейства доменов B). Скорее всего, он участвует в посредничестве белок-белковое взаимодействие через 5 анкириновых доменов.[4] POTEB, скорее всего, помогает в внутриклеточная передача сигналов, но вряд ли это секретируемый или ядерный белок.[4] Функция POTEB, вероятно, будет регулироваться через 17 потенциальных фосфорилирование места.[5] В настоящее время нет доказательств того, что POTEB сигналы ядерной локализации.[6]
Ген
POTEB расположен по адресу 15q11.2 на хромосома 15 у человека и транскрибируется с обратной цепи ДНК. POTEB также известен как POTEB3 и POTE15.[7] В ПОТЕБ ген имеет длину 47 547 пар оснований и состоит из 11 экзоны.[7]

мРНК
В ПОТЕБ ген может быть записано создать четыре потенциальных мРНК. Однако только одна из этих мРНК, обладающая всеми 11 экзоны, может транслироваться в белок POTEB.[8] Три других транскрипта не кодируют белки.

Протеин
Белок POTEB состоит из 544 аминокислоты и, согласно биоинформатический анализов, имеет молекулярную массу 61,7 кДа. Имеет изоэлектрическая точка из 5,68.[9] Его наиболее распространенные аминокислоты: лейцин и глютаминовая кислота, на долю которых приходится 11% и 10,3% белка соответственно.[9] Однако для белков человека это нормально. POTEB, скорее всего, цитоплазматический белок[10] фосфорилируется по 17 серины, треонины, и тирозины расположен по всей длине белка,[5] но концентрируется на С-конце белка. это вторичная структура состоит в основном из пяти спиральных доменов с анкириновыми повторами, которые содержат мотив TALHL. Также есть один миристоилирование сайт на белке, близко к N-концу.[11]

Выражение
POTEB экспрессируется на высоком уровне в простате, яичниках и семенниках человека. Однако есть также свидетельства того, что он выражается на низких уровнях в эмбриональные стволовые клетки, носоглотка и ткани груди.[12][13] В эмбриональных стволовых клетках дифференцировка, вероятно, отключает экспрессию POTEB при раке груди, тройные отрицательные клетки Обнаружено, что экспрессия POTEB отсутствует, что указывает на роль в путях активации рака.[13]

В некоторых исследованиях использовались зонды POTEB для изучения экспрессии POTEB в человеческом мозге. Однако единственной областью с заметным выражением POTEB является кора мозжечка, отвечающий за двигательную функцию и некоторые когнитивные функции.[14]

Регулирование выражения
Экспрессия POTEB, вероятно, регулируется Факторы привязки электронного ящика и Крюппель-подобная транскрипция факторов, наряду с ядерным фактором каппа B (NF-κB ) факторы транскрипции.[15]
Экспрессия POTEB может регулироваться связыванием факторов транскрипции с интроном 1 пре-мРНК, что приводит к продукции укороченной мРНК, которая не транслируется. С другой стороны, экспрессия POTEB может подавляться за счет образования стержневые петли близко к стартовому кодону.[16] Нет известных убиквитинирование сайты в POTEB, которые могут помочь в регулировании функции и стабильности POTEB.

Функция
POTEB, скорее всего, участвует в посредничестве белок-белковое взаимодействие через 5 анкириновых доменов.[4] POTEB, скорее всего, помогает в внутриклеточная передача сигналов, но вряд ли это секретируемый или ядерный белок[4] поскольку вряд ли он будет содержать сигналы ядерной локализации.[6] Функция POTEB, вероятно, будет регулироваться через 17 потенциальных фосфорилирование места[5] которые определяют, как анкириновые домены взаимодействуют с другими белками.[17]
Белок-белковые взаимодействия
Не было опубликовано исследований, подтверждающих взаимодействие POTEB с другими белками человека. Однако есть неопубликованные данные, свидетельствующие о взаимодействии между POTEB и альфа-1-B гликопротеины, Факторы дополнения APOBEC1, и альфа-2-макроглобулин.[18] Эти данные основаны на аффинный захват - масс-спектрометрия.
Клиническое значение
По сравнению с другими типами клеток рака молочной железы экспрессия POTEB низкая или полностью снижена в трижды отрицательных клетках рака молочной железы.[13] Это предполагает участие POTEB во внутриклеточных сигнальных путях, подавляющих рак, или в путях, регулирующих нормальный рост и деление клеток.
Гомология
Паралоги
POTEB предсказал 8 паралоги (Согласно последовательности белка) у человека, причем большинство паралогов находится на разных хромосомах человека.[19][20] Предполагается, что это большое количество паралогов возникло из-за нескольких дублирование События.[10]
| Имя паралога | Регистрационный номер | % Идентичности | Аминокислоты | Хромосома № |
|---|---|---|---|---|
| POTE 15B | AAS58869.1 | 99 | 544 | Хромосома 15 |
| ПОТ С | NP_001131143.1 | 90 | 542 | Хромосома 18 |
| POTE H | NP_001129685.1 | 89 | 545 | Хромосома 22 |
| POTE J | NP_001264012.1 | 86 | 1038 | Хромосома 2 |
| POTE 14A | AAS58868.1 | 82 | 508 | Хромосома 14 |
| POTE G | NP_001005356.1 | 82 | 508 | Хромосома 14 |
| POTE E | XP_016859648.1 | 80 | 967 | Хромосома 2 |
| ПОТ I | NP_001264335.1 | 80 | 1075 | Хромосома 2 |
Ортологи
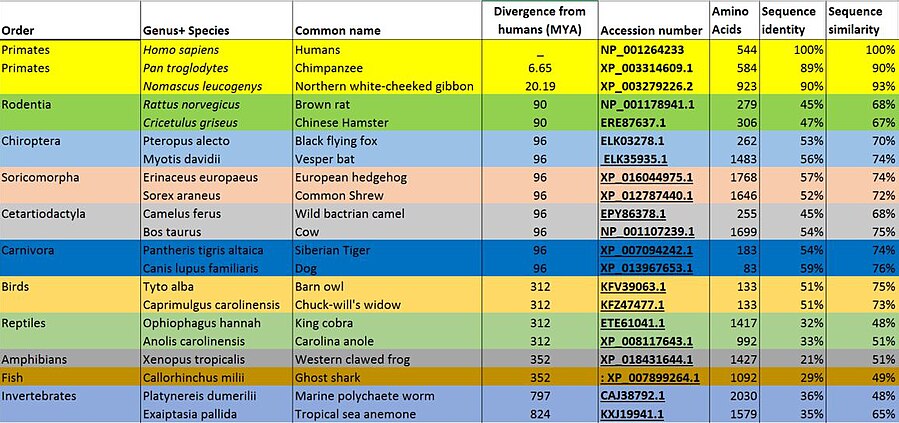
Ортологи POTEB были найдены в млекопитающие, птицы, рептилии, амфибии, рыбы, и даже у беспозвоночных, таких как морские анемоны и морские многощетинковые черви.[19] Эти ортологи имеют сходство с POTEB в основном из-за присутствия анкириновых повторов, что позволяет предположить, что белки, содержащие анкириновый домен, были консервированный за миллионы лет. Ортологи POTEB не были обнаружены у растений, одноклеточных эукариот, бактерий и архей.[19]
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000233917 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Entrez Gene: семейство анкириновых доменов POTE, член B". Получено 2012-11-26.
- ^ а б c d Mosavi LK, Cammett TJ, Desrosiers DC, Peng ZY (июнь 2004 г.). «Анкириновый повтор как молекулярная архитектура для распознавания белков». Белковая наука. 13 (6): 1435–48. Дои:10.1110 / пс 03554604. ЧВК 2279977. PMID 15152081.
- ^ а б c "Сервер NetPhos 3.1". www.cbs.dtu.dk. Получено 2017-05-06.
- ^ а б «Сервер SignalP 4.1». www.cbs.dtu.dk. Получено 2017-05-06.
- ^ а б База данных, генокарты Human Gene. "Ген POTEB - Генные карты | Белок POTEB | Антитело POTEB". www.genecards.org. Получено 2017-05-06.
- ^ «Хромосома 15: 21 846 329–21 877 703 - Подробная информация о регионе - Homo sapiens - Обозреватель генома ансамбля 88». useast.ensembl.org. Получено 2017-05-06.
- ^ а б Верстак, NCSA Biology. "SDSC Biology Workbench". workbench.sdsc.edu. Получено 2017-05-06.
- ^ а б Хан Й., Бера Т.К., Пастан И.Х., Ли Б. (февраль 2006 г.). «Дупликация и обширное ремоделирование генов семейства POTE, кодирующих белки, содержащие анкириновые повторы и домены спиральной спирали». Ген. 366 (2): 238–45. Дои:10.1016 / j.gene.2005.07.045. PMID 16364570.
- ^ «ExPASy - средство миристоилирования». web.expasy.org. Получено 2017-05-07.
- ^ Бера Т.К., Сен-Флер А., Ха Д, Ямада М., Ли Й., Ли Б., Хан И, Кауфман Д.С., Пера М., Пастан I (апрель 2008 г.). «Селективные паралоги POTE на хромосоме 2 экспрессируются в эмбриональных стволовых клетках человека». Стволовые клетки и развитие. 17 (2): 325–32. Дои:10.1089 / scd.2007.0079. ЧВК 7233169. PMID 18447647.
- ^ а б c «Зритель GEO Accession». www.ncbi.nlm.nih.gov. Получено 2017-05-06.
- ^ Вольф У., Рапопорт М.Дж., Швейцер Т.А. (01.07.2009). «Оценка аффективного компонента когнитивно-аффективного синдрома мозжечка». Журнал нейропсихиатрии и клинической неврологии. 21 (3): 245–53. Дои:10.1176 / jnp.2009.21.3.245. PMID 19776302.
- ^ «Genomatix - Анализ данных NGS и персонализированная медицина». www.genomatix.de. Получено 2017-05-06.
- ^ "UNAFold | mfold.rit.albany.edu". unafold.rna.albany.edu. Получено 2017-05-06.
- ^ Нельсон В.Дж., Вешнок П.Дж. (1987-08-06). «Связывание анкирина с (Na + + K +) АТФазой и значение для организации мембранных доменов в поляризованных клетках». Природа. 328 (6130): 533–6. Bibcode:1987Натура.328..533Н. Дои:10.1038 / 328533a0. PMID 3039371.
- ^ Лаборатория Майка Тайерса. «Сеть взаимодействий белков человека BioPlex: дополнительные неопубликованные результаты AP-MS | BioGRID». thebiogrid.org. Получено 2017-05-07.
- ^ а б c «Protein BLAST: поиск в базах данных белков с помощью белкового запроса». blast.ncbi.nlm.nih.gov. Получено 2017-05-07.
- ^ Бера Т.К., Хуйн Н., Маеда Х., Сатьянараяна Б.К., Ли Б., Пастан I (август 2004 г.). «Пять паралогов POTE и их варианты сплайсинга экспрессируются в предстательной железе человека и кодируют белки разной длины». Ген. 337: 45–53. Дои:10.1016 / j.gene.2004.05.009. PMID 15276201.
- ^ «Дерево времени :: Шкала времени жизни». www.timetree.org. Получено 2017-05-07.


