Правило Бента - Википедия - Bents rule

В химии, Правило Бента описывает и объясняет взаимосвязь между орбитальная гибридизация центральных атомов в молекулах и электроотрицательность из заместители.[1][2] Правило было сформулировано Генри А. Бент следующее:[2]
Характер атомов концентрируется на орбиталях, направленных к электроположительным заместителям.
В химическая структура из молекула тесно связано с его свойствами и реакционной способностью. Теория валентной связи предполагает, что молекулярные структуры обусловлены ковалентные связи между атомы и что каждая связь состоит из двух пересекающихся и обычно гибридизированный атомные орбитали. Традиционно p-блок элементы в молекулах считаются скрещивать строго как зрп, куда п равно 1, 2 или 3. Кроме того, предполагается, что все гибридные орбитали эквивалентны (т.е. п + 1 зрп орбитали имеют одинаковый символ p). Результаты такого подхода обычно хорошие, но их можно улучшить, если изовалентная гибридизация, в котором гибридизированные орбитали могут иметь нецелочисленный и неравный p-характер. Правило Бента дает качественную оценку того, как должны быть построены эти гибридизированные орбитали.[3] Правило Бента состоит в том, что в молекуле центральный атом, связанный с несколькими группами, будет гибридизоваться, так что орбитали с более s-характером направлены к электроположительным группам, а орбитали с более p-характером будут направлены к группам, которые более электроотрицательны. Убрав предположение, что все гибридные орбитали эквивалентны spп орбитали, лучшие предсказания и объяснения таких свойств, как молекулярная геометрия и прочность связи может быть получена.[4] Правило Бента было предложено в качестве альтернативы Теория VSEPR в качестве элементарного объяснения наблюдаемой молекулярной геометрии простых молекул с преимуществами более легкого согласования с современными теориями связи и более сильного экспериментального подтверждения.
Правило Бента можно обобщить до d-блок элементы тоже. Гибридизация металлического центра устроена так, что орбитали с характером больше s направлены в сторону лиганды которые образуют связи с более ковалентным характером. Эквивалентно орбитали с более d-характером направлены к группам, которые образуют связи с более сильным ионным характером.[1] Справедливость правила Бента для 75 типов связей между основными элементами группы была исследована недавно.[5] Для связей с более крупными атомами из более низких периодов тенденции орбитальной гибридизации сильно зависят как от электроотрицательности, так и от размера орбиты.
История
В начале 1930-х годов, вскоре после большей части начального развития квантовая механика, эти теории начали применяться к молекулярной структуре Полинг,[6] Slater,[7] Коулсон,[8] и другие. В частности, Полинг ввел понятие гибридизация, где атомные s- и p-орбитали объединяются в гибридные sp, sp2, и sp3 орбитали. Гибридные орбитали оказались мощным средством объяснения молекулярной геометрии простых молекул, таких как метан (тетраэдрические с пр.3 углерод). Однако в 1940-х годах стали очевидны небольшие отклонения от этой идеальной геометрии.[9] Особенно хорошо известен пример воды, где угол между атомами водорода составляет 104,5 °, что намного меньше ожидаемых 109,5 °. Чтобы объяснить такие несоответствия, было высказано предположение, что гибридизация может приводить к орбиталям с неравным s- и p-характером. А. Д. Уолш описан в 1947 г.[9] взаимосвязь между электроотрицательностью групп, связанных с углеродом, и гибридизацией указанного углерода. Наконец, в 1961 году Бент опубликовал крупный обзор литературы, который касался молекулярной структуры, гибридизации центрального атома и электроотрицательности заместителей. [2] и именно благодаря этой работе правило Бента и получило свое название.
Обоснование

Полярные ковалентные связи
Неформальное обоснование правила Бента основывается на том, что s-орбитали имеют меньшую энергию, чем p-орбитали.[2] Связи между элементами разных электроотрицательность будет полярный и электронная плотность в таких связях будет смещена в сторону более электроотрицательного элемента. Применяя это к молекуле фторметан демонстрирует правило Бента. Потому что углерод больше электроотрицательный чем водород, электронная плотность в связях C-H будет ближе к углеродной. Энергия этих электронов будет сильно зависеть от гибридных орбиталей, которые углерод вносит в эти связи из-за повышенной плотности электронов около углерода. Увеличивая количество символов s на этих гибридных орбиталях, можно уменьшить энергию этих электронов, поскольку s-орбитали имеют меньшую энергию, чем p-орбитали.
По той же логике и тому факту, что фтор более электроотрицателен, чем углерод, электронная плотность в связи C-F будет ближе к фтору. Гибридная орбиталь, которую углерод вносит в связь C-F, будет иметь относительно меньшую электронную плотность, чем в случае C-H, и поэтому энергия этой связи будет меньше зависеть от гибридизации углерода. Направляя гибридные орбитали с более p-характером к фтору, энергия этой связи не очень сильно увеличивается.
Вместо того, чтобы направлять эквивалентные зр3 орбитали по отношению ко всем четырем заместителям, смещение s-символа в сторону связей CH будет значительно стабилизировать эти связи из-за повышенной электронной плотности около углерода, в то время как смещение s-символа от связи CF увеличит ее энергию на меньшую величину, поскольку электронная плотность этой связи дальше от углерода. Характер атома на атоме углерода был направлен в сторону более электроположительных водородных заместителей и далек от электроотрицательного фтора, что и предполагает правило Бента.
Хотя фторметан является особым случаем, приведенный выше аргумент может быть применен к любой структуре с центральным атомом и 2 или более заместителями. Ключевым моментом является то, что концентрация атома на орбиталях, направленных к электроположительным заместителям, за счет его истощения на орбиталях, направленных на электроотрицательные заместители, приводит к общему снижению энергии системы. Этот стабилизирующий компромисс отвечает за правило Бента.
Несвязывающие орбитали
Правило Бента может быть расширено и для объяснения гибридизации несвязывающих орбиталей. С одной стороны, неподеленную пару (занятую несвязывающую орбиталь) можно рассматривать как предельный случай электроположительного заместителя с электронной плотностью, полностью поляризованной по направлению к центральному атому. Правило Бента предсказывает, что для стабилизации неподеленных, тесно удерживаемых несвязывающих электронов, орбитали одиночной пары должны принять характер высоких. С другой стороны, незанятая несвязывающая орбиталь может рассматриваться как предельный случай электроотрицательного заместителя с электронной плотностью, полностью поляризованной по направлению к лиганду. Правило Бента предсказывает, что для того, чтобы оставить как можно больше символов s для оставшихся занятых орбиталей, незанятые несвязывающие орбитали должны максимизировать p-характер.
Экспериментально первый вывод согласуется с уменьшенными валентными углами молекул с неподеленными парами, такими как вода или аммиак, по сравнению с метаном, в то время как второй вывод согласуется с плоской структурой молекул с незанятыми несвязывающими орбиталями, такими как мономерный боран и ионы карбения.
Последствия
Правило Бента можно использовать для объяснения тенденций как в молекулярной структуре, так и в реакционной способности. После определения того, как гибридизация центрального атома должна влиять на конкретное свойство, можно исследовать электроотрицательность заместителей, чтобы увидеть, выполняется ли правило Бента.
Углы крепления
Знание углов между связями - важный компонент в определении молекулярной структуры. В теория валентной связи предполагается, что ковалентные связи состоят из двух электронов, лежащих на перекрывающихся, обычно гибридизированных, атомных орбиталях от связывающих атомов. Орбитальная гибридизация объясняет почему метан четырехгранный и этилен плоский, например. Однако есть отклонения от идеальной геометрии spп гибридизация, например, в воды и аммиак. Валентные углы в этих молекулах составляют 104,5 ° и 107 ° соответственно, что ниже ожидаемого тетраэдрического угла 109,5 °. Традиционный подход к объяснению этих различий таков: Теория VSEPR. В рамках этой концепции предполагается, что валентные электроны находятся в локализованных областях, и предполагается, что неподеленные пары отталкивают друг друга в большей степени, чем связывающие пары.
Правило Бента дает альтернативное объяснение того, почему некоторые валентные углы отличаются от идеальной геометрии. Во-первых, тенденцию между гибридизацией центрального атома и валентным углом можно определить с помощью модельных соединений метан, этилен, и ацетилен. Для того чтобы атомы углерода направляли sp3, sp2, а sp орбитали к водородным заместителям. Валентные углы между заместителями составляют ~ 109,5 °, ~ 120 ° и 180 °. Эта простая система демонстрирует, что гибридизированные атомные орбитали с более высоким значением p будут иметь меньший угол между собой. Этот результат можно сделать строгим и количественным, как теорему Коулсона (см. Раздел «Формальная теория» ниже).

Теперь, когда связь между гибридизацией и валентными углами установлена, правило Бента можно применить к конкретным примерам. Следующее было использовано в оригинальной статье Бента, в которой рассматривается групповая электроотрицательность метильной группы должно быть меньше, чем у атома водорода, потому что замещение метила снижает константы кислотной диссоциации муравьиной кислоты и уксусной кислоты.[2]
| Молекула | Угол связи между заместителями |
|---|---|
Диметиловый эфир | 111° |
Метанол | 107-109° |
Вода | 104.5° |
Дифторид кислорода | 103.8° |
По мере продвижения вниз по таблице заместители становятся более электроотрицательными, и угол связи между ними уменьшается. Согласно правилу Бента, по мере увеличения электроотрицательности заместителей орбитали с большим р-характером будут направлены к этим группам. Согласно приведенному выше обсуждению, это уменьшит угол связи. Это согласуется с экспериментальными результатами. Сравнивая это объяснение с Теория VSEPR, VSEPR не может объяснить, почему угол в диметиловый эфир больше 109,5 °.
При прогнозировании валентного угла воды правило Бента предполагает, что гибридные орбитали с более s-характером должны быть направлены к неподеленным парам, в то время как это оставляет орбитали с более p-характером, направленными к водородам, что приводит к отклонению от идеализированного O (sp3) гибридные орбитали с характером 25% s и характером 75% p. В случае воды с углом НОН 104,5 ° связывающие орбитали ОН построены из O (~ sp4.0) орбитали (~ 20% s, ~ 80% p), а неподеленные пары состоят из O (~ sp2.3) орбитали (~ 30% s, ~ 70% p). Как обсуждалось в обосновании выше, неподеленные пары ведут себя как очень электроположительные заместители и имеют характер избытка s. В результате связывающие электроны имеют повышенный р-характер. Этот увеличенный p-характер в этих орбиталях уменьшает валентный угол между ними до менее чем тетраэдрический 109,5 °. Та же самая логика может быть применена к аммиаку (угол связи HNH 107,0 °, с тремя N (~ sp3.4 или 23% s) связывающих орбиталей и один N (~ sp2.1 или 32% s) неподеленная пара), другой канонический пример этого явления.
Та же тенденция сохраняется и для азотсодержащих соединений. Вопреки ожиданиям теории VSEPR, но в соответствии с правилом Бента, валентные углы аммиака (NH3) и трифторид азота (NF3) равны 107 ° и 102 ° соответственно.
В отличие от Теория VSEPR, теоретические основы которого сейчас кажутся шаткими, правило Бента по-прежнему считается важным принципом в современных методах лечения склеивания.[10] Например, модификация этого анализа все еще жизнеспособна, даже если неподеленные пары H2O считаются неэквивалентными в силу их симметрии (т. Е. Только s, а в плоскости pИкс и ру кислородные АО гибридизуются с образованием двух связывающих орбиталей O-H σОЙ и одинокая пара пО(σ), а pz становится неэквивалентной чистой неподеленной парой p-символов пО(π)), как и в случае неподеленных пар, выходящих из орбиталь естественной связи методы.
Длина скрепления
Подобно валентным углам, гибридизация атома может быть связана с длиной образующихся связей.[2] По мере увеличения s-характера связывающих орбиталей длина s-связи уменьшается.
| Молекула | Средняя длина углерод-углеродной связи |
|---|---|
 | 1,54 Å |
 | 1,50 Å |
 | 1,46 Å |
Добавляя электроотрицательные заместители и изменяя гибридизацию центральных атомов, можно изменять длину связи. Если молекула содержит структуру X-A - Y, замена заместителя X на более электроотрицательный атом изменяет гибридизацию центрального атома A и укорачивает соседнюю связь A - Y.
| Молекула | Средняя длина связи углерод – фтор |
|---|---|
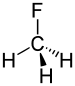 Фторметан | 1,388 Å |
 Дифторметан | 1,358 Å |
 Трифторметан | 1,329 Å |
 Тетрафторметан | 1,323 Å |
Поскольку фтор намного более электроотрицателен, чем водород, во фторметане углерод будет направлять гибридные орбитали с более высоким s-характером к трем атомам водорода, чем к фтору. В дифторметане есть только два атома водорода, поэтому меньше всего s-характера направлено к ним, а больше направлено к двум фторам, что укорачивает длину связи C-F по сравнению с фторметаном. Эта тенденция сохраняется вплоть до тетрафторметана, связи C-F которого имеют самый высокий s-характер (25%) и самую короткую длину связи в ряду.
Та же тенденция сохраняется и для хлорированных аналогов метана, хотя эффект менее значительный, поскольку хлор менее электроотрицателен, чем фтор.[2]
| Молекула | Средняя длина связи углерод-хлор |
|---|---|
 Хлорметан | 1,783 Å |
 Дихлорметан | 1,772 Å |
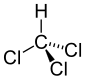 Трихлорметан | 1,767 Å |
 Тетрахлорметан | 1,766 Å |
Вышеупомянутые случаи, кажется, демонстрируют, что размер хлора менее важен, чем его электроотрицательность. Прогноз, основанный только на стерических принципах, привел бы к противоположной тенденции, поскольку большие заместители хлора были бы более предпочтительными при большом расстоянии друг от друга. Поскольку стерическое объяснение противоречит экспериментальному результату, правило Бента, вероятно, играет главную роль в определении структуры.
JCH Константы связи
Возможно, самым прямым измерением s-характера на связывающей орбитали между водородом и углеродом является 1H−13C муфта константы, определяемые из ЯМР спектры. Теория предсказывает, что JCH Значения будут намного выше у облигаций с более характерным s-характером.[11][12] В частности, одна облигация 13C-1Константа связи H 1J13C-1H связан с дробным s-характером углеродной гибридной орбитали, используемой для образования связи, посредством эмпирического отношения . (Например, чистый зр.3 гибридная атомная орбиталь, обнаруженная в связи C-H метана, будет иметь характер 25% s, что приведет к ожидаемой константе связи 500 Гц × 0,25 = 125 Гц, что отлично согласуется с экспериментально определенным значением.)
| Молекула | JCH (метильных протонов) |
|---|---|
 Метан | 125 Гц |
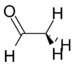 Ацетальдегид | 127 Гц |
 1,1,1-Трихлорэтан | 134 Гц |
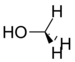 Метанол | 141 Гц |
 Фторметан | 149 Гц |
По мере того как электроотрицательность заместителя увеличивается, количество р-символа, направленного в сторону заместителя, также увеличивается. Это оставляет более s-характер связи с протонами метила, что приводит к увеличению JCH константы связи.
Индуктивный эффект
В индуктивный эффект можно объяснить правилом Бента.[13] Индуктивный эффект - это передача заряда через ковалентные связи, и правило Бента обеспечивает механизм для таких результатов через различия в гибридизации. В таблице ниже[14] по мере того, как группы, связанные с центральным углеродом, становятся более электроотрицательными, центральный углерод становится более поглощающим электроны, как измерено константа полярного заместителя. Константы полярных заместителей в принципе аналогичны значениям σ из Уравнение Гаммета, поскольку увеличение значения соответствует большей способности акцептора электронов. Правило Бента предполагает, что по мере увеличения электроотрицательности групп больше p-символа отклоняется в сторону этих групп, что оставляет больше s-символа в связи между центральным углеродом и R-группой. Поскольку s-орбитали имеют большую плотность электронов ближе к ядру, чем p-орбитали, электронная плотность в связи C-R будет больше смещаться в сторону углерода по мере увеличения s-символа. Это сделает центральный углерод более отталкивающим электроны для группы R.[9] Таким образом, электроноакцепторная способность заместителей была передана соседнему углероду, что и предсказывает индукционный эффект.
| Заместитель | Постоянная полярного заместителя (большие значения означают большее электроноакцепторная способность) |
|---|---|
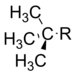 т-Бутил | −0.30 |
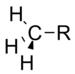 Метил | 0.00 |
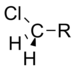 Хлорметил | 1.05 |
 Дихлорметил | 1.94 |
 Трихлорметил | 2.65 |
Формальная теория
Правило Бента обеспечивает дополнительный уровень точности теория валентной связи. Теория валентных связей предполагает, что ковалентные связи состоят из двух электронов, лежащих на перекрывающихся, обычно гибридизованных, атомных орбиталях двух связывающих атомов. Предположение, что ковалентная связь - это линейная комбинация атомных орбиталей всего двух связывающих атомов является приближением (см. теория молекулярных орбиталей ), но теория валентной связи достаточно точна, чтобы иметь и продолжает оказывать большое влияние на то, как понимается связь.[1]
В теории валентной связи каждый из двух атомов вносит свой вклад в атомную орбиталь, а электроны в перекрывающейся орбитали образуют ковалентную связь. Атомы обычно не вносят чистого водородоподобная орбиталь облигациям.[6] Если бы атомы могли вносить только водородоподобные орбитали, то экспериментально подтвержденная тетраэдрическая структура метан было бы невозможно, поскольку 2s и 2p орбитали углерода не имеют такой геометрии. Это и другие противоречия привели к предложению орбитальная гибридизация. В этой структуре атомные орбитали могут смешиваться, чтобы образовать эквивалентное количество орбиталей различных форм и энергий. В вышеупомянутом случае метана 2s и три 2p-орбитали углерода гибридизуются, давая четыре эквивалентных sp.3 орбитали, что разрешает несоответствие структуры. Орбитальная гибридизация позволила теории валентных связей успешно объяснить геометрию и свойства огромного числа молекул.
В традиционной теории гибридизации все гибридные орбитали эквивалентны.[15] А именно атомные s- и p-орбитали объединяются, чтобы получить четыре зря3 = 1⁄√4(s + √3пя) орбитали, три зря2 = 1⁄√3(s + √2пя) орбитали, или две зря = 1⁄√2(s + пя) орбитали. Эти комбинации выбраны для удовлетворения двух условий. Во-первых, общее количество s- и p-орбитальных вкладов должно быть эквивалентным до и после гибридизации. Во-вторых, гибридные орбитали должны быть ортогональный друг другу.[15] Если бы две гибридные орбитали не были ортогональными, по определению они имели бы ненулевое перекрытие орбиталей. Электроны на этих орбиталях будут взаимодействовать, и если одна из этих орбиталей будет вовлечена в ковалентную связь, другая орбиталь также будет иметь ненулевое взаимодействие с этой связью, что нарушит принцип теории валентных связей два электрона на связь.
Чтобы построить гибридные s- и p-орбитали, пусть первая гибридная орбиталь задается формулой s + √λяпя, где pя направлен на связующую группу и λя определяет количество символов p, которые имеет эта гибридная орбиталь. Это взвешенная сумма волновых функций. Теперь выберите вторую гибридную орбиталь. s + √λjпj, куда пj направлен каким-то образом и λj это количество п персонаж на этой второй орбите. Значение λj и направление пj должен быть определен так, чтобы результирующая орбиталь могла быть нормализована и чтобы она была ортогональна первой гибридной орбитали. Гибрид, безусловно, можно нормализовать, поскольку он представляет собой сумму двух нормированных волновых функций. Ортогональность должна быть установлена так, чтобы две гибридные орбитали могли быть вовлечены в отдельные ковалентные связи. В внутренний продукт ортогональных орбиталей должны быть равны нулю, и вычисление внутреннего произведения сконструированных гибридов дает следующий расчет.
Орбиталь s нормализована, поэтому внутренний продукт ⟨ s | s ⟩ = 1. Так же s орбиталь ортогональна пя и пj орбитали, что приводит к двум слагаемым выше, равным нулю. Наконец, последний член - это внутреннее произведение двух нормированных функций, расположенных под углом ωij друг другу, что дает потому что ωij по определению. Однако ортогональность связывающих орбиталей требует, чтобы 1 + √λяλj потому что ωij = 0, так что в результате получаем теорему Коулсона:[15]
Это означает, что четыре атомных орбитали s и p могут быть гибридизированы в произвольных направлениях при условии, что все коэффициенты λ попарно удовлетворяют вышеуказанному условию, чтобы гарантировать, что полученные орбитали ортогональны.
Правило Бента, согласно которому центральные атомы направляют орбитали с большим p-характером в сторону более электроотрицательных заместителей, легко применимо к вышесказанному, если отметить, что увеличение λя коэффициент увеличивает p-характер s + √λяпя гибрид орбитальный. Таким образом, если центральный атом A связан с двумя группами X и Y, а Y является более электроотрицательным, чем X, то A будет гибридизоваться, так что λИкс < λY. Для точного предсказания молекулярной геометрии из первых принципов необходимы более сложные теоретические и вычислительные методы, помимо правила Бента, но правило Бента обеспечивает отличную эвристику для объяснения молекулярных структур.
Смотрите также
- Молекулярная орбитальная теория
- Орбитальная гибридизация
- Молекулярная геометрия
- Линейная комбинация атомных орбиталей
Рекомендации
- ^ а б c Weinhold, F .; Ландис, К. Л. (2005), Валентность и связь: перспектива естественного донора-акцептора (1-е изд.), Кембридж: Издательство Кембриджского университета, ISBN 978-0-521-83128-4
- ^ а б c d е ж грамм Бент, Х.А. (1961), "Оценка структур валентных связей и гибридизации в соединениях элементов первого ряда", Chem. Ред., 61 (3): 275–311, Дои:10.1021 / cr60211a005
- ^ Foster, J. P .; Weinhold, F. (1980), "Природные гибридные орбитали", Варенье. Chem. Soc., 102 (24): 7211–7218, Дои:10.1021 / ja00544a007
- ^ Алабугин, И. В .; Bresch, S .; Гомес, Г. П. (2015). «Орбитальная гибридизация: ключевой электронный фактор в управлении структурой и реактивностью». J. Phys. Орг. Chem. 28 (2): 147–162. Дои:10.1002 / poc.3382.
- ^ Алабугин, И. В .; Bresch, S .; Манохаран, М. (2014). «Тенденции гибридизации элементов основной группы и расширение правила Бента за пределы углерода: больше, чем электроотрицательность». J. Phys. Chem. А. 118 (20): 3663–3677. Дои:10.1021 / jp502472u. PMID 24773162.
- ^ а б Полинг, Л. (1931), «Природа химической связи. Применение результатов, полученных из квантовой механики и теории парамагнитной восприимчивости, к структуре молекул», Варенье. Chem. Soc., 53 (4): 1367–1400, Дои:10.1021 / ja01355a027
- ^ Слейтер, Дж. К. (1931), "Направленная валентность в многоатомных молекулах", Phys. Ред., 37 (5): 481–489, Bibcode:1931ПхРв ... 37..481С, Дои:10.1103 / PhysRev.37.481
- ^ Колсон, К. А. (1961), Валентность (2-е изд.), Оксфорд: Clarendon Press
- ^ а б c Уолш, А. Д. (1947), "Свойства связей с участием углерода", Обсуждать. Faraday Soc., 2: 18–25, Дои:10.1039 / DF9470200018
- ^ Weinhold, F .; Лэндис, Кларк Р. (2012). Открытие химии с помощью естественных связующих орбиталей. Хобокен, штат Нью-Джерси: Wiley. С. 67–68. ISBN 9781118119969.
- ^ Muller, N .; Причард, Д. Э. (1959), "С13 в спектрах протонного магнитного резонанса. I. Углеводороды », J. Chem. Phys., 31 (3): 768–771, Bibcode:1959ЖЧФ..31..768М, Дои:10.1063/1.1730460
- ^ Muller, N .; Причард, Д. Э. (1959), "С13 в спектрах протонного магнитного резонанса. II. Связь в замещенных метанах », J. Chem. Phys., 31 (6): 1471–1476, Bibcode:1959ЖЧФ..31.1471М, Дои:10.1063/1.1730638
- ^ Бент, Х.А. (1960), "Распределение атомного характера в молекулах и его химические последствия", J. Chem. Educ., 37 (12): 616–624, Bibcode:1960JChEd..37..616B, Дои:10.1021 / ed037p616
- ^ Тафт-младший, Р. У. (1957), "Относительно электрона - отводящая способность и электроотрицательность групп", J. Chem. Phys., 26 (1): 93–96, Bibcode:1957ЖЧФ..26 ... 93Т, Дои:10.1063/1.1743270
- ^ а б c Колсон, К. А. (1961), Валентность (2-е изд.), Oxford: Clarendon Press, стр. 203–5 Неэквивалентные гибриды.


![{ displaystyle { begin {align} left langle s + { sqrt { lambda _ {i}}} p_ {i} { Big vert} s + { sqrt { lambda _ {j}}} p_ {j} right rangle & = langle s mid s rangle + { sqrt { lambda _ {i}}} langle s mid p_ {i} rangle + { sqrt { lambda _ { j}}} langle s mid p_ {j} rangle + { sqrt { lambda _ {i} lambda _ {j}}} langle p_ {i} mid p_ {j} rangle [4pt] & = 1 + 0 + 0 + { sqrt { lambda _ {i} lambda _ {j}}} cos omega _ {ij} = 1 + { sqrt { lambda _ {i} lambda _ {j}}} cos omega _ {ij} конец {выровнено}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a9a0eccf9438e2d82c4e98622999feded965adac)
