Пиовердин - Pyoverdine
 | |
| Имена | |
|---|---|
| Другие имена Пиовердин | |
| Идентификаторы | |
3D модель (JSmol ) | |
PubChem CID | |
| |
| |
| Характеристики | |
| C56ЧАС88N18О22 | |
| Молярная масса | 1365.424 г · моль−1 |
| Внешность | Твердый |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Пиовердины[1] (альтернативно и реже пишется как пиовердины) находятся флуоресцентный сидерофоры произведено некоторыми псевдомонады.[2][3] Пиовердины важны факторы вирулентности, и требуются для патогенез во многих биологические модели инфекции. Их вклад в бактериальный патогенез включать предоставление важнейших питательных веществ (т. е. утюг ), регулирование других факторы вирулентности (включая экзотоксин А и протеаза Прпл),[4] поддержка формирования биопленки,[5] и все чаще признаются за то, что токсичность самих себя.[6][7][8]
Пиовердины также были исследованы как "Троянский конь "молекулы для доставки противомикробные препараты иначе устойчивые бактериальные штаммы, так как хелаторы что можно использовать для биоремедиация из тяжелые металлы, и, как флуоресцентный репортеры использовали для анализа на присутствие железа и, возможно, других металлов.[9]
Из-за того, что они заполняют пробелы между патогенность, метаболизм железа, и флуоресценция, пиовердины вызывают любопытство ученых всего мира более 100 лет.
Биологические функции
Как большинство сидерофоры, синтезируется пиовердин и секретный в окружающую среду, когда микроорганизм который производит, обнаруживает, что внутриклеточный утюг концентрации упали ниже установленного порога. Несмотря на то что утюг это четвертый по распространенности элемент в земной коре, растворимость биологически значимых утюг соединений чрезвычайно низок и, как правило, недостаточен для нужд большинства (но не всех) микроорганизмы. Сидерофоры, которые обычно достаточно растворимы и имеют исключительно высокий жадность за железо (III) (в жадность некоторых сидерофоры за утюг превышает 1040 M-1 и многие из самых сильных алчностей, когда-либо наблюдавшихся в природе, проявляются сидерофоры за утюг ), помочь увеличить биодоступность из утюг втягивая его в водный раствор.
Помимо этой роли пиовердин выполняет ряд других функций, в том числе регулирует вирулентность,[4][5] ограничение роста других видов бактерий (и служащих своего рода противомикробным средством) за счет ограничения доступности железа и связывания других металлов и предотвращения их токсичности.
Состав и характеристики
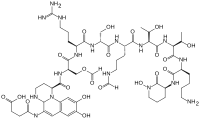
Хотя многие (> 100) форм пиовердина были выделены и изучены, все они имеют определенные общие характеристики. Каждая молекула пиовердина состоит из трех частей: дигидроксихинолинового ядра, 6-14 аминокислота пептид это варьируется среди напряжения, и боковая цепь (обычно состоящая из 4-5 углеродных α-кетокислота от Цикл Кребса / лимонной кислоты ). Ядро пиовердина отвечает за несколько его свойств, включая хорошо известный желтоватый цвет и флуоресценция.
Структура
Ядро дигидроксихинолина состоит из (1S) -5-амино-2,3-дигидро-8,9-дигидрокси-1H-пиримидо [1,2-a]хинолин -1-карбоновая кислота. Эта часть молекулы инвариантна среди всех наблюдаемых молекул пиовердина.
Ядро модифицировано добавлением аминокислотная цепь пиовердина состоит из 6-14 аминокислоты. Цепочка аминокислот построена на хромофор ядро, и синтезируется через синтез нерибосомальных пептидов.[10][11] Как обычно для пептидов, синтезированных не рибзосомами, пиовердин часто включает: Аминокислоты в форме D и нестандартные аминокислоты, такие как N-5-формил-N-5-гидроксиорнитин. Пептидная цепь также может быть частично (или полностью) циклизована. Эта пептидная цепь обеспечивает четыре других аспекта гексадентатный взаимодействие, обычно через гидроксамат и / или гидроксикарбоксилат группы. Эта часть молекулы также имеет решающее значение для взаимодействия с рецептором феррипиовердина (FpvA), который позволяет феррипиовердину импортироваться в клетку. Пептидная цепь, продуцируемая данным штаммом Псевдомонады в настоящее время считается инвариантным.
Мало что известно о конкретной функции или важности боковой цепи кетокислоты, но она хорошо известна.[12] молекулы пиовердина с разными кетокислоты (сородичи ) сосуществуют. Кетокислоты наблюдаемые включают сукцинат /сукцинамид, глутамат, глутарат, малат /маламид, и α-кетоглутарат.
| Виды псевдомонад | Напряжение | Структура пептидной цепи пиовердина |
|---|---|---|
| P. aeruginosa | ATCC15692 (PAO1) | Q-DSer-Arg-DSer-FoOHOrn-c (Lys-FoOHOrn-Thr-Thr) |
| P. aeruginosa | ATCC27853 | Q-DSer-FoOHDOrn-Orn-Gly-aDThr-Ser-cOHOrn |
| P. aeruginosa | Pa6 | Q-DSer-Dab-FoOHOrn-Gln-DGln-FoOHDOrn-Gly |
| P. chlororaphis | ATCC9446 | Q-DSer-Lys-Gly-FoOHOrn-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens bv.I | ATCC13525 | Q-DSer-Lys-Gly-FoOHOrn-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens bv.I | 9AW | Q-DSer-Lys-OHHis-aDThr-Ser-cOHOrn |
| P. fluorescens bv.III | ATCC17400 | Q-DAla-DLys-Gly-Gly-OHAsp-DGln / Dab-Ser-DAla-cOHOrn |
| P. fluorescens bv.V | 51 Вт | Q-DAla-DLys-Gly-Gly-OHDAsp-DGln-DSer-Ala-Gly-aDThr-cOHOrn |
| P. fluorescens bv.V | 1 Вт | Q-DSer-Lys-Gly-FoOHOrn-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens bv.V | 10CW | Q-DSer-Lys-Gly-FoOHOrn-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens bv.VI | PL7 | Q-DSer-AcOHDOrn-Ala-Gly-aDThr-Ala-cOHOrn |
| P. fluorescens bv.VI | PL8 | Q-DLys-AcOHDOrn-Ala-Gly-aDThr-Ser-cOHOrn |
| P. fluorescens | 1.3 | Q-DAla-DLys-Gly-Gly-OHAsp-DGln / Dab-Gly-Ser-cOHOrn |
| P. fluorescens | 18.1 | Q-DSer-Lys-Gly-FoOHOrn-Ser-DSer-Gly-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens | CCM 2798 | Q-Ser-Dab-Gly-Ser-OHDAsp-Ala-Gly-DAla-Gly-cOHOrn |
| P. fluorescens | CFBP 2392 | Q-DLys-AcOHDOrn-Gly-aDThr-Thr-Gln-Gly-DSer-cOHOrn |
| P. fluorescens | CHA0 | Q-Asp-FoOHDOrn-Lys-c (Thr-Ala-Ala-FoOHDOrn-Lys) |
| P. putida bv. B | 9BW | Q-DSer-Lys-OHHis-aDThr-Ser-cOHOrn |
| P. putida | CFBP 2461 | Q-Asp-Lys-OHDAsp-Ser-aDThr-Ala-Thr-DLys-cOHOrn |
| P. tolaasii | НЦППБ 2192 | Q-DSer-Lys-Ser-DSer-Thr-Ser-AcOHOrn-Thr-DSer-cOHDOrn |
Характеристики
Среди других примечательных характеристик пиовердины обладают яркими, относительно фотостабильная флуоресценция с характерной спектры возбуждения и излучения которые быстро и сильно закаленный при связывании их естественных лиганд, утюг. Возбуждение и молярная поглощающая способность показать умеренный pH зависимость, но флуоресценция обычно не подвержен влиянию pH вариации. В отличие от флуоресценция, спектроскопический поглощение показывает мало закалка на железосвязывающий, предполагая, что механизм молекулярной релаксации является колебательным, а не через электромагнитное излучение.
Пиовердин координирует гексадентатный (т. е. шестичастное) хелатирование железа, которое включает шесть различных атомов кислорода (2 от дигидроксихинолинового ядра и по 2 от каждой из 2 различных аминокислот в основной цепи). Это приводит к очень тесной координации восьмигранный комплекс, который эффективно предотвращает попадание воды или другие материалы, которые могут нарушить связывание. Обычно трехвалентное железо выводится из пиовердина снижение к железо состояние, для которого пиовердин имеет гораздо более низкую (т.е. 109 M-1) жадность. Это позволяет осуществлять неразрушающее удаление железа из пиовердина. После восстановления железо «передается» другим носителям, которые имеют повышенное сродство к двухвалентному железу, в то время как апопиовердин реэкспортируется для дальнейшего использования.
Пиовердин структурно похож на азобактин, из Azotobacter vinelandii, за исключением того, что последний обладает дополнительным кольцом мочевины.[13]
Синтез
Биосинтез
В Синегнойная палочка PAO1 всего 14 pvd гены, участвующие в биосинтезе пиовердина.[14]
Биосинтез пиовердина, по-видимому, в значительной степени регулируется за счет активности альтернативных фактор сигма PvdS, который, в свою очередь, регулируется как системой Fur, так и внутриклеточной секвестрацией PvdS в плазматическая мембрана и вдали от нуклеоид репрессором FpvI.
Несмотря на значительные исследования, относительно мало известно о биосинтезе пиовердина. Например, остается неясным, происходит ли биосинтез пиовердина в виде отдельных компонентов (то есть ядра, пептид цепь, и кетокислота ) или если ядро и другие части конденсируются как начальная молекула (возможно, белком PvdL), а затем модифицируются другими ферментами. По причинам, которые остаются неясными, биосинтез пиовердина сильно подавляется противораковыми препаратами. фторурацил,[15] особенно из-за его способности нарушать метаболизм РНК.[16] Хотя продукция пиовердинов варьируется от штамма к штамму, было показано, что флуоресцентные виды Pseudomonas производят от 200 до 500 мг / л при выращивании в условиях обеднения железа.[17][18]
Основной
Существует некоторый спор о происхождении флуоресцентный хромофор основной. Первоначально считалось, что он был синтезирован pvcABCD оперон, как удаление частей ПВХ и ПВХ гены нарушают выработку пиовердина.[19] Как и другие аспекты биосинтеза пиовердина, регуляция pvcABCD является железо-зависимым, и потеря активности этих генов приводит к нарушению работы пиовердина.
В отдельном отчете предполагается, что pvcABCD вместо этого может быть ответственным за синтез паерукумарина (молекулы, связанной с псевдовердином), и утверждает, что потеря активности в локусе не влияет на продукцию пиовердина.[20] Кроме того, у некоторых флуоресцентных псевдомонад отсутствуют явные гомологи этих генов, что дополнительно ставит под сомнение, является ли это функцией этих генов.
Это согласуется с сообщениями, pvdL сочетает кофермент А к миристический кислотный фрагмент, затем добавляет глутамат, D-тирозин и L-2,4-диаминомасляная кислота (DAB).[21] Альтернативный путь биосинтеза предполагает, что pvdL включает глутамат, 2,4,5-тригидроксифенилаланин и L-2,4-даминомасляная кислота.[22] Последнее подтверждается идентификацией включения радиоактивно меченного тирозин в пиовердин или псевдовердин.
Это несоответствие остается нерешенным.
Пептидная цепь
Некоторые из гены отвечает за биосинтез пиовердина (например, ПВДГ, ПВДА, и pvdF) участвуют в генерации предшественников и альтернативных аминокислоты необходим для различных частей молекулы.[23] Несколько других (например, pvdI, и pvdJ) непосредственно отвечают за «сшивание» пептидной цепи.[23] pvdD завершает цепь и выпускает предшественник в цитоплазма, что согласуется с идентификацией пиовердиноподобных молекул в цитоплазма с недозревшими хромофоры.[23]
Кетокислота
В настоящее время наиболее достоверные данные свидетельствуют о том, что кетокислота изначально прикреплен к хромофор ядро (как L-глутамат ) при его синтезе из D-тирозин, L-2,4-диаминомасляная кислота и L-глутамат. Неясно, как это позже передается другому конгенерированному (т.е. а-кетоглутарат, сукцинат /сукцинамид и др.) формы.
Созревание и экспорт
Локализация некоторых белков Pvd в периплазма и внешняя мембрана (такая как PvdN, PvdO, PvdP и PvdQ) были интерпретированы как предполагающие, что части созревания пиовердина происходят в этом месте, возможно, после того, как он был перемещен в периплазма от PvdE, который гомологичен Экспортеры типа ABC. Насколько полностью созревший пиовердин выводится из клетки, остается неясным. После полного созревания пиовердин экспортируется из периплазма автор: PvdRT-OpmQ излияние насос.
Полный химический синтез
Полный органический синтез путь для пиовердина, продуцируемого P. aeruginosa штамм PAO1 был зарегистрирован[24] с помощью твердофазный пептидный синтез. Этот протокол позволил получить пиовердин с высоким выходом (~ 48%), и ожидается, что он существенно увеличит способность ученых генерировать целевые производные на каркасе пиовердина и будет способствовать созданию сидерофоры с противомикробный боеголовки.
Механизмы вирулентности
Сообщается, что пиовердин необходим для вирулентность в различных модели болезней, включая C. elegans и различные модели мышиной инфекции (например, ожоговые модели, модели пневмонии и т. д.).[6][15][25]
Как отмечалось выше, пиовердин несколькими способами способствует общей вирулентности, включая регулирование собственной продукции, экзотоксин А (что тормозит перевод), а протеаза PrpL.[4] Есть также свидетельства того, что пиовердин, хотя и не является необходимым для его образования, способствует образованию и развитию биопленки которые важны для вирулентности.[5]
Наконец, пиовердин сам по себе ассоциируется с несколькими видами токсичности. В 2001 году Альбеса и его коллеги сообщили, что пиовердин очищен от штамма P. fluorescens показал глубокий цитотоксичность к млекопитающим макрофаги и что этот эффект хотя бы частично зависел от активные формы кислорода.[26] Позже Кириенко и его коллеги определили, что пиовердин необходим и достаточен для убийства. C. elegans, попадает в клетки-хозяева, дестабилизирует митохондриальная динамика, и индуцирует гипоксический ответ.[6][7] Воздействие вызывает реакцию, соответствующую гипоксия это зависит от HIF-1 белка, предполагая, что хозяин воспринимает состояние, при котором ему не хватает молекулярных инструментов для генерации АТФ (как правило, железо, кислород и эквиваленты клеточных восстановителей).[6][7]
Роль в микробиологическом сотрудничестве
Как только пиовердин секретируется, он свободно распространяется в окружающей среде. Связанный с железом пиовердин (также известный как феррипиовердин) может поглощаться любой бактериальной клеткой с соответствующим рецептор, хотя это зависит от сорта.[27] Важно отметить, что это создает общее благо, которым могут воспользоваться «мошенники», которые сохраняют способность использовать пиовердин, но перестали его производить. Поскольку производство пиовердина является энергетически затратным, это может создать преимущество в пригодности клеток, которые его не синтезируют.[28][29][30][31] Следовательно, пиовердин стал модельным признаком для изучения. микробное сотрудничество и эксплуатация.[32][33]
В P. aeruginosa было показано, что не продуцирующие пиовердин «читерские» бактерии: i) легко эволюционируют от продуцирующего предка;[34] и ii) превосходить сотрудничающих напряжения в смешанной культуре в зависимости от плотности и частоты.[35][36] Поскольку использование пиовердина зависит от пассивного распространение производство пиовердина является метаболически затратным, известно, что условия окружающей среды влияют на вероятность успешной эксплуатации. Было показано, что конкурентное преимущество непродуцентов пиовердина перед продуцентами в смешанной культуре максимизируется, когда окружающая среда хорошо перемешана и молекулы легко диффундируют (низкая пространственная структура), а также когда затраты и выгоды от производства пиовердина высоки, т.е. утюг сильно ограничено.[30][37] Большинство исследований взаимодействия пиовердина и обмана было проведено с использованием клинических изолятов, но сидерофор эксплуатация была недавно также продемонстрирована в естественных Псевдомонады изоляты из неклинических образцов.[38][39]
Номенклатура
В настоящее время не используется широко распространенная систематическая номенклатура для дифференциации структур пиовердина. Система была предложена в 1989 г.[40] состоящий из пиовердина типа I, типа IIa, типа IIb и типа III. В то время было известно только несколько структур пиовердина, и ожидалось, что будет происходить гораздо меньше вариаций, чем предполагалось. Как следствие огромной неоднородности, наблюдаемой в пептид позвоночника, и наблюдение сородичей (пиовердины одного штамма, различающиеся только кетокислота порциями), номенклатура пиовердинов остается довольно разреженной, и ни одна система не получила всеобщего признания.
История
- 1850-е годы: Седийо отмечает сине-зеленые выделения из повязок на хирургические раны.
- 1860: Пиовердин (хотя и не названный так) был извлечен из повязок на рану. Фордос.
- 1862: Лакке связывает пиовердин с бациллами, наблюдаемыми под микроскопом.
- 1882: Синегнойная палочка впервые выращенный в чистой культуре Карлом Гессардом, описанный в «О синем и зеленом окрашивании бинтов». Гессар называет организм Синегнойная палочкапосле слова aerugo на латыни Verdigris.
- 1889: Бушар отмечает, что инъекция кролика, инфицированного бацилла сибирской язвы (возбудитель сибирская язва ) с P. aeruginosa предотвращает образование сибирской язвы.
- 1889: Бушар обнаруживает пиовердин флуоресценция под ультрафиолетовый свет.
- 1948, 1952: Первые наблюдения, что концентрации утюг и пиовердин взаимны.
- 1978: Мейер и его коллеги впервые продемонстрировали роль пиовердина в приобретении железа.
- 1980–1990-е: Разработаны первые структуры и регламент провердина.
- 1999: Первое определение того, что флуоресценция пиовердина закаленный железным связыванием.
Другое использование
Этот раздел пуст. Вы можете помочь добавляя к этому. (Октябрь 2016) |
Псевдовердин
Соединение, родственное пиовердину, называемое псевдовердином (формально известное как 3-формиламино-6,7-дигидроксикумарин), также производится некоторыми флуоресцентный Псевдомонады.[41] Считается, что псевдовердин и пиовердин могут возникать из общего предшественника, 2,4,5-тригидроксифенилаланина, который может конденсироваться с L-2,4-диаминомасляной кислотой, чтобы инициировать выработку пиовердина.[41]
Псевдовердин относительно похож на пиовердин по своим свойствам. флуоресценция и другие спектроскопический свойства, и его способность хелат железо утюг, хотя и намного ниже близость.[41] В отличие от пиовердина не способен транспортировка утюг в клетки, вероятно, из-за отсутствия пептид цепь.[41] Еще одно отличие состоит в том, что псевдовердин не кажется регулируемый теми же процессами, что и пиовердин.[41]
Рекомендации
- ^ Для целей данной страницы под пиовердином обычно понимается (если не указано иное) пиовердин, производимый Синегнойная палочка штамм PAO1. Он подвергся наиболее обширным исследованиям и может считаться прототипом сидерофоров.
- ^ С. Венденбаум; П. Деманж; А. Делл; Дж. М. Мейер; М. А. Абдалла (1983). «Строение пиовердина Па, сидерофор синегнойной палочки». Буквы Тетраэдра. 24 (44): 4877–4880. Дои:10.1016 / S0040-4039 (00) 94031-0.
- ^ Menhart, N .; Thariath, A .; Вишванатха, Т. (1991). «Характеристика пиовердинов Azotobacter vinelandii ATCC 12837 в отношении гетерогенности». Биология металлов. 4 (4): 223–32. Дои:10.1007 / bf01141185. PMID 1838001. S2CID 8712926.
- ^ а б c Lamont, Iain L .; Beare, Paul A .; Охснер, Урс; Василь, Адриана I .; Василь, Михаил Л. (2002-05-14). «Сидерофор-опосредованная передача сигналов регулирует продукцию фактора вирулентности у Pseudomonasaeruginosa». Труды Национальной академии наук Соединенных Штатов Америки. 99 (10): 7072–7077. Bibcode:2002PNAS ... 99.7072L. Дои:10.1073 / pnas.092016999. ISSN 0027-8424. ЧВК 124530. PMID 11997446.
- ^ а б c Банин, Эхуд; Василь, Михаил Л .; Гринберг, Э. Питер (2005-08-02). «Формирование биопленок железа и синегнойной палочки». Труды Национальной академии наук Соединенных Штатов Америки. 102 (31): 11076–11081. Bibcode:2005PNAS..10211076B. Дои:10.1073 / pnas.0504266102. ISSN 0027-8424. ЧВК 1182440. PMID 16043697.
- ^ а б c d Кириенко, Наталья В .; Кириенко, Даниил Р .; Ларкинс-Форд, Иона; Уэлби, Каролина; Рувкун, Гэри; Осубель, Фредерик М. (17 апреля 2013 г.). «Pseudomonas aeruginosa нарушает гомеостаз железа Caenorhabditis elegans, вызывая гипоксический ответ и смерть». Клеточный хозяин и микроб. 13 (4): 406–416. Дои:10.1016 / j.chom.2013.03.003. ISSN 1934-6069. ЧВК 3641844. PMID 23601103.
- ^ а б c Кириенко, Наталья В .; Ausubel, Frederick M .; Рувкун, Гэри (10.02.2015). «Митофагия придает устойчивость к опосредованному сидерофором уничтожению Pseudomonas aeruginosa». Труды Национальной академии наук Соединенных Штатов Америки. 112 (6): 1821–1826. Bibcode:2015ПНАС..112.1821К. Дои:10.1073 / pnas.1424954112. ISSN 1091-6490. ЧВК 4330731. PMID 25624506.
- ^ Минандри, Фабриция; Импери, Франческо; Франжипани, Эмануэла; Бончи, Карло; Визаджио, Даниэла; Факкини, Марселла; Паскуали, Паоло; Брагонзи, Алессандра; Виска, Паоло (1 августа 2016 г.). «Роль систем захвата железа в вирулентности Pseudomonas aeruginosa и инфекции дыхательных путей». Инфекция и иммунитет. 84 (8): 2324–2335. Дои:10.1128 / IAI.00098-16. ISSN 1098-5522. ЧВК 4962624. PMID 27271740.
- ^ Йодер, Майкл Ф .; Кисаалита, Уильям С. (01.01.2011). «Железоспецифичность биосенсора на основе флуоресцентного пиовердина, иммобилизованного в золь-гель стекле». Журнал биологической инженерии. 5: 4. Дои:10.1186/1754-1611-5-4. ISSN 1754-1611. ЧВК 3114707. PMID 21554740.
- ^ Hohlneicher, U .; Schäfer, M .; Fuchs, R .; Будзикевич, Х. (2016-10-11). «Феррибактины как биосинтетические предшественники пиовердинов Pseudomonas siderophores». Zeitschrift für Naturforschung C. 56 (3–4): 308–310. Дои:10.1515 / znc-2001-3-423. ISSN 0939-5075. PMID 11371026.
- ^ Виска, Паоло; Импери, Франческо; Ламонт, Иэн Л. (01.01.2007). «Пиовердин сидерофоры: от биогенеза к биозначению». Тенденции в микробиологии. 15 (1): 22–30. Дои:10.1016 / j.tim.2006.11.004. ISSN 0966-842X. PMID 17118662.
- ^ Будзикевич, Х (1997). «Сидерофоры флуоресцентных псевдомонад». Zeitschrift für Naturforschung C. 52 (11–12): 713–720. Дои:10.1515 / znc-1997-11-1201. PMID 9463934. S2CID 26196277.
- ^ а б Мейер, Дж. М. (2000). «Пиовердины: пигменты, сидерофоры и потенциальные таксономические маркеры флуоресцентных видов Pseudomonas». Архив микробиологии. 174 (3): 135–142. Дои:10.1007 / s002030000188. PMID 11041343. S2CID 13283224.
- ^ Lamont, I. L .; Мартин, Л. В. (2003). «Идентификация и характеристика новых генов синтеза пиовердина у Pseudomonas aeruginosa». Микробиология. 149 (4): 833–842. Дои:10.1099 / мик. 0.26085-0. PMID 12686626.
- ^ а б Импери, Франческо; Масаи, Франческо; Факкини, Марселла; Франжипани, Эмануэла; Визаджио, Даниэла; Леони, Ливия; Брагонзи, Алессандра; Виска, Паоло (30 апреля 2013 г.). «Переназначение антимикотического препарата флуцитозина для подавления патогенности Pseudomonas aeruginosa». Труды Национальной академии наук Соединенных Штатов Америки. 110 (18): 7458–7463. Bibcode:2013ПНАС..110.7458И. Дои:10.1073 / pnas.1222706110. ISSN 1091-6490. ЧВК 3645532. PMID 23569238.
- ^ Кириенко, Даниил Р .; Ревтович, Алексей В .; Кириенко, Наталья В. (2016-08-01). «Фенотипический скрининг с высоким содержанием позволяет идентифицировать фторуридин как ингибитор биосинтеза пиовердина и вирулентности Pseudomonas aeruginosa». мСфера. 1 (4): e00217–16. Дои:10.1128 / мСфера.00217-16. ISSN 2379-5042. ЧВК 4999921. PMID 27579370.
- ^ Корнелис, П; Hohnadel, D; Мейер, JM (1989). «Доказательства различных систем захвата железа, опосредованных пиовердином, среди штаммов Pseudomonas aeruginosa». Заразить иммунную. 57 (11): 3491–3497. Дои:10.1128 / IAI.57.11.3491-3497.1989. ЧВК 259858. PMID 2509364.
- ^ Hohnadel, Дэни; Хаас, Дитер; Мейер, Жан-Мари (1986-09-01). «Картирование мутаций, влияющих на продукцию пиовердина в Pseudomonas aeruginosa». Письма о микробиологии FEMS. 36 (2–3): 195–199. Дои:10.1111 / j.1574-6968.1986.tb01695.x. ISSN 0378-1097.
- ^ Стинци, А .; Johnson, Z .; Stonehouse, M .; Ochsner, U .; Meyer, J.M .; Василь, М. Л .; Пул, К. (1999-07-01). «Кластер pvc генов Pseudomonas aeruginosa: роль в синтезе пиовердинового хромофора и регуляция PtxR и PvdS». Журнал бактериологии. 181 (13): 4118–4124. Дои:10.1128 / JB.181.13.4118-4124.1999. ISSN 0021-9193. ЧВК 93907. PMID 10383985.
- ^ Кларк-Пирсон, Майкл Ф .; Брэди, Шон Ф. (2008-10-01). «Паэрукумарин, новый метаболит, продуцируемый кластером генов pvc из Pseudomonas aeruginosa». Журнал бактериологии. 190 (20): 6927–6930. Дои:10.1128 / JB.00801-08. ISSN 1098-5530. ЧВК 2566218. PMID 18689486.
- ^ Будзикевич, Х (1993). «Вторичные метаболиты флуоресцентных псевдомонад». FEMS Microbiol Rev. 10 (3–4): 209–228. Дои:10.1111 / j.1574-6968.1993.tb05868.x. PMID 8318257.
- ^ Стинци, А; Корнелис, П; Hohnadel, D; Мейер, JM; Дин, C; Пул, К; Курамбас, S; Кришнапиллаи, V (1996). «Новый ген (ы) биосинтеза пиовердина Pseudomonas aeruginosa PAO». Микробиология. 142 (5): 1181–1190. Дои:10.1099/13500872-142-5-1181. PMID 8704959.
- ^ а б c Cézard, C .; Farvacques, N .; Сонет, П. (01.01.2015). «Химия и биология пиовердинов, первичных сидерофоров Pseudomonas». Современная лекарственная химия. 22 (2): 165–186. Дои:10.2174/0929867321666141011194624. ISSN 1875–533X. PMID 25312210.
- ^ Машиах, Рой; Мейлер, Майкл М. (2013-04-05). «Полный синтез пиовердина D». Органические буквы. 15 (7): 1702–1705. Дои:10.1021 / ol400490s. ISSN 1523-7052. PMID 23530778.
- ^ Takase, H .; Nitanai, H .; Хосино, К .; Отани, Т. (2000-04-01). «Влияние производства сидерофоров на инфекции Pseudomonas aeruginosa у мышей с ослабленным иммунитетом». Инфекция и иммунитет. 68 (4): 1834–1839. Дои:10.1128 / iai.68.4.1834-1839.2000. ISSN 0019-9567. ЧВК 97355. PMID 10722571.
- ^ Becerra, C .; Albesa, I .; Эрасо, А. Дж. (13 июля 2001 г.). «Лейкотоксичность пиовердина, продукция активных форм кислорода и влияние УФ-излучения». Сообщения о биохимических и биофизических исследованиях. 285 (2): 414–418. Дои:10.1006 / bbrc.2001.5188. PMID 11444858.
- ^ Бодилис, Жосселин; Гизель, Барт; Осаянде, Джули; Маттис, Сандра; Пирне, Жан-Поль; Денайер, Сара; Де Вос, Даниэль; Корнелис, Пьер (2009-08-01). «Распределение и эволюция рецепторов феррипиовердина у синегнойной палочки». Экологическая микробиология. 11 (8): 2123–2135. Дои:10.1111 / j.1462-2920.2009.01932.x. ISSN 1462-2920. PMID 19397675.
- ^ Вейгерт, Майкл; Кюммерли, Рольф (12.07.2017). «Физические границы сотрудничества общественных благ между прикрепленными к поверхности бактериальными клетками». Proc. R. Soc. B. 284 (1858): 20170631. Дои:10.1098 / rspb.2017.0631. ISSN 0962-8452. ЧВК 5524494. PMID 28701557.
- ^ Buckling, Ангус; Харрисон, Фрейя; Вос, Михиэль; Брокхерст, Майкл А .; Гарднер, Энди; West, Stuart A .; Гриффин, Эшли (2007-11-01). «Сидерофор-опосредованное сотрудничество и вирулентность в Pseudomonas aeruginosa». FEMS Microbiology Ecology. 62 (2): 135–141. Дои:10.1111 / j.1574-6941.2007.00388.x. ISSN 0168-6496. PMID 17919300.
- ^ а б Кюммерли, Рольф; Браун, Сэм П. (2010-11-02). «Молекулярные и регуляторные свойства общественного блага определяют эволюцию сотрудничества». Труды Национальной академии наук. 107 (44): 18921–18926. Bibcode:2010PNAS..10718921K. Дои:10.1073 / pnas.1011154107. ISSN 0027-8424. ЧВК 2973908. PMID 20944065.
- ^ Гриффин, Эшли С .; West, Stuart A .; Баклинг, Ангус (2004). «Сотрудничество и конкуренция в патогенных бактериях». Природа. 430 (7003): 1024–1027. Bibcode:2004 Натур.430.1024G. Дои:10.1038 / природа02744. HDL:1842/698. ISSN 1476-4687. PMID 15329720. S2CID 4429250.
- ^ West, Stuart A .; Гриффин, Эшли С .; Гарднер, Энди; Диггл, Стивен П. (2006). «Теория социальной эволюции микроорганизмов». Обзоры природы Микробиология. 4 (8): 597–607. Дои:10.1038 / nrmicro1461. ISSN 1740-1534. PMID 16845430. S2CID 18451640.
- ^ Kümmerli, R .; Санторелли, Л. А .; Granato, E.T .; Dumas, Z .; Добай, А .; Griffin, A. S .; Вест, С. А. (2015-12-01). «Коэволюционная динамика между производителями общественных благ и мошенниками в бактерии Pseudomonas aeruginosa» (PDF). Журнал эволюционной биологии. 28 (12): 2264–2274. Дои:10.1111 / jeb.12751. ISSN 1420-9101. PMID 26348785. S2CID 826683.
- ^ Dumas, Z .; Кюммерли, Р. (2012-03-01). «Стоимость подбора правил сотрудничества для читов в бактериальных метапопуляциях». Журнал эволюционной биологии. 25 (3): 473–484. Дои:10.1111 / j.1420-9101.2011.02437.x. ISSN 1420-9101. PMID 22168669. S2CID 19132153.
- ^ Росс-Гиллеспи, Адин; Гарднер, Энди; West, Stuart A .; Гриффин, Эшли С. (01.09.2007). «Частотная зависимость и сотрудничество: теория и тест с бактериями». Американский натуралист. 170 (3): 331–342. Дои:10.1086/519860. ISSN 0003-0147. PMID 17879185. S2CID 14248496.
- ^ Росс-Гиллеспи, Адин; Гарднер, Энди; Buckling, Ангус; West, Stuart A .; Гриффин, Эшли С. (01.09.2009). «Зависимость от плотности и сотрудничество: теория и тест с бактериями». Эволюция. 63 (9): 2315–2325. Дои:10.1111 / j.1558-5646.2009.00723.x. ISSN 1558-5646. PMID 19453724. S2CID 5699402.
- ^ Кюммерли, Рольф; Гриффин, Эшли С .; West, Stuart A .; Buckling, Ангус; Харрисон, Фрейя (07.10.2009). «Вязкая среда способствует сотрудничеству патогенной бактерии Pseudomonas aeruginosa». Труды Лондонского королевского общества B: биологические науки. 276 (1672): 3531–3538. Дои:10.1098 / rspb.2009.0861. ISSN 0962-8452. ЧВК 2817189. PMID 19605393.
- ^ Брюс, Джон Б.; Купер, Гай А .; Шабас, Элен; West, Stuart A .; Гриффин, Эшли С. (2017-10-01). «Обман и устойчивость к обману в естественных популяциях бактерии Pseudomonas fluorescens». Эволюция. 71 (10): 2484–2495. Дои:10.1111 / evo.13328. ISSN 1558-5646. PMID 28833073. S2CID 3485902.
- ^ Бутайте, Елена; Баумгартнер, Майкл; Уайдер, Стефан; Кюммерли, Рольф (04.09.2017). «Обман сидерофоров и устойчивость к обману формируют конкуренцию за железо в почвенных и пресноводных сообществах Pseudomonas». Nature Communications. 8 (1): 414. Bibcode:2017НатКо ... 8..414B. Дои:10.1038 / s41467-017-00509-4. ISSN 2041-1723. ЧВК 5583256. PMID 28871205.
- ^ Briskot, G .; Тараз, К .; Будзикевич, Х. (1989). «Бактериальные компоненты, XXXVII. Сидерофоры пиовердинового типа из Pseudomonas aeruginosa». Либигс Энн Хем. 1989 (4): 375–384. Дои:10.1002 / jlac.198919890164.
- ^ а б c d е Longerich, I; Тараз, К; Budzikiewicz, H; Цай, L; Мейер, JM (1993). «Псевдовердин, соединение, родственное хромофору пиовердина из штамма Pseudomonas aeruginosa, неспособного продуцировать пиовердин». Z Naturforsch C. 48 (5–6): 425–429. Дои:10.1515 / znc-1993-5-605. PMID 8363709. S2CID 29269780.
