Респираторный взрыв - Respiratory burst
Респираторный взрыв (или окислительный взрыв) - быстрое высвобождение активные формы кислорода (ROS), супероксид-анион (О−
2) и пероксид водорода (ЧАС
2О
2), из разных ячейка типы.
Обычно это используется для млекопитающих. иммунологическая защита, но также играет роль в клеточная сигнализация. Респираторный взрыв также связан с яйцеклетка животных, следующих оплодотворение. Это также может произойти в клетки растений.
Иммунитет
Иммунные клетки можно разделить на миелоидные клетки и лимфоидные клетки. Миелоидные клетки, в том числе макрофаги и нейтрофилы, особенно причастны к респираторному взрыву. Они есть фагоцитарный, и респираторный взрыв жизненно важен для последующей деградации усвоенный бактерии или другой патогены. Это важный аспект врожденный иммунитет.
Респираторный взрыв требует увеличения потребления кислорода в 10-20 раз. НАДФН оксидаза (NOX2 у человека) активность. НАДФН является ключевым субстрат NOX2 и медведи снижение мощности. Гликоген разрушение жизненно важно для производства НАДФН. Это происходит через пентозофосфатный путь.
Фермент NOX2 связывается в фаголизосома мембрана. После бактериального фагоцитоза он активируется, вырабатывая супероксид через его редокс центр, который переносит электроны от цитозольного НАДФН к O2 в фагосоме.[1]
2O2 + НАДФН -> 2O2•– + НАДФ+ + H+
Тогда супероксид может спонтанно или ферментативно реагирует с другими молекулами с образованием других АФК. Фагоцитарная мембрана закрывается, чтобы ограничить воздействие на внеклеточную среду образующихся реактивных веществ. свободные радикалы.
Пути образования активных видов
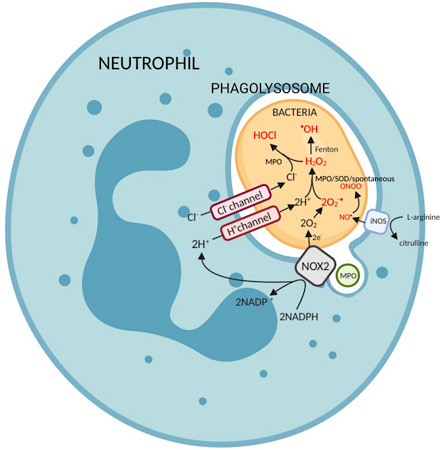
Есть 3 основных пути образования активных форм кислорода или активные формы азота (RNS) в эффекторные клетки:[2]
- Супероксиддисмутаза (или, альтернативно, миелопероксидаза ) образует перекись водорода из супероксида. Гидроксильные радикалы затем генерируются через Реакция Габера-Вейсса или Реакция Фентона, из которых оба катализируются Fe2+.
О2•–+ H2О2 —> •ОН + ОН– + O2 - В присутствии галогенид ионы, особенно хлорид-ионы, миелопероксидаза использует перекись водорода для производства хлорноватистая кислота.
ЧАС2О2 + Cl− -> ClO− + H2О - Синтаза оксида азота (индуцибельная изоформа, iNOS, при иммунитете) катализирует производство оксид азота от L-аргинин. 2L-аргинин + 3НАДФН + 3 H+ + 4O2 —> 2цитруллин + 2НО• + 4H2O + 3NADP+
Оксид азота может реагировать с анионами супероксида с образованием пероксинитрит анион.
Защита от патогенов
Воздействие этих реактивных частиц при респираторном взрыве приводит к патологии. Это связано с окислительное повреждение поглощенным бактериям.
Примечательно, что пероксинитрит - очень сильный окислитель что может привести к перекисное окисление липидов, окисление белков, белок нитрование, которые ответственны за его бактерицидное действие. Он может напрямую реагировать с белками, которые содержат центры переходных металлов, такие как FeS, выпуская Fe2+ для реакции Фентона. Пероксинитрит может также реагировать с различными аминокислотами в пептидной цепи, тем самым изменяя структуру белка и, следовательно, функцию белка. Чаще всего окисляет цистеин, и может косвенно вызвать тирозин нитрование через другие генерируемые РНС. Измененная функция белка включает изменения каталитической активности фермента, организации цитоскелета и передачи клеточного сигнала.[3]
Хлорноватистая кислота реагирует с рядом биомолекул, включая ДНК, липиды и белки. HClO может окислять цистеины и метионины через их сульфгидрильные группы и серные группы соответственно. Первое приводит к образованию дисульфидные связи, индуцируя сшивание белков. Оба окисления приводят к агрегации белков и, в конечном итоге, к гибели клеток.[4] Сульфгидрильные группы могут окисляться до трех раз тремя молекулами HClO, образуя сульфеновые кислоты, сульфиновые кислоты и R – SO3H, которые становятся все более необратимыми и бактерицидными.[5][6] Между тем окисление метионина обратимо. HOCl также может реагировать с первичными или вторичными амины, производящие хлорамины, токсичные для бактерий.[7][8] Также может происходить перекрестное сшивание и агрегация белков, а также разрушение групп FeS.
Неотъемлемой частью образования хлорноватистой кислоты является миелопероксидаза. Миелопероксидаза наиболее распространена в нейтрофилах, при этом фагоцитоз сопровождается дегрануляция. Это слияние гранул с фаголизосомами, высвобождение их содержимого, в том числе миелопероксидазы.[9] Поскольку многие микробицидные продукты образуются во время респираторного взрыва, важность отдельных молекул в уничтожении вторгающихся патогенов до конца не изучена.
Из-за высокой токсичности генерируемых антимикробных продуктов, включая ROS, нейтрофилы имеют короткую продолжительность жизни, чтобы ограничить повреждение тканей хозяина во время воспаление.
Болезнь
Хроническая гранулематозная болезнь наследственное заболевание человека нейтрофилы, в котором NOX2 является дефектным. Фагоцитоз все еще может происходить, но без надлежащего функционирования NOX2 не происходит выработки супероксида и, следовательно, респираторного взрыва. Бактериальный инфекция не очищается.[10]
Сотовая сигнализация
Нефагоцитарные клетки
В нефагоцитарных клетках продукты окислительного взрыва используются во внутриклеточных сигнальных путях. Сгенерированные ROS достигают этого путем смещения ячейки редокс штат. Это можно контролировать по соотношению антиоксидантного фермента глутатион к его окисленному продукту, дисульфид глутатиона (GSH: GSSG).[11] Антиоксидантные ферменты уравновешивают передачу сигналов окислительно-восстановительного потенциала, устраняя вовлеченные молекулы, в частности супероксид-анион и оксид азота. Передача сигналов окислительно-восстановительного потенциала имеет решающее значение для нормальных процессов, таких как пролиферация, дифференцировка, а также сосудистой функции и нейротрансмиссии. Он также участвует в таких болезненных состояниях, как рак.
Изоформа НАДФН-оксидазы NOX1 временно производит выброс супероксида в ответ на фактор роста (например. EGF ) стимуляция соответствующих рецепторов.[12] Супероксид дисмутируется до перекиси водорода со скоростью, близкой к скорости, ограниченной диффузией. Это пространственное ограничение дисмутации супероксида учитывает специфичность редокс-передачи сигналов. Специфичность также обеспечивается локализацией NOX1 в определенных микродоменах плазматической мембраны клетки. Через такие каналы, как аквапорин или диффузия, перекись водорода попадает в цитозоль. Там он окисляет цистеиновые группы окислительно-восстановительных белков, которые затем могут передавать сигналы.[13]
Макрофаги
Окислительный взрыв в фагоцитах чаще всего связан с уничтожением бактерий. Однако макрофаги, особенно альвеолярные макрофаги, обычно производят гораздо более низкие уровни АФК, чем нейтрофилы, и могут потребовать активации для их бактерицидных свойств. Вместо этого их кратковременный окислительный взрыв регулирует воспалительную реакцию, вызывая цитокин синтез для передачи сигналов редокс, что приводит к притоку нейтрофилов и активированных макрофагов.[14]
Раковые клетки
Раковые клетки могут манипулировать передачей клеточных сигналов, производя избыточные уровни ROS, тем самым постоянно активируя пути, способствующие их клеточному росту и пролиферации.[15] Подразумеваемые пути включают: NF-κB, PI3K, ФОМС и МАРК. У людей митохондриальные АФК необходимы наряду с теми, которые высвобождаются в результате окислительного всплеска для митогенный стимуляция пути в онкогенный KRAS клетки. Однако у онкогенных мышей Kras фибробласты Было показано, что ингибиторов НАДФН-оксидазы достаточно, чтобы блокировать пути этих факторов роста.[16] Одновременно опухолевые клетки поддерживают высокий уровень антиоксидантов для защиты от гибели раковых клеток.[17]
Удобрение
В частности, окислительный взрыв после оплодотворения можно увидеть на морской еж яйцо. Считается, что это эволюционно отличается от нейтрофилов.
Перекись водорода производится яичная оксидаза активность после увеличения потребления кислорода.[18] Это важно для сшивание белков яйцеклетки для предотвращения летального полиспермия. Сама перекись водорода также обладает спермицидными свойствами. Однако генерируемые реактивные виды поддерживаются на более низком уровне, чем иммунитет, чтобы защитить само оплодотворенное яйцо от окислительного повреждения. Это достигается за счет удаления перекиси водорода, в первую очередь за счет двойной функции той же яичной оксидазы, а во вторую - за счет поглотителей цитоплазматических АФК, таких как каталаза и глутатион.[19]
В растениях
Окислительный взрыв действует как механизм защиты растений от патогенной инфекции. Это видно сообщение PAMPs обнаружение рецепторами, расположенными на поверхности клетки (например, FLS2 или EFR ).[20][21][22] Как и у животных, продукция активных форм кислорода у растений опосредуется НАДФН оксидаза. В иммунитет растений субъединицы НАДФН-оксидазы RbohD и RbohF обладают перекрывающимися функциями, экспрессируются в разных тканях и на разных уровнях.[23][24] Однако, в отличие от фагоцитов животных, в которых генерируемые АФК содержатся в запечатанных фаголизосомах, окислительный взрыв в растениях не сдерживается. Следовательно, генерируемые АФК несут дополнительные эффекты наряду с токсичностью патогенов. Перекись водорода индуцирует окислительное сшивание гликопротеинов клеточной стенки растений.[25][26] Это снижает подверженность ферментативной деградации патогенами.[27] Системная приобретенная резистентность, который аналогичен врожденному иммунитету у животных, также индуцируется в облученных растительных клетках.[28] Воздействие перекиси водорода также может привести к гиперчувствительный ответ, что является гибелью небольшого количества клеток-хозяев в месте заражения с целью ограничения патогенной инфекции.[29][30] Производство АФК в растениях можно использовать в качестве индикатора для успешного распознавания патогенов с помощью люминол -пероксидаза на основе анализа.[31]
использованная литература
- ^ Лето Т.Л., Гейст М. (сентябрь 2006 г.). «Роль NADPH оксидазы семейства Nox в защите хозяина». Антиоксиданты и редокс-сигналы. 8 (9–10): 1549–61. Дои:10.1089 / ars.2006.8.1549. PMID 16987010.
- ^ Имлай JA (2003). «Пути окислительного повреждения». Ежегодный обзор микробиологии. 57: 395–418. Дои:10.1146 / annurev.micro.57.030502.090938. PMID 14527285.
- ^ Pacher P, Beckman JS, Liaudet L (январь 2007 г.). «Оксид азота и пероксинитрит в здоровье и болезни». Физиологические обзоры. 87 (1): 315–424. Дои:10.1152 / Physrev.00029.2006. ЧВК 2248324. PMID 17237348.
- ^ Перейра В.Е., Хояно Ю., Summons RE, Бэкон В.А., Даффилд А.М. (июнь 1973 г.). «Исследования хлорирования. II. Реакция водной хлорноватистой кислоты с альфа-аминокислотами и дипептидами». Biochimica et Biophysica Acta. 313 (1): 170–80. Дои:10.1016/0304-4165(73)90198-0. PMID 4745674.
- ^ Винтерборн CC (июнь 1985 г.). «Сравнительная реакционная способность различных биологических соединений с миелопероксидазой-перекисью водорода-хлоридом и сходство окислителя с гипохлоритом». Biochimica et Biophysica Acta (BBA) - Общие предметы. 840 (2): 204–10. Дои:10.1016/0304-4165(85)90120-5. PMID 2986713.
- ^ Prütz WA (январь 1998 г.). «Взаимодействие хлорноватистой кислоты с пиримидиновыми нуклеотидами и вторичные реакции хлорированных пиримидинов с GSH, NADH и другими субстратами». Архивы биохимии и биофизики. 349 (1): 183–91. Дои:10.1006 / abbi.1997.0440. PMID 9439597.
- ^ Fang FC (6 сентября 2011 г.). «Антимикробное действие активных форм кислорода». мБио. 2 (5). Дои:10.1128 / mBio.00141-11. ЧВК 3171981. PMID 21896680.
- ^ Хэмптон МБ, Чайник А.Дж., Винтерборн СС (ноябрь 1998 г.). «Внутри фагосомы нейтрофилов: оксиданты, миелопероксидаза и уничтожение бактерий». Кровь. 92 (9): 3007–17. Дои:10.1182 / кровь.V92.9.3007.421k47_3007_3017. PMID 9787133.
- ^ Witko-Sarsat V, Rieu P, Descamps-Latscha B, Lesavre P, Halbwachs-Mecarelli L (май 2000 г.). «Нейтрофилы: молекулы, функции и патофизиологические аспекты». Лабораторные исследования; Журнал технических методов и патологии. 80 (5): 617–53. Дои:10.1038 / labinvest.3780067. PMID 10830774.
- ^ Фернандес Х. «Хроническая гранулематозная болезнь (ХГБ) - иммунология; аллергические расстройства». Руководство MSD Professional Edition. Получено 2020-03-12.
- ^ Schafer FQ, Buettner GR (июнь 2001 г.). «Редокс-среда клетки с точки зрения окислительно-восстановительного состояния пары дисульфид / глутатион глутатиона». Свободная радикальная биология и медицина. 30 (11): 1191–212. Дои:10.1016 / S0891-5849 (01) 00480-4. PMID 11368918.
- ^ Forman HJ, Torres M (декабрь 2002 г.). «Реактивные формы кислорода и клеточная передача сигналов: респираторный взрыв в передаче сигналов макрофагами». Американский журнал респираторной медицины и реанимации. 166 (12, п. 2): S4-8. Дои:10.1164 / rccm.2206007. PMID 12471082.
- ^ Ди Марцо Н., Чиши Э, Джованнони Р. (октябрь 2018 г.). «Роль перекиси водорода в редокс-зависимой передаче сигналов: гомеостатические и патологические реакции в клетках млекопитающих». Клетки. 7 (10): 156. Дои:10.3390 / ячеек7100156. ЧВК 6211135. PMID 30287799.
- ^ Forman HJ, Torres M (декабрь 2002 г.). «Реактивные формы кислорода и клеточная передача сигналов: респираторный взрыв в передаче сигналов макрофагами». Американский журнал респираторной медицины и реанимации. 166 (12, п. 2): S4-8. Дои:10.1164 / rccm.2206007. PMID 12471082.
- ^ Сатровски Т.П., Натан К.Ф. (февраль 1991 г.). «Производство больших количеств перекиси водорода опухолевыми клетками человека». Исследования рака. 51 (3): 794–8. PMID 1846317.
- ^ Irani K, Xia Y, Zweier JL, Sollott SJ, Der CJ, Fearon ER и др. (Март 1997 г.). «Митогенная передача сигналов, опосредованная оксидантами в Ras-трансформированных фибробластах». Наука. 275 (5306): 1649–52. Дои:10.1126 / science.275.5306.1649. PMID 9054359. S2CID 19733670.
- ^ Горрини С., Харрис И.С., Мак Т.В. (декабрь 2013 г.). «Модуляция окислительного стресса как противораковая стратегия». Обзоры природы. Открытие наркотиков. 12 (12): 931–47. Дои:10.1038 / nrd4002. PMID 24287781. S2CID 20604657.
- ^ Варбург О (январь 1908 г.). "Beobachtungen über die Oxydationsprozesse im Seeigelei". Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 57 (1–2): 1–16. Дои:10.1515 / bchm2.1908.57.1-2.1.
- ^ Вонг Дж. Л., Кретон Р., Вессель Г. М. (декабрь 2004 г.). «Окислительный всплеск при оплодотворении зависит от активации двойной оксидазы Udx1». Клетка развития. 7 (6): 801–14. Дои:10.1016 / j.devcel.2004.10.014. PMID 15572124.
- ^ Док Н (1985-11-01). «НАДФН-зависимое образование O2- в мембранных фракциях, выделенных из поврежденных клубней картофеля, инокулированных Phytophthora infestans». Физиологическая патология растений. 27 (3): 311–322. Дои:10.1016 / 0048-4059 (85) 90044-Х.
- ^ Брэдли DJ, Kjellbom P, Lamb CJ (июль 1992 г.). «Вызванное элиситором и индуцированное раной окислительное перекрестное сшивание богатого пролином белка клеточной стенки растений: новый быстрый защитный ответ». Ячейка. 70 (1): 21–30. Дои:10.1016 / 0092-8674 (92) 90530-П. PMID 1623521. S2CID 12312001.
- ^ Jabs T, Tschope M, Colling C, Hahlbrock K, Scheel D (апрель 1997 г.). «Стимулируемые элиситором потоки ионов и O2- от окислительного всплеска являются важными компонентами в запуске активации защитных генов и синтеза фитоалексина в петрушке». Труды Национальной академии наук Соединенных Штатов Америки. 94 (9): 4800–5. Bibcode:1997PNAS ... 94.4800J. Дои:10.1073 / пнас.94.9.4800. ЧВК 20805. PMID 9114072.
- ^ Торрес М.А., Дангл Дж. Л., Джонс Дж. Д. (январь 2002 г.). «Гомологи Arabidopsis gp91phox AtrbohD и AtrbohF необходимы для накопления активных кислородных промежуточных продуктов в ответной реакции растений». Труды Национальной академии наук Соединенных Штатов Америки. 99 (1): 517–22. Bibcode:2002ПНАС ... 99..517Т. Дои:10.1073 / pnas.012452499. ЧВК 117592. PMID 11756663.
- ^ Моралес Дж., Кадота Ю., Зипфель С., Молина А., Торрес М.А. (март 2016 г.). «НАДФН-оксидазы арабидопсиса RbohD и RbohF демонстрируют различные паттерны экспрессии и вклад в иммунитет растений». Журнал экспериментальной ботаники. 67 (6): 1663–76. Дои:10.1093 / jxb / erv558. PMID 26798024.
- ^ Брэдли DJ, Кьеллбом П., Лэмб СиДжей (июль 1992 г.). «Вызванное элиситором и индуцированное раной окислительное перекрестное сшивание богатого пролином белка клеточной стенки растений: новый быстрый защитный ответ». Ячейка. 70 (1): 21–30. Дои:10.1016 / 0092-8674 (92) 90530-п. PMID 1623521. S2CID 12312001.
- ^ Войташек П., Третхован Дж., Болвелл Г.П. (сентябрь 1995 г.). «Специфичность иммобилизации белков клеточной стенки в ответ на различные молекулы-элиситоры в культивируемых в суспензии клетках фасоли фасоли (Phaseolus vulgaris L.)». Молекулярная биология растений. 28 (6): 1075–87. Дои:10.1007 / BF00032668. PMID 7548825. S2CID 23319754.
- ^ Бриссон Л.Ф., Тенхакен Р., Лэмб С. (декабрь 1994 г.). «Функция окислительного перекрестного сшивания структурных белков клеточной стенки при устойчивости растений к болезням». Растительная клетка. 6 (12): 1703–1712. Дои:10.1105 / tpc.6.12.1703. ЧВК 160556. PMID 12244231.
- ^ Chen Z, Silva H, Klessig DF (декабрь 1993 г.). «Активные формы кислорода в индукции системной приобретенной устойчивости растений салициловой кислотой». Наука. 262 (5141): 1883–6. Bibcode:1993Sci ... 262.1883C. Дои:10.1126 / science.8266079. PMID 8266079.
- ^ Тенхакен Р., Левин А., Бриссон Л. Ф., Диксон Р. А., Лэмб К. (май 1995 г.). «Функция окислительного взрыва при устойчивости к гиперчувствительным заболеваниям». Труды Национальной академии наук Соединенных Штатов Америки. 92 (10): 4158–63. Bibcode:1995PNAS ... 92.4158T. Дои:10.1073 / пнас.92.10.4158. ЧВК 41903. PMID 11607542.
- ^ Левин А., Тенхакен Р., Диксон Р., Лэмб С. (ноябрь 1994 г.). «Н2О2 от окислительного всплеска управляет реакцией устойчивости растений к гиперчувствительным болезням». Ячейка. 79 (4): 583–93. Дои:10.1016/0092-8674(94)90544-4. PMID 7954825. S2CID 1488844.
- ^ Кепплер Л.Д. (1989). «Активное производство кислорода во время реакции гиперчувствительности, вызванной бактериями в клетках суспензии табака». Фитопатология. 79 (9): 974. Дои:10.1094 / фито-79-974.
внешние ссылки
- Респираторный + взрыв в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
