Тиофосфат - Thiophosphate
- Для эфиров тиофосфата см. органотиофосфаты.
Тиофосфаты (или фосфоротиоаты, PS) находятся химические соединения и анионы с общим химическая формула PS
4−ИксО3−
Икс (Икс = 0, 1, 2 или 3) и родственные производные, в которых органические группы присоединены к одному или нескольким O или S. Тиофосфаты имеют тетраэдрические центры фосфора (V).[1]
Органический
Органотиофосфаты являются подклассом фосфорорганические соединения которые структурно связаны с неорганическими тиофосфатами. Общие члены имеют формулы типа (RO)3−ИксрИксPS и родственные соединения, где RO заменен на RS. Многие из этих соединений используются как инсектициды, некоторые из них имеют медицинское применение, а некоторые использовались как масляные присадки.[1]
- Избранные органотиофосфаты

диалкилдитиофосфат цинка, масляная присадка.[2]

Фосфоротиоаты - основа антисмысловой терапии.

Амифостин, который используется в химиотерапии рака.
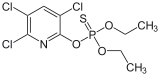
Хлорпирифос, популярный инсектицид.
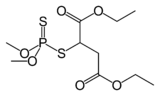
Малатион, популярный инсектицид.
Фосфоротиоаты олигонуклеотидов (OPS) представляют собой модифицированные олигонуклеотиды, в которых один из атомов кислорода в фосфатной части замещен серой. Они являются основой антисмысловая терапия, например, лекарства Fomivirsen (Витравене), облимерсен, Alicaforsen, и Мипомерсен (Кинамро).[3]
Неорганический

Простейшие тиофосфаты имеют формулу [PS4−ИксОИкс]3−. Эти трианионы наблюдаются только при очень высоких pH, вместо этого они существуют в протонированной форме с формулой [HпPS4−ИксОИкс](3−п)− (x = 0, 1, 2 или 3 и (n = 1, 2 или 3).
Монотиофосфат

Монотиофосфат - это анион [PO3S]3−, что имеет C3в симметрия. Поваренная соль - это монотиофосфат натрия (Na3PO3S). Монотиофосфат используется в исследованиях как аналог фосфата в биохимия. Эфиры монотиофосфата являются биохимическими реагенты используется при изучении транскрипция,[4] методы замещающей интерференции. Иногда «монотиофосфат» относится к сложным эфирам, таким как (CH3O)2POS−.[5]
Дитиофосфаты
Дитиофосфат имеет формулу [PO2S2]3−, что имеет C2v симметрия. Дитиофосфат натрия, который является бесцветным, является основным продуктом реакции пентасульфид фосфора с участием NaOH:[6]
- п2S5 + 6 NaOH → 2 Na3PO2S2 + H2S + 2 H2О
Дитиофосфорная кислота получается обработкой дитиофосфата бария с серная кислота:
- Ба3(PO2S2)2 + 3 часа2ТАК4 → 3 BaSO4 + 2 часа3PO2S2
Оба Na3PO2S2 и особенно H3PO2S2 склонны к гидролизу до их монотио производных.
Три- и тетратиофосфаты
Тритиофосфат - это анион [поз.3]3−, что имеет C3в симметрия. Тетратиофосфат - это анион [PS4]3−, которая имеет Td симметрия.
пИксSу: бинарные тиофосфаты и полифосфаты

Ряд этих анионов известен. Некоторые из них вызвали интерес как компоненты в быстрые ионные проводники для использования в твердотельных батареях. Бинарные тиофосфаты не демонстрируют большого разнообразия аналогичных анионов P-O, но содержат аналогичные структурные особенности, например, P имеет 4 координаты, образуются связи P-S-P и есть связи P-P. Одно отличие состоит в том, что ионы могут включать полисульфидные фрагменты из 2 или более атомов S, тогда как в анионах P-O присутствует только реактивная -O-O-, пероксо, звено.
- PS−
3 является аналогом нитрат ион Нет−
3 (здесь нет PO−
3 аналог); он был выделен в виде желтой соли тетрафениларсония[8] - PS3−
4 является серным аналогом PO3−
4и подобное PO3−
4 четырехгранный. - п
2S4−
7 пиротиофосфат-ион, состоящий из двух угловых ПС4 тетраэдры, аналогичные пирофосфаты.[9] - п
2S4−
10 Ион, который можно представить как два PS4 тетраэдры, соединенные дисульфид звено или пиротиофосфат, где мостик -S- заменен на -S4−.[10] - п
2S2−
6 реберная битетраэдрическая структура. Таким образом, структура аналогична изоэлектронной Al2Cl6 димер. Аналог кислорода, диметафосфат п
2О2−
6, напротив, неизвестно, благоприятствуют ли метафосфаты полимерным структурам цепей или колец.[9] - п
2S2−
8 и п
2S2−
10 связаны с п
2S2−
6 но их два мостиковых атома −S− заменены на −S − S− в п
2S2−
8 и мостом −S − S − S− в п
2S2−
10.[11] - п2S4−
6 Они образуют водостойкие соли.[12] Анион имеет этан -подобная структура и содержит связь P − P. Формальная степень окисления фосфора +4. Аналог кислорода - анион гиподифосфата, п
2О4−
6. - п
3S3−
9 содержит шестичленный P3S3 звенеть. Соль аммония получают по реакции P4S10 в жидком аммиаке.[13] Другой способ визуализации структуры - это P4S10 адамантан (П4О10) структура с ПС3+ вершина удалена. - п
4S4−
8 содержит квадрат P4 звенеть,[8] п
5S5−
10 содержит P5 кольцо и п
6S6−
12 а P6 звенеть.[11] Эти (PS−
2)
п циклические анионы содержат P со степенью окисления +3. Обратите внимание, что они не тригональные, поскольку мышьяк (III) находится в арсениты, но являются тетраэдрическими с двумя связями с другими атомами фосфора и двумя с серой. В п
6S6−
12 анион аналогичен п
6О6−
12 кольцевой анион.[14] - п
4S2−
2 Необычный ион в форме бабочки SP (P2) PS, которую можно представить как п4 молекула, в которой две связи P-S заменяют одну связь P-P.[15] - п
7S3−
3 представляет собой кластерный анион сульфидогептафосфана.[8]
использованная литература
- ^ а б Дж. Свара, Н. Веферлинг, Т. Хофманн «Соединения фосфора, органические» в Энциклопедии промышленной химии Ульмана, Wiley-VCH, Weinheim, 2006. Дои:10.1002 / 14356007.a19_545.pub2
- ^ Х. Спайкс "История и механизмы ZDDP" Письма о трибологии, Vol. 17, No. 3, октябрь 2004 г. Дои:10.1023 / B: TRIL.0000044495.26882.b5.
- ^ Куррек, Дж., «Антисмысловые технологии. Улучшение с помощью новых химических модификаций», European Journal of Biochemistry 2003, 270, 1628-1644.Дои:10.1046 / j.1432-1033.2003.03555.x
- ^ Lorsch JR; Бартель Д.П. Шостак JW (1995). «Обратная транскриптаза считывает 2'-5'-связь и 2'-тифосфат в шаблоне». Нуклеиновые кислоты Res. 23 (15): 2811–2814. Дои:10.1093 / nar / 23.15.2811. ЧВК 307115. PMID 7544885.
- ^ Poat JC и др. (1990). "Гетеробиметаллический комплекс платины и цинка с тиофосфатным мостиком: [(Me2PhP)2Pt {OSP (OR)2}2ZnCl2". J. Chem. Soc., Chem. Commun.: 1036–1038.
- ^ Р. Клемент «Фосфор» в Справочнике по препаративной неорганической химии, 2-е изд. Под редакцией Г. Брауэра, Academic Press, 1963, NY. Vol. 1., с. 571.
- ^ Димитров, А .; Hartwich, I .; Ziemer, B .; Heidemann, D .;; Майзель, М. (2005). "Synthese, Charakterisierung und Struktur des donorstabilisierten monomeren [PS3]− - Анионы (монометатритиофосфаты) ». Zeitschrift für anorganische und allgemeine Chemie. 631: 2439–2444. Дои:10.1002 / zaac.200500246.CS1 maint: лишняя пунктуация (ссылка на сайт)
- ^ а б c Гринвуд, Норман Н.; Эрншоу, Алан (1984). Химия элементов. Оксфорд: Pergamon Press. С. 509–510. ISBN 978-0-08-022057-4.
- ^ а б Фосфор: химия, биохимия и технология, шестое издание, 2013 г., D.E.C. Корбридж, CRC Pres, Taylor Francis Group, ISBN 978-1-4398-4088-7
- ^ Aitken, Jennifer A .; Канлас, Кристиан; Великий, Дэвид П .; Канатзидис, Меркури Г. (2001). "[П2S10]4−: Новый политиофосфат-анион, содержащий фрагмент тетрасульфида ». Неорганическая химия. 40 (25): 6496–6498. Дои:10.1021 / ic010664p. ISSN 0020-1669.
- ^ а б Холлеман, Арнольд Фредерик; Виберг, Эгон (2001), Виберг, Нильс (ред.), Неорганическая химия, переведенный Иглсоном, Мэри; Брюэр, Уильям, Сан-Диего / Берлин: Academic Press / De Gruyter, стр. 734–735, ISBN 0-12-352651-5
- ^ Гжикай, Мимоза; Эрхардт, Клаус (2007). «Новые гексахалькогено-гиподифосфаты щелочных металлов: синтез, кристаллическая структура и колебательные спектры гидратов гексатиодифосфата (IV) K4[П2S6] · 4 H2O, Rb4[П2S6] · 6 H2O и Cs4[П2S6] · 6 H2О ". Zeitschrift für anorganische und allgemeine Chemie. 633 (7): 1048–1054. Дои:10.1002 / zaac.200600339. ISSN 0044-2313.
- ^ Wolf, G.-U .; Мейзел М. (1982). "Beiträge zur Chemie von Phosphorverbindungen mit Adamantanstruktur. VII [1]. Über Darstellung und Eigenschaften von Nonathio-cyclotriphosphat". Zeitschrift für anorganische und allgemeine Chemie. 494 (1): 49–54. Дои:10.1002 / zaac.19824940106. ISSN 0044-2313.
- ^ Эберт, М .; Насслер, Дж. (1989). "Кольцевая кислота, H6п6О12 и кольцевая кислота, H4п4О10 и их соли ". Фосфор, сера, кремний и родственные элементы. 41 (3–4): 462. Дои:10.1080/10426508908039741. ISSN 1042-6507.
- ^ Роттер, Кристиана; Шустер, Майкл; Карагиосов, Константин (2009). «Необычный бинарный анион фосфор-теллур и его селено- и тио- аналоги: п
4Ch2−
2 (Ch = S, Se, Te) ". Неорганическая химия. 48 (16): 7531–7533. Дои:10.1021 / ic901149m. ISSN 0020-1669.





