Фосфонат - Phosphonate
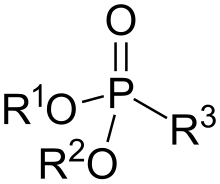
Фосфонаты и фосфоновые кислоты находятся фосфорорганические соединения содержащий C − PO (OH)2 или C − PO (ИЛИ)2 группы (где R = алкил, арил ). Фосфоновые кислоты, с которыми обычно обращаются в виде солей, обычно представляют собой нелетучие твердые вещества, которые плохо растворимы в органических растворителях, но растворимы в воде и обычных спиртах. Многие коммерчески важные соединения представляют собой фосфонаты, в том числе глифосат (активная молекула гербицида «Раундап»), и Этефон, широко используемый регулятор роста растений. Бисфосфонаты популярные препараты для лечения остеопороз.[1]
В биологии и медицинской химии фосфонатные группы используются как стабильные биоизотеры для фосфата, например, в аналоге противовирусного нуклеотида, Тенофовир, один из краеугольных камней анти-ВИЧ терапия.
Основные свойства
Фосфонаты содержат тетраэдрические центры фосфора. Они структурно тесно связаны с (и часто готовятся из) фосфористая кислота.[2]

Соли фосфонатов являются результатом депротонирования фосфоновых кислот, которые являются дипротонными кислотами:
- RPO (ОН)2 + NaOH → H2O + RPO (OH) (ONa) (фосфонат натрия)
- RPO (OH) (ONa) + NaOH → H2O + RPO (ONa)2 (фосфонат динатрия)
Сложные эфиры фосфоновой кислоты являются результатом конденсации фосфоновых кислот со спиртами.
Синтез
Существует несколько методов получения фосфоновых кислот и их солей.
Из фосфоновой кислоты
Большинство процессов начинаются с фосфористая кислота (также известная как фосфоновая кислота, H3PO3), используя его реактивную связь P-H.[1][2]
Фосфоновая кислота может быть алкилирована под действием Манних условия для получения аминометилированных фосфонатов, которые используются в качестве комплексообразователей. Одним из примеров является промышленное приготовление нитрилотрис (метиленфосфоновая кислота):
- NH3 + 3 часа3PO3 + 3 канала2O → N (CH2PO3ЧАС2)3 + 3 часа2О
Фосфоновая кислота также может быть алкилирована акриловая кислота производные для получения фосфоновых кислот, функционализированных карбоксильными группами. Эта реакция является вариантом Майкл дополнение:
- CH2= CHCO2R + 3 H3PO3 → (HO)2P (O) CH2CH2CO2р
в Муфта Hirao диалкил фосфиты (которые также можно рассматривать как диэфиры фосфоновой кислоты: (O = PH (OR)2) подвергаются катализируемой палладием реакции сочетания с арилгалогенид с образованием фосфоната.
Реакция Михаэлиса-Арбузова
Сложные эфиры фосфоновой кислоты получают с использованием Реакция Михаэлиса – Арбузова. Например, метилиодид катализирует превращение триметилфосфита в сложный эфир фосфоновой кислоты. диметилметилфосфонат:
- P (OMe)3 → MePO (OMe)2
Эти сложные эфиры можно гидролизовать до кислоты (Me = метил):
- MePO (OMe)2 + H2О → МеПО (ОН)2 + 2 МеОН
в Реакция Михаэлиса – Беккера сначала депротонируют сложный диэфир гидрофосфоновой кислоты и алкилируют полученный анион.
Из трихлорида фосфора
Винилфосфоновая кислота может быть получен реакцией PCl3 и ацетальдегид:
- PCl3 + CH3CHO → CH3CH (O−)PCl+
3
Этот аддукт реагирует с уксусной кислотой:
- CH3CH (O−)PCl+
3 + 2 канала3CO2H → CH3CH (Cl) PO (OH)2 + 2 канала3COCl
Этот хлорид подвергается дегидрохлорированию, чтобы получить цель:
- CH3CH (Cl) PO (OH)2 → CH2= CHPO (OH)2 + HCl
в Киннер-Перрен реакция алкилфосфонилдихлориды и сложные эфиры образуются алкилирование из трихлорид фосфора в присутствии трихлорид алюминия. Соли алкилтрихлорфосфония являются промежуточными продуктами:[1]
- PCl3 + RCl + AlCl3 → RPCl+
3 + AlCl−
4
RPCl+
3 затем продукт может быть разложен водой с образованием дихлорида алкилфосфоновой кислоты RP (= O) Cl2.
Реакции
Гидролиз
Сложные эфиры фосфоновой кислоты обычно подвержены гидролизу как в кислых, так и в основных условиях. Расщепление связи P-C сложнее, но может быть достигнуто в агрессивных условиях.
- O = ПК (ИЛИ)2 + 2 часа2О → О = ПК (ОН)2 + 2 ROH
Реакция Хорнера – Уодсворта – Эммонса
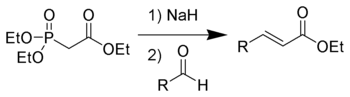
в Реакция Хорнера – Уодсворта – Эммонса диалкилфосфонаты депротонируются с образованием стабилизированной карбанионы, которые реагируют с альдегиды дать Е-алкены с отщеплением диалкил-фосфат.[3]
Структурные подклассы
Бисфосфонаты

Соединения, содержащие 2 близнец фосфонатные группы известны как бисфосфонаты. Впервые они были синтезированы в 1897 г. Фон Байер и Hofmann и теперь составляют основу важного класса лекарств, используемых для лечения остеопороза и подобных заболеваний. Примеры включают HEDP (этидроновая кислота или дидронел), который получают из фосфористой кислоты и уксусный ангидрид:[1]
- 2 ч3PO3 + (CH3CO)2O → CH3С (ОН) (ПО3ЧАС2)2 + CH3CO2ЧАС
Тиофосфонаты
А тиофосфонат группа представляет собой функциональную группу, связанную с фосфонатом путем замещения атома кислорода на серу. Они являются реактивным компонентом многих пестициды и нервно-паралитические вещества. Замещенные тиофосфонаты могут иметь 2 основных структурные изомеры связывание через группы O или S с образованием форм тиона и тиола соответственно. Это свойство они разделяют со связанными функциональными группами, такими как тиокарбоновые кислоты и органотиофосфаты.
Фосфонамидаты
Фосфонамидаты связаны с фосфонатами за счет замещения атома кислорода атомом азота. Они представляют собой редко встречающуюся функциональную группу, нервно-паралитические агенты. Табун это пример.
Встречаемость в природе

Фосфонаты - один из трех источников поступления фосфатов в биологические клетки.[нужна цитата ] Два других - это неорганический фосфат и органофосфаты.
Встречающаяся в природе фосфонат 2-аминоэтилфосфоновая кислота была впервые обнаружена в 1959 году у растений и многих животных, где она локализуется в мембранах. Фосфонаты довольно распространены среди разных организмов, от прокариоты к эубактерии и грибы, моллюски, насекомые и другие. Впервые о них сообщили в естественных почвах Ньюман и Тейт (1980). Биологическая роль природных фосфонатов еще плохо изучена. Бис- или полифосфонаты не встречаются в природе.
Ряд фосфонатных веществ натуральных продуктов с антибиотик свойства были идентифицированы.[4] Фосфонатные антибиотики из натуральных продуктов включают: фосфомицин который одобрен FDA для лечения несложных инфекция мочевыводящих путей а также несколько доклинических исследованных веществ, таких как фосмидомицин (ингибитор изопренилсинтазы), SF-2312 (ингибитор гликолитического фермента энолаза,[5] и вещества с неизвестным образом действия, такие как алахопцин. Хотя фосфонаты в значительной степени непроницаемы для клеток, природные фосфонатные антибиотики эффективны против ряда организмов, поскольку многие виды бактерий экспрессируют импортеры глицерин-3-фосфата и глюкозо-6-фосфата, которые могут быть захвачены фосфонатными антибиотиками. Устойчивые к фосфомицину бактериальные штаммы часто имеют мутации, инактивирующие эти переносчики; однако такие мутации не поддерживаются в отсутствие антибиотика из-за дороговизны, которую они накладывают.
Использует
В 1998 году потребление фосфонатов во всем мире составило 56 000 тонн: 40 000 тонн в США, 15 000 тонн в Европе и менее 800 тонн в Японии. Спрос на фосфонаты неуклонно растет на 3% ежегодно.
Хеланты металлов
Поскольку работа Герольд Шварценбах в 1949 г. фосфоновые кислоты известны как эффективные хелатирующие агенты. Введение амин группу в молекулу, чтобы получить −NH2−C − PO (ОН)2 увеличивает способность фосфоната к связыванию металлов. Примерами таких соединений являются NTMP, EDTMP и DTPMP. Эти фосфонаты являются структурными аналогами хорошо известных аминополикарбоксилат Такие как EDTA. Стабильность комплексов металлов увеличивается с увеличением числа групп фосфоновой кислоты. Фосфонаты хорошо растворимы в воде, в то время как фосфоновые кислоты очень слабо растворимы.
Фосфонаты - эффективные хелатирующие агенты. То есть они прочно связываются с ионами двух- и трехвалентных металлов, что полезно в умягчение воды. Таким образом они предотвращают образование нерастворимых осадков (накипи). Связывание этих лигандов также подавляет каталитические свойства ионов металлов. Они устойчивы в суровых условиях. По этим причинам фосфонаты в промышленности широко используются в охлаждающих водах, системах опреснения и на нефтяных месторождениях для предотвращения образования накипи. Фосфонаты также регулярно используются в системах обратного осмоса в качестве антискалантов. Фосфонаты в системах охлаждающей воды также служат для контроля коррозии чугуна и стали. В целлюлозно-бумажной и текстильной промышленности они служат «стабилизаторами пероксидного отбеливателя», хелатируя металлы, которые могут инактивировать пероксид. В моющих средствах они используются в качестве комбинации хелатирующего агента, ингибитора образования отложений и стабилизатора отбеливания. Фосфонаты также все чаще используются в медицине для лечения нарушений, связанных с формированием костей и метаболизмом кальция. Кроме того, они служат переносчиками радионуклидов при лечении рака костей (см. самарий-153-этилендиаминтетраметиленфосфонат ).
Бетонные добавки
Фосфонаты также используются в качестве замедлителей схватывания бетона.[6][7] Они задерживают время схватывания цемента, позволяя дольше укладывать бетон или распределять тепло гидратации цемента на более длительный период времени, чтобы избежать слишком высокой температуры и возникающих трещин. Они также обладают хорошими диспергирующими свойствами и поэтому исследуются как возможный новый класс суперпластификаторов. Однако в настоящее время фосфонаты не являются коммерчески доступными в качестве суперпластификаторов. Суперпластификаторы - это добавки к бетону, предназначенные для увеличения текучести и удобоукладываемости бетона или для уменьшения водоцементного (в / ц) отношения. Уменьшая содержание воды в бетоне, он уменьшает его пористость, улучшая таким образом механические свойства (прочность на сжатие и растяжение) и долговечность бетона (снижая свойства переноса воды, газа и растворенных веществ).[8]
Лекарство
В медицине фосфонаты и бисфосфонаты обычно используются в качестве ингибиторов ферментов, которые используют фосфаты и дифосфаты в качестве субстратов. В частности, эти ферменты включают те, которые производят промежуточные продукты биосинтеза холестерина.[9]
Фосфонат аналоги нуклеотидов, Такие как Тенофовир, Цидофовир и Адефовир критические противовирусные препараты, которые в различных пролекарственных формах используются для лечения ВИЧ, гепатит Б и другие.
Ниша использует
В сочетании с органосиликатами фосфонаты также используются для лечения «внезапной смерти дуба», вызванной грибковым эукариотом. Phytophthora ramorum.
Токсикология
Токсичность фосфонатов для организмов, живущих в воде, невысока. Сообщенные значения для 48-часовой LC50 значения для рыбы составляют от 0,1 до 1,1 мМ. Так же коэффициент биоконцентрации для рыбы очень низкий.
Биоразложение
В природе бактерии играют главную роль в разложении фосфонатов.[10] Из-за присутствия в окружающей среде природных фосфонатов бактерии развили способность метаболизировать фосфонаты в качестве источников питательных веществ. Некоторые бактерии используют фосфонаты в качестве источника фосфора для роста. Аминофосфонаты также могут использоваться некоторыми бактериями как единственный источник азота. Полифосфонаты, используемые в промышленности, сильно отличаются от природных фосфонатов, таких как 2-аминоэтилфосфоновая кислота, поскольку они намного крупнее, несут высокий отрицательный заряд и образуют комплексы с металлами. Тесты на биоразложение осадка от городских очистных сооружений с HEDP и NTMP не показали никаких признаков разложения. Исследование HEDP, NTMP, EDTMP и DTPMP в стандартных тестах на биоразложение также не позволило идентифицировать какое-либо биоразложение. Однако было отмечено, что в некоторых испытаниях из-за высокого соотношения ила к фосфонату наблюдалось удаление исследуемого вещества из раствора по мере потери DOC. Этот фактор был связан с адсорбцией, а не с биоразложением. Однако бактериальные штаммы, способные разлагать аминополифосфонаты и HEDP в условиях ограниченного фосфора, были выделены из почв, озер, сточных вод, активного ила и компоста.
«Биоразложения фосфонатов во время очистки воды не наблюдается, но фотодеградация Fe (III) -комплексов является быстрым. Аминополифосфонаты также быстро окисляются в присутствии Mn (II) и кислорода, и образуются стабильные продукты разложения, обнаруженные в сточных водах. Отсутствие информации о фосфонатах в окружающей среде связано с аналитическими проблемами их определения в следовых концентрациях в природных водах. Фосфонаты присутствуют в природных водах в основном в виде комплексов Ca и Mg и поэтому не влияют на состав или перенос металлов ».[11] Фосфонаты сильно взаимодействуют с некоторыми поверхностями, что приводит к значительному удалению в технических и природных системах.
Фосфонатные соединения
- Тенофовир алафенамид: Пролекарство аналога нуклеотидов Тенофовира, важного для лечения ВИЧ.
- AMPA: Аминометилфосфоновая кислота, продукт разложения глифосата
- Винилфосфоновая кислота: мономер
- Диметилметилфосфонат (DMMP), один из простейших диэфиров фосфоновой кислоты
- Этидроновая кислота (HEDP): 1-гидроксиэтилиден-1,1-дифосфоновая кислота, используемая в детергентах, очистке воды, косметике и фармацевтике.
- ATMP: Аминотрис (метиленфосфоновая кислота), хелатирующий агент.
- EDTMP: Этилендиаминтетра (метиленфосфоновая кислота), хелатирующий агент.
- TDTMP: тетраметилендиаминтетра (метиленфосфоновая кислота), хелатирующий агент
- HDTMP: гексаметилендиаминтетра (метиленфосфоновая кислота), хелатирующий агент
- DTPMP: Диэтилентриаминпента (метиленфосфоновая кислота), хелатирующий агент.
- PBTC: фосфонобутантрикарбоновая кислота
- PMIDA: N- (фосфонометил) иминодиуксусная кислота
- CEPA: 2-карбоксиэтилфосфоновая кислота
- HPAA: 2-гидроксифосфонокарбоновая кислота
- AMP: Aminotris (метиленфосфоновая кислота)
- BPMG: N,N-Бис (фосфонометил) глицин
- Глифосат: обычный сельскохозяйственный гербицид
- Фоскарнет: для лечения герпеса
- Перзинфотель: для лечения инсульта
- SF2312: натуральный продукт, ингибитор фосфонатного антибиотика энолаза
- Сельфотель: брошенный экспериментальный препарат от инсульта
Смотрите также
- Фосфорорганический соединения
- Оксид фосфина - OPR3
- Фосфинит - П (ИЛИ) R2
- Фосфонит - P (ИЛИ)2р
- Фосфит - P (ИЛИ)3
- Фосфинат - OP (OR) R2
- Фосфат - OP (ИЛИ)3
Рекомендации
- ^ а б c d Svara, J .; Weferling, N .; Хофманн, Т. «Соединения фосфора, органические», в Энциклопедия промышленной химии Ульмана, Wiley-VCH, Weinheim, 2008. Дои:10.1002 / 14356007.a19_545.pub2.
- ^ а б Современная химия фосфонатов Филипп Савиньяк и Богдан Йорга, CRC Press, Бока-Ратон, Флорида, 2003. ISBN 0-8493-1099-7
- ^ Бутаги, Джон; Томас, Ричард (февраль 1974 г.). «Синтез олефинов с карбанионами органических фосфонатов». Химические обзоры. 74 (1): 87–99. Дои:10.1021 / cr60287a005.
- ^ Джу К.С., Дорогази-младший, Меткалф WW (2014). «Открытие с помощью геномики натуральных фосфонатных продуктов и путей их биосинтеза». J. Ind. Microbiol. Биотехнология. 41 (2): 345–356. Дои:10.1007 / s10295-013-1375-2. ЧВК 3946943. PMID 24271089.
- ^ Леонард П.Г., Сатани Н., Максвелл Д., Лин Й.Х., Хаммуди Н., Пенг З., Писанески Ф., Линк TM, Ли Г.Р., Сан Д., Прасад Б.А., Ди Франческо М.Э., Чако Б., Асара Дж.М., Ван Я., Борнманн В., ДеПиньо РА, Мюллер Флорида (декабрь 2016 г.). «SF2312 - природный фосфонатный ингибитор енолазы». Природа Химическая Биология. 12 (12): 1053–1058. Дои:10.1038 / nchembio.2195. ЧВК 5110371. PMID 27723749.
- ^ Рамачандран, В. С .; Лоури, М. С .; Мудрый, Т .; Поломарк, Г. М. (1993). «Роль фосфонатов в гидратации портландцемента». Материалы и конструкции. 26 (7): 425–432. Дои:10.1007 / BF02472943. ISSN 0025-5432. S2CID 97857221.
- ^ Кольер, Николас С .; Milestone, Neil B .; Трэвис, Карл П .; Гибб, Фергус. (2016). «Влияние органических замедлителей схватывания на сгущение и схватывание раствора при захоронении высокоактивных радиоактивных отходов в глубоких скважинах». Прогресс в атомной энергетике. 90: 19–26. Дои:10.1016 / j.pnucene.2016.02.021. ISSN 0149-1970.
- ^ Flatt, R .; Шобер И. (2012). «Суперпластификаторы и реология бетона». Понимание реологии бетона. С. 144–208. Дои:10.1533/9780857095282.2.144. ISBN 9780857090287.
- ^ Wiemer, AJ; Hohl, RJ; Вимер, Д. Ф. (июнь 2009 г.). «Промежуточные ферменты метаболизма изопреноидов как противораковые мишени». Противораковые средства в медицинской химии. 9 (5): 526–42. Дои:10.2174/187152009788451860. PMID 19519294.
- ^ Хуан Дж., Су З., Сюй Й. (ноябрь 2005 г.). «Эволюция микробных путей деградации фосфонатов». Журнал молекулярной эволюции. 61 (5): 682–90. Bibcode:2005JMolE..61..682H. Дои:10.1007 / s00239-004-0349-4. PMID 16245012. S2CID 13414302.
- ^ Новак Бернд (2003). «Экологическая химия фосфонатов». Водные исследования. 37 (11): 2533–2546. Дои:10.1016 / S0043-1354 (03) 00079-4. PMID 12753831.
дальнейшее чтение
- Ньюман Р.Х., Тейт К.Р. (1980). "Почва, характеризующаяся 31Ядерный магнитный резонанс ". Коммуникации в области почвоведения и анализа растений. 11: 835–842. Дои:10.1080/00103628009367083.
- Абхиманью С. Параскар и Арумугам Судалай (2006). "Роман Cu (OTf)"2 опосредованный трехкомпонентным синтезом α-аминофосфонатов с высоким выходом » (PDF). Аркивок (1838EP): 183–9.[постоянная мертвая ссылка ]
- Сингх Р., Нолан С.П. (ноябрь 2005 г.). «Синтез сложных эфиров фосфора путем переэтерификации при посредничестве N-гетероциклические карбены (NHC) ». Химические коммуникации (43): 5456–8. Дои:10.1039 / b509783e. PMID 16261245.