Имиде - Imide

В органическая химия, имид это функциональная группа состоящий из двух ацил группы, связанные с азот.[1] Соединения структурно родственны ангидриды кислот, хотя имиды более устойчивы к гидролизу. С точки зрения коммерческого применения имиды наиболее известны как компоненты высокопрочных полимеров, называемых полиимиды. Неорганические имиды также известны как твердые или газообразные соединения, и имидогруппа (= NH) также может действовать как лиганд.
Номенклатура
Большинство имидов представляют собой циклические соединения, полученные из дикарбоновые кислоты, и их названия отражают исходную кислоту.[2] Примеры сукцинимид, происходит от Янтарная кислота, и фталимид, происходит от фталевая кислота. Для имидов, полученных из амины (в отличие от аммиака) N-замещающий обозначается префиксом. Например, N-этилсукцинимид получают из янтарной кислоты и этиламин. Изоимидес изомеры с нормальными имидами и имеют формулу RC (O) OC (NR ') R ″. Часто они являются промежуточными продуктами, которые превращаются в более симметричные имиды. Органические соединения, называемые карбодиимиды имеют формулу RN = C = NR. Они не имеют отношения к имидам.
Имиды дикарбоновых кислот
В PubChem ссылки предоставляют доступ к дополнительной информации о соединениях, включая другие названия, идентификаторы, токсичность и безопасность.
п Распространенное имя Систематическое название Структура PubChem исходная кислота структура 2 Сукцинимид Пирролидин-2,5-дион 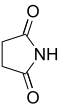
11439 Янтарная кислота 
2, ненасыщенные, цис-углерод-углеродные двойные связи Малеимид Пиррол-2,5-дион 
10935 Малеиновая кислота 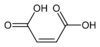
3 Глутаримид Пиперидин-2,6-дион 
70726 Глутаровая кислота 
6 Фталимид Изоиндол-1,3-дион 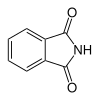
6809 Фталевая кислота 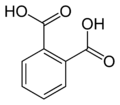
Характеристики
Обладая высокой полярностью, имиды хорошо растворяются в полярных средах. N – H-центр имидов, полученных из аммиака, является кислым и может участвовать в водородная связь. В отличие от структурно родственных ангидридов кислот, они устойчивы к гидролизу, а некоторые даже могут перекристаллизованный из кипятка.
Возникновение и приложения
Многие высокопрочные или электропроводящие полимеры содержат имидные субъединицы, т.е. полиимиды. Одним из примеров является Каптон где повторяющееся звено состоит из двух имидных групп, полученных из ароматических тетракарбоновых кислот.[3] Другим примером полиимидов является полиглутаримид, обычно получаемый из полиметилметакрилата (ПММА) и аммиака или первичного амина путем аминолиза и циклизации ПММА при высокой температуре и давлении, обычно в экструдере. Этот метод называется реактивной экструзией. Коммерческий полиглутаримидный продукт на основе метиламинного производного ПММА, названный Kamax, был произведен компанией Rohm and Haas. Прочность этих материалов отражает жесткость имидной функциональной группы.
Интерес к биоактивности имидсодержащих соединений был вызван ранним открытием высокой биоактивности этих соединений. Циклогексимид как ингибитор биосинтеза белка у некоторых организмов. Талидомид, известный своими побочными эффектами, является одним из результатов этого исследования. Номер фунгициды а гербициды содержат имидную функциональность. Примеры включают Captan, который при некоторых условиях считается канцерогенным, и Процимидон.[4]

В 21 веке возник новый интерес к иммуномодулирующим эффектам талидомида, что привело к созданию класса иммуномодуляторов, известных как иммуномодулирующие имидные препараты (IMiDs).
Подготовка
Наиболее распространенные имиды получают нагреванием дикарбоновых кислот или их ангидридов и аммиак или первичный амины. В результате реакция конденсации:[5]
- (RCO)2O + R′NH2 → (RCO)2NR ′ + H2О
Эти реакции протекают через посредство амиды. Внутримолекулярная реакция карбоновой кислоты с амидом намного быстрее, чем межмолекулярная реакция, которая наблюдается редко.
Они также могут быть получены путем окисления амиды, особенно при запуске с лактамы.[6]
- R (CO) NHCH2R '+ 2 [O] → R (CO) N (CO) R' + H2О
Некоторые имиды также могут быть получены в виде изоимида в имид. Мумия перестановка.
Реакции
Для имидов, полученных из аммиака, N – H-центр является слабокислым. Таким образом, соли имидов щелочных металлов могут быть получены с использованием обычных оснований, таких как гидроксид калия. Конъюгированное основание фталимида фталимид калия. Эти анионы можно алкилировать, чтобы получить N-алкилимиды, которые, в свою очередь, могут разлагаться с высвобождением первичного амина. Сильные нуклеофилы, такие как гидроксид калия или гидразин используются на этапе выпуска.
Обработка имидов галогенами и основанием дает N-галогенпроизводные. Примеры, которые полезны в органический синтез находятся N-хлорсукцинимид и N-бромсукцинимид, которые соответственно служат источниками «Cl+"и" Br+" в органический синтез.
Имиды в координационной химии
В координационная химия имидокомплексы переходных металлов показать NR2- лиганд. В некоторых отношениях они похожи на оксолиганды. В некоторых случаях угол M-N-C составляет 180 °, но часто угол явно изогнут. Исходный имид (NH2-) является промежуточным звеном в азотфиксация синтетическими катализаторами.[7]

Рекомендации
- ^ «Имидес». Сборник химической терминологии ИЮПАК. 2009. Дои:10.1351 / goldbook.I02948. ISBN 978-0-9678550-9-7.
- ^ Мартынов, А. В. (2005-12-06). «Новый подход к синтезу имидов транс-аконитовой кислоты». ХимИнформ. 36 (49): нет. Дои:10.1002 / подбородок.200549068. ISSN 1522-2667.
- ^ Уолтер У. Райт и Майкл Холден-Аббертон «Полиимиды» в Энциклопедия промышленной химии Ульмана, 2002, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a21_253
- ^ Петер Акерманн, Пауль Марго, Франц Мюллер «Фунгициды, сельскохозяйственные» в Энциклопедия промышленной химии Ульмана, 2002, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a12_085
- ^ Винсент Родескини, Найджел С. Симпкинс и Фэнчжи Чжанги (2009). «Иллюстративное образование имида из амина и ангидрида». Органический синтез.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 11, п. 1028
- ^ Сперри, Джонатан (27 сентября 2011 г.). «Окисление амидов до имидов: мощное синтетическое преобразование». Синтез. 2011 (22): 3569–3580. Дои:10.1055 / с-0030-1260237.
- ^ Nugent, W.A .; Майер, Дж. М., "Множественные связи металл-лиганд", Дж. Вили: Нью-Йорк, 1988.
- ^ Hazari, N .; Маунтфорд, П., "Реакции и применение имидо-комплексов титана", Acc. Chem. Res. 2005, 38, 839-849. Дои:10.1021 / ar030244z






