Белок из трех пальцев - Википедия - Three-finger protein
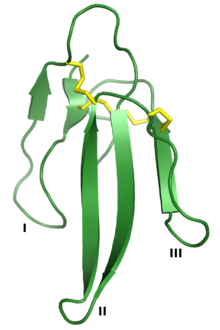
| Белок с тремя пальцами | |
|---|---|
| Идентификаторы | |
| Символ | ? |
| CATH | 1qkd |
| SCOP2 | 1qkd / Объем / СУПФАМ |
Трехпальцевые белки или же трехпальцевые белковые домены (3FP или же TFPD) площадь белковое суперсемейство состоящий из небольших, примерно 60-80 аминокислотный остаток белковые домены с общим третичная структура: три бета-прядь петли выходили из гидрофобное ядро стабилизируется дисульфидные связи. Семейство названо в честь вытянутых «пальцев» трех петель. Члены семьи не имеют ферментативный активности, но способны формировать белок-белковые взаимодействия с высоким специфичность и близость. Члены-основатели семьи, также лучше всего характеризующиеся структурой, являются токсины из трех пальцев нашел в Змеиный яд, которые имеют множество фармакологический эффекты, чаще всего в результате нарушения холинергический сигнализация. Семейство также представлено нетоксичными белками, которые имеют широкий таксономический распределение; 3FP домены встречаются в внеклеточные домены некоторых рецепторы клеточной поверхности а также в GPI-якорь и секретный глобулярные белки, обычно участвует в передаче сигналов.[2][3][4][5]
Токсины с трех пальцев
Члены-основатели семейства 3FP являются токсины из трех пальцев (3FTx) часто встречается в Змеиный яд. Белки 3FTx широко распространены в семьях ядовитых змей, но особенно богаты белками семья Elapidae, в котором относительная доля 3FTx по отношению к другим токсинам яда может достигать 95%.[4][6] Многие белки 3FTx являются нейротоксины, хотя механизм токсичности значительно различается даже среди белков с относительно высоким идентичность последовательности; общие белковые мишени включают те, которые участвуют в холинергический сигнализация, такая как никотиновые рецепторы ацетилхолина, мускариновые рецепторы ацетилхолина, и ацетилхолинэстераза. Еще одно большое подсемейство белков 3FTx - это кардиотоксины (также известные как цитотоксины или цитолизины); эта группа напрямую цитотоксический скорее всего, из-за взаимодействия с фосфолипиды и, возможно, другие компоненты клеточная мембрана.[2]
Семейство Ly6 / uPAR

Семейство Ly6 / uPAR широко описывает генная семья содержащий три пальца белковые домены которые не являются токсичными и не ядовитыми компонентами; их часто называют LU домены и его можно найти в внеклеточные домены из рецепторы клеточной поверхности и в любом GPI-якорь или же секретный глобулярные белки.[4][8] Семейство названо в честь двух репрезентативных групп членов, малых глобулярных белков. лимфоцитарный антиген 6 (LY6) семья и рецептор активатора плазминогена урокиназы (uPAR).[9] Другие рецепторы с доменами LU включают членов трансформирующий бета-рецептор фактора роста (TGF-beta) суперсемейство, такое как рецептор активина 2 типа;[10] и рецептор костного морфогенетического белка, тип IA.[11] Другие белки домена LU представляют собой небольшие глобулярные белки, такие как CD59 антиген, LYNX1, SLURP1, и SLURP2.[4][12]
Многие белки, содержащие домен LU, участвуют в холинергический сигнализация и привязка ацетилхолин рецепторов, в частности, связывая их функцию с общим механизм токсичности 3FTx.[4][8][13] Считается, что члены семейства Ly6 / uPAR являются эволюционными предками токсинов 3FTx.[14] Другие белки LU, такие как CD59 антиген, имеют хорошо изученные функции в регуляции иммунная система.[13]
Структура гена
Змеиные токсины трех пальцев и члены семейства Ly6 / uPAR имеют общие ген структура, обычно состоящая из двух интроны и три экзоны. Последовательность первого экзона в целом хорошая. консервированный по сравнению с двумя другими.[4] Третий экзон содержит основные отличительные признаки между двумя группами, так как именно здесь C-терминал GPI-якорь кодируется пептид, обычный среди глобулярных белков Ly6 / uPAR.[4][13]
Эволюция и таксономическое распространение
Белки общей трехпалой складки широко распространены среди многоклеточные животные.[4] 2008 г. биоинформатика исследование выявило около 45 примеров таких белков, содержащих до трех трехпальцевых доменов, представленных в человеческий геном.[12] Более свежий профиль Ly6 / uPAR генная семья идентифицировали 35 человек и не менее 61 мышь члены семьи в соответствующих геномах организмов.[8]
Считается, что семейство белков с тремя пальцами расширилось за счет дупликация гена в змея происхождение.[14][15] Токсины 3FTx считаются ограниченными Caenophidia, таксон, содержащий все ядовитые змеи; однако по крайней мере один гомолог был идентифицирован в Бирманский питон, близкородственная подгруппа.[16] Традиционно считалось, что гены 3FTx эволюционировали в результате повторяющихся событий дупликации, за которыми следовали неофункционализация и набор в экспрессия гена узоры ограничиваются ядовитыми железами.[14][15] Однако утверждалось, что этот процесс должен происходить крайне редко и что субфункционализация лучше объясняет наблюдаемое распределение.[17] Совсем недавно было обнаружено, что нетоксичные белки 3FP широко экспрессируются во многих различных ткани у змей, что привело к альтернативной гипотезе о том, что белки с ограниченной экспрессией в слюна были выборочно задействованы для токсичной функциональности.[16]
Рекомендации
- ^ Nastopoulos V, Kanellopoulos PN, Tsernoglou D (сентябрь 1998 г.). «Структура димерного и мономерного эрабутоксина a уточнена при разрешении 1,5 A» (PDF). Acta Crystallographica. Раздел D, Биологическая кристаллография. 54 (Pt 5): 964–74. Дои:10.1107 / S0907444998005125. PMID 9757111.
- ^ а б Кини Р.М., Доли Р. (ноябрь 2010 г.). «Структура, функции и эволюция трехпальцевых токсинов: мини-белки с множественными мишенями». Токсикон. 56 (6): 855–67. Дои:10.1016 / j.toxicon.2010.07.010. PMID 20670641.
- ^ Хегде Р.П., Раджагопалан Н., Доли Р., Кини М. (2010). «Змеиный яд трехпалого токсина». В Mackessy SP (ред.). Справочник ядов и токсинов рептилий. Бока-Ратон: CRC Press. С. 287–302. ISBN 9781420008661.
- ^ а б c d е ж грамм час Кесслер П., Маршот П., Сильва М., Сервент Д. (август 2017 г.). «Токсиновая складка из трех пальцев: многофункциональный структурный каркас, способный модулировать холинергические функции». Журнал нейрохимии. 142 Дополнение 2: 7–18. Дои:10.1111 / jnc.13975. PMID 28326549.
- ^ Уткин Ю., Сунагар К., Джексон Т.Н., Рикс Т., Фрай Б.Г. (2015). «Глава 8: Токсины трех пальцев». В Fry B (ред.). Ядовитые рептилии и их токсины: эволюция, патофизиология и биологические открытия. Издательство Оксфордского университета. С. 218–227. ISBN 9780199309405.
- ^ Санс Л., Пла Д., Перес А., Родригес И., Завалета А., Салас М., Ломонте Б., Кальвете Дж. Дж. (Июнь 2016 г.). «Веномный анализ плохо изученной пустынной коралловой змеи, Micrurus tschudii tschudii, поддерживает дихотомию 3FTx / PLA₂ по ядам Micrurus». Токсины. 8 (6): 178. Дои:10.3390 / токсины8060178. ЧВК 4926144. PMID 27338473.
- ^ Лит К.Дж., Джонсон С., Роверси П., Хьюз Т.Р., Смит Р.А., Маккензи Л., Морган Б.П., Ли С.М. (август 2007 г.). «Структуры высокого разрешения растворимого CD59 человека, экспрессируемого бактериями». Acta Crystallographica. Раздел F, Структурная биология и сообщения о кристаллизации. 63 (Pt 8): 648–52. Дои:10.1107 / S1744309107033477. ЧВК 2335151. PMID 17671359.
- ^ а б c Loughner CL, Bruford EA, McAndrews MS, Delp EE, Swamynathan S, Swamynathan SK (апрель 2016 г.). «Организация, эволюция и функции генов семейства Ly6 / uPAR человека и мыши». Геномика человека. 10: 10. Дои:10.1186 / s40246-016-0074-2. ЧВК 4839075. PMID 27098205.
- ^ Плуг М., Эллис В. (август 1994 г.). «Взаимоотношения структура-функция в рецепторе для активатора плазминогена урокиназного типа. Сравнение с другими членами семейства Ly-6 и альфа-нейротоксинами змеиного яда». Письма FEBS. 349 (2): 163–8. Дои:10.1016/0014-5793(94)00674-1. PMID 8050560. S2CID 86302713.
- ^ Гринвальд Дж., Фишер У.Х., Вэйл У.В., Чхве С. (январь 1999 г.). «Трехпальцевая токсиновая складка для внеклеточного лиганд-связывающего домена серинкиназы рецептора активина типа II». Структурная биология природы. 6 (1): 18–22. Дои:10.1038/4887. PMID 9886286. S2CID 26301441.
- ^ Кирш Т., Себальд В., Драйер М.К. (июнь 2000 г.). «Кристаллическая структура комплекса эктодомена BMP-2-BRIA». Структурная биология природы. 7 (6): 492–6. Дои:10.1038/75903. PMID 10881198. S2CID 19403233.
- ^ а б Галат А (ноябрь 2008 г.). «Трехпалый белковый домен генома человека». Клеточные и молекулярные науки о жизни. 65 (21): 3481–93. Дои:10.1007 / s00018-008-8473-8. PMID 18821057. S2CID 19931506.
- ^ а б c Цетлин В.И. (февраль 2015 г.). «Нейротоксины трехпальцевой змеи и белки Ly6, нацеленные на никотиновые рецепторы ацетилхолина: фармакологические инструменты и эндогенные модуляторы». Тенденции в фармакологических науках. 36 (2): 109–23. Дои:10.1016 / j.tips.2014.11.003. PMID 25528970.
- ^ а б c Фрай Б.Г. (март 2005 г.). «От генома к« яду »: молекулярное происхождение и эволюция протеома змеиного яда, выведенные из филогенетического анализа последовательностей токсинов и родственных белков организма». Геномные исследования. 15 (3): 403–20. Дои:10.1101 / гр.3228405. ЧВК 551567. PMID 15741511.
- ^ а б Фрай Б.Г., Казуэлл Н.Р., Вюстер В., Видал Н., Янг Б., Джексон Т.Н. (сентябрь 2012 г.). «Структурная и функциональная диверсификация системы яда рептилий Toxicofera». Токсикон. Прогресс в базовой и трансляционной ядовитости. 60 (4): 434–48. Дои:10.1016 / j.toxicon.2012.02.013. PMID 22446061.
- ^ а б Рейес-Веласко Дж., Кард округ Колумбия, Эндрю А.Л., Шейни К.Дж., Адамс Р.Х., Шилд Д.Р., Кейсвелл Н.Р., Макесси СП, Кастое Т.А. (январь 2015 г.) «Экспрессия гомологов гена яда в различных тканях питона предлагает новую модель эволюции змеиного яда». Молекулярная биология и эволюция. 32 (1): 173–83. Дои:10.1093 / molbev / msu294. PMID 25338510.
- ^ Hargreaves AD, Swain MT, Hegarty MJ, Logan DW, Mulley JF (август 2014 г.). «Ограничение и дупликация генов рекрутирования и происхождение и эволюция токсинов змеиного яда». Геномная биология и эволюция. 6 (8): 2088–95. Дои:10.1093 / gbe / evu166. ЧВК 4231632. PMID 25079342.
внешняя ссылка
- SCOP: SSF57302
- CATH: 2.10.60.10
