Человеческий геном - Human genome
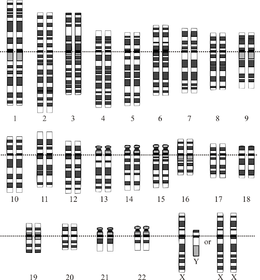 Графическое изображение идеализированного диплоида человека кариотип, показывающий организацию генома в хромосомы. На этом рисунке показаны как женская (XX), так и мужская (XY) версии 23-й пары хромосом. Хромосомы показаны выровненными по их центромеры. Митохондриальная ДНК не показана. | |
| NCBI идентификатор генома | 51 |
|---|---|
| Плоидность | диплоид |
| Размер генома | 3100 Мбит / с[1] (мега-пар оснований) на гаплоидный геном Всего 6200 Мбит / с (диплоид). |
| Количество хромосомы | 23 пары |
В человеческий геном это полный набор последовательности нуклеиновых кислот для люди, закодированный как ДНК в пределах 23 хромосома пары в ядра клеток и в небольшой молекуле ДНК, найденной в индивидуальном митохондрии. Их обычно рассматривают отдельно как ядерный геном и митохондриальный геном.[2] Человек геномы включают как гены ДНК, кодирующие белок, так и некодирующая ДНК. Гаплоидный геномы человека, которые содержатся в стволовые клетки (в яйцо и сперма гамета ячейки, созданные в мейоз фаза половое размножение перед оплодотворение создает зигота ) состоят из трех миллиардов ДНК пар оснований, в то время как диплоид геномы (найдены в соматические клетки ) содержат вдвое больше ДНК. Хотя между геномами людей существуют значительные различия (порядка 0,1% из-за однонуклеотидные варианты[3] и 0,6% при рассмотрении инделы ),[4] они значительно меньше, чем различия между людьми и их ближайшими живыми родственниками, бонобо и шимпанзе (~1.1% исправлено однонуклеотидные варианты [5] и 4% при включении инделей).[6]
Первые последовательности генома человека были опубликованы в почти полной форме в феврале 2001 г. Проект генома человека[7] и Celera Corporation.[8] О завершении проекта по секвенированию генома человека было объявлено в 2004 году, когда был опубликован черновой вариант последовательности генома, в котором остался только 341 пробел в последовательности, представляющий собой сильно повторяющуюся и другую ДНК, которую невозможно было секвенировать с помощью доступной в то время технологии.[9] Геном человека был первым из позвоночных, который был секвенирован до такого почти полного завершения, и по состоянию на 2018 год диплоидные геномы более миллиона отдельных людей были определены с использованием секвенирование следующего поколения.[10] Эти данные используются во всем мире в биомедицинская наука, антропология, криминалистика и другие отрасли науки. Такие геномные исследования привели к успехам в диагностике и лечении заболеваний, а также к новым открытиям во многих областях биологии, включая эволюция человека.
Хотя последовательность генома человека была (почти) полностью определена путем секвенирования ДНК, она еще не полностью изучена. Большинство (хотя, вероятно, не все) гены были идентифицированы путем сочетания высокопроизводительных экспериментальных и биоинформатика подходов, но еще предстоит проделать большую работу для дальнейшего выяснения биологических функций их белка и РНК продукты. Недавние результаты показывают, что большая часть огромного количества некодирующей ДНК в геноме связана с биохимической активностью, включая регуляция экспрессии генов, организация хромосомная архитектура, и сигналы, управляющие эпигенетическая наследственность.
До получения полной последовательности генома оценки количества человеческих генов варьировались от 50 000 до 140 000 (иногда неясно, включали ли эти оценки гены, не кодирующие белки).[11] По мере улучшения качества геномной последовательности и методов идентификации генов, кодирующих белок,[9] количество распознаваемых генов, кодирующих белок, упало до 19 000-20 000.[12] Однако более полное понимание роли, которую играют последовательности, которые не кодируют белки, а вместо этого экспрессируют регуляторную РНК, увеличило общее количество генов как минимум до 46 831,[13] плюс еще 2300 генов микро-РНК.[14] К 2012 году не было обнаружено функциональных элементов ДНК, не кодирующих ни РНК, ни белков.[15] и еще 10% эквивалент человеческого генома был обнаружен в недавнем (2018) опросе населения.[16] Протеин -кодирующие последовательности составляют лишь очень небольшую часть генома (примерно 1,5%), а остальная часть связана с некодирующая РНК гены регуляторные последовательности ДНК, ЛИНИИ, СИНУСЫ, интроны, и последовательности, для которых пока Не работает был определен.[17]
В июне 2016 года ученые официально объявили HGP-запись, план по синтезу генома человека.[18][19]
Полнота последовательности генома человека
Хотя о завершении проекта генома человека было объявлено в 2001 году,[17] в последовательности все еще оставались сотни пробелов, при этом отсутствовало около 5–10% последовательности, в основном в гетерохроматический регионы и вблизи центромеры и теломеры, но также и в эухроматический регионы.[20] В 2015 г. осталось 160 эухроматических пробелов, когда была определена последовательность, охватывающая еще 50 ранее не секвенированных регионов.[21] Только в 2020 году была определена первая действительно полная последовательность теломер-теломер хромосомы человека, а именно Х хромосома.[22]
Молекулярная организация и содержание генов
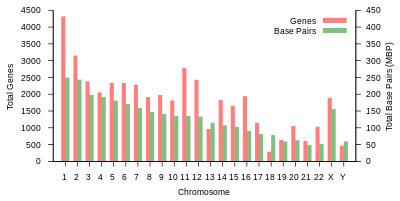
Общая длина генома человека составляет более 3 миллиардов пар оснований. Геном состоит из 22 парных хромосом, называемых аутосомы, плюс 23 пара половые хромосомы (XX) у женщин и (XY) у мужчин. Все это большие линейные молекулы ДНК, содержащиеся в ядре клетки. В геном также входят митохондриальная ДНК, сравнительно небольшая круговая молекула, присутствующая в каждом митохондрия. Основная информация об этих молекулах и составе их генов, основанная на эталонный геном которые не представляют последовательность какого-либо конкретного человека, представлены в следующей таблице. (Источник данных: Браузер Ensembl Genome, выпуск 87[постоянная мертвая ссылка ], Декабрь 2016 г. для большинства значений; Браузер Ensembl Genome, выпуск 68, Июль 2012 г. для miRNA, рРНК, snRNA, snoRNA.)
| Хромосома | Длина (мм ) | База пары | Вариации | Белок кодирование гены | Псевдо- гены | Всего длинная нкРНК | Всего маленький нкРНК | miRNA | рРНК | мяРНК | snoRNA | Разное нкРНК | Ссылки | Центромера должность (Мбит / с ) | Накопительный (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 85 | 248,956,422 | 12,151,146 | 2058 | 1220 | 1200 | 496 | 134 | 66 | 221 | 145 | 192 | EBI | 125 | 7.9 |
| 2 | 83 | 242,193,529 | 12,945,965 | 1309 | 1023 | 1037 | 375 | 115 | 40 | 161 | 117 | 176 | EBI | 93.3 | 16.2 |
| 3 | 67 | 198,295,559 | 10,638,715 | 1078 | 763 | 711 | 298 | 99 | 29 | 138 | 87 | 134 | EBI | 91 | 23 |
| 4 | 65 | 190,214,555 | 10,165,685 | 752 | 727 | 657 | 228 | 92 | 24 | 120 | 56 | 104 | EBI | 50.4 | 29.6 |
| 5 | 62 | 181,538,259 | 9,519,995 | 876 | 721 | 844 | 235 | 83 | 25 | 106 | 61 | 119 | EBI | 48.4 | 35.8 |
| 6 | 58 | 170,805,979 | 9,130,476 | 1048 | 801 | 639 | 234 | 81 | 26 | 111 | 73 | 105 | EBI | 61 | 41.6 |
| 7 | 54 | 159,345,973 | 8,613,298 | 989 | 885 | 605 | 208 | 90 | 24 | 90 | 76 | 143 | EBI | 59.9 | 47.1 |
| 8 | 50 | 145,138,636 | 8,221,520 | 677 | 613 | 735 | 214 | 80 | 28 | 86 | 52 | 82 | EBI | 45.6 | 52 |
| 9 | 48 | 138,394,717 | 6,590,811 | 786 | 661 | 491 | 190 | 69 | 19 | 66 | 51 | 96 | EBI | 49 | 56.3 |
| 10 | 46 | 133,797,422 | 7,223,944 | 733 | 568 | 579 | 204 | 64 | 32 | 87 | 56 | 89 | EBI | 40.2 | 60.9 |
| 11 | 46 | 135,086,622 | 7,535,370 | 1298 | 821 | 710 | 233 | 63 | 24 | 74 | 76 | 97 | EBI | 53.7 | 65.4 |
| 12 | 45 | 133,275,309 | 7,228,129 | 1034 | 617 | 848 | 227 | 72 | 27 | 106 | 62 | 115 | EBI | 35.8 | 70 |
| 13 | 39 | 114,364,328 | 5,082,574 | 327 | 372 | 397 | 104 | 42 | 16 | 45 | 34 | 75 | EBI | 17.9 | 73.4 |
| 14 | 36 | 107,043,718 | 4,865,950 | 830 | 523 | 533 | 239 | 92 | 10 | 65 | 97 | 79 | EBI | 17.6 | 76.4 |
| 15 | 35 | 101,991,189 | 4,515,076 | 613 | 510 | 639 | 250 | 78 | 13 | 63 | 136 | 93 | EBI | 19 | 79.3 |
| 16 | 31 | 90,338,345 | 5,101,702 | 873 | 465 | 799 | 187 | 52 | 32 | 53 | 58 | 51 | EBI | 36.6 | 82 |
| 17 | 28 | 83,257,441 | 4,614,972 | 1197 | 531 | 834 | 235 | 61 | 15 | 80 | 71 | 99 | EBI | 24 | 84.8 |
| 18 | 27 | 80,373,285 | 4,035,966 | 270 | 247 | 453 | 109 | 32 | 13 | 51 | 36 | 41 | EBI | 17.2 | 87.4 |
| 19 | 20 | 58,617,616 | 3,858,269 | 1472 | 512 | 628 | 179 | 110 | 13 | 29 | 31 | 61 | EBI | 26.5 | 89.3 |
| 20 | 21 | 64,444,167 | 3,439,621 | 544 | 249 | 384 | 131 | 57 | 15 | 46 | 37 | 68 | EBI | 27.5 | 91.4 |
| 21 | 16 | 46,709,983 | 2,049,697 | 234 | 185 | 305 | 71 | 16 | 5 | 21 | 19 | 24 | EBI | 13.2 | 92.6 |
| 22 | 17 | 50,818,468 | 2,135,311 | 488 | 324 | 357 | 78 | 31 | 5 | 23 | 23 | 62 | EBI | 14.7 | 93.8 |
| Икс | 53 | 156,040,895 | 5,753,881 | 842 | 874 | 271 | 258 | 128 | 22 | 85 | 64 | 100 | EBI | 60.6 | 99.1 |
| Y | 20 | 57,227,415 | 211,643 | 71 | 388 | 71 | 30 | 15 | 7 | 17 | 3 | 8 | EBI | 10.4 | 100 |
| мтДНК | 0.0054 | 16,569 | 929 | 13 | 0 | 0 | 24 | 0 | 2 | 0 | 0 | 0 | EBI | Нет данных | 100 |
| Всего | 3,088,286,401 | 155,630,645 | 20412 | 14600 | 14727 | 5037 | 1756 | 532 | 1944 | 1521 | 2213 |
Таблица 1 (выше) суммирует физическую организацию и генное содержание человека. эталонный геном, со ссылками на исходный анализ, опубликованный в Ансамбль база данных в Европейский институт биоинформатики (EBI) и Wellcome Trust Sanger Institute. Длину хромосом оценивали путем умножения количества пар оснований на 0,34 нанометра, расстояние между парами оснований в Двойная спираль ДНК. Недавняя оценка длины хромосом человека, основанная на обновленных данных, сообщает о 205,00 см для диплоидного мужского генома и 208,23 см для женского генома, что соответствует весу 6,41 и 6,51 пикограмма (пг) соответственно.[23] Количество белков зависит от количества исходных предшественник мРНК стенограммы, и не включает продукты альтернативный сплайсинг пре-мРНК, или модификации структуры белка, которые происходят после перевод.
Количество генов в геноме человека не совсем ясно, потому что функция многочисленных стенограммы остается неясным. Это особенно актуально для некодирующая РНК (см. ниже). Число генов, кодирующих белки, известно лучше, но все еще существует порядка 1400 сомнительных генов, которые могут или не могут кодировать функциональные белки, обычно кодируемые короткими открытые рамки для чтения. В таблице 2 приведены оценки по различным проектам и показаны эти расхождения.
| Gencode[25] | Ансамбль[26] | Refseq[27] | ШАХМАТЫ[28] | |
|---|---|---|---|---|
| гены, кодирующие белок | 19,901 | 20,376 | 20,345 | 21,306 |
| гены днРНК | 15,779 | 14,720 | 17,712 | 18,484 |
| антисмысловая РНК | 5501 | 28 | 2694 | |
| разная РНК | 2213 | 2222 | 13,899 | 4347 |
| Псевдогены | 14,723 | 1740 | 15,952 | |
| общие стенограммы | 203,835 | 203,903 | 154,484 | 328,827 |
Вариации представляют собой уникальные различия в последовательностях ДНК, которые были идентифицированы в отдельных последовательностях генома человека, проанализированных Ensembl по состоянию на декабрь 2016 года. Ожидается, что количество идентифицированных вариаций будет увеличиваться в дальнейшем личные геномы секвенируются и анализируются. Помимо содержания гена, показанного в этой таблице, в геноме человека было идентифицировано большое количество неэкспрессированных функциональных последовательностей (см. Ниже). Ссылки открывают окна со ссылочными последовательностями хромосом в браузере генома EBI.
Маленький некодирующие РНК представляют собой РНК из 200 оснований, не обладающих потенциалом кодирования белков. Они включают: микроРНК, или миРНК (посттранскрипционные регуляторы экспрессии генов), малые ядерные РНК, или мяРНК (компоненты РНК сплайсосомы ), и малые ядрышковые РНК, или мяРНК (участвует в химических модификациях других молекул РНК). Длинные некодирующие РНК представляют собой молекулы РНК длиной более 200 оснований, не обладающие потенциалом кодирования белков. Они включают: рибосомные РНК, или рРНК (компоненты РНК рибосомы ) и множество других длинных РНК, которые участвуют в регуляция экспрессии генов, эпигенетический модификации нуклеотидов ДНК и гистон белки и регуляция активности генов, кодирующих белок. Небольшие несоответствия между числами total-small-ncRNA и числами конкретных типов малых ncNRAs возникают из-за того, что первые значения получены из Ensembl выпуска 87, а последние из Ensembl выпуска 68.
Информационное содержание
В гаплоидный геном человека (23 хромосомы ) имеет длину около 3 миллиардов пар оснований и содержит около 30 000 генов.[29] Поскольку каждую базовую пару можно закодировать двумя битами, это примерно 750 мегабайты данных. Индивидуальный соматический (диплоид ) ячейка содержит вдвое больше, то есть около 6 миллиардов пар оснований. У мужчин их меньше, чем у женщин, потому что Y-хромосома составляет около 57 миллионов пар оснований, тогда как X составляет около 156 миллионов. Поскольку отдельные геномы различаются по последовательности менее чем на 1% друг от друга, вариации генома данного человека от общей ссылки могут быть сжатие без потерь примерно до 4 мегабайт.[30]
В скорость энтропии генома существенно различается между кодирующими и некодирующими последовательностями. Это близко к максимуму 2 бита на пару оснований для кодирующих последовательностей (около 45 миллионов пар оснований), но меньше для некодирующих частей. Он варьируется от 1,5 до 1,9 бит на пару оснований для отдельной хромосомы, за исключением Y-хромосомы, у которой коэффициент энтропии ниже 0,9 бит на пару оснований.[31]
Кодирующая и некодирующая ДНК
Содержание генома человека обычно делится на кодирующие и некодирующие последовательности ДНК. Кодирующая ДНК определяется как те последовательности, которые можно транскрибировать в мРНК и переведено в белки в течение жизненного цикла человека; эти последовательности занимают лишь небольшую часть генома (<2%). Некодирующая ДНК состоит из всех тех последовательностей (около 98% генома), которые не используются для кодирования белков.
Некодирующая ДНК содержит гены молекул РНК с важными биологическими функциями (некодирующая РНК, Например рибосомная РНК и переносить РНК ). Изучение функции и эволюционного происхождения некодирующей ДНК является важной целью современных исследований генома, в том числе КОДИРОВАТЬ (Энциклопедия элементов ДНК), целью которого является исследование всего генома человека с использованием различных экспериментальных инструментов, результаты которых указывают на молекулярную активность.
Поскольку некодирующая ДНК значительно превосходит кодирующую ДНК, концепция секвенированного генома стала более сфокусированной аналитической концепцией, чем классическая концепция ДНК-кодирующего гена.[32][33]
Кодирующие последовательности (гены, кодирующие белок)

Последовательности, кодирующие белок, представляют собой наиболее широко изученный и наиболее изученный компонент генома человека. Эти последовательности в конечном итоге приводят к производству всех человеческих белки, хотя несколько биологических процессов (например, Перестройки ДНК и альтернативный сплайсинг пре-мРНК ) может привести к производству гораздо большего количества уникальных белков, чем количество генов, кодирующих белок. Полная модульная способность генома к кодированию белков содержится в экзом, и состоит из последовательностей ДНК, кодируемых экзоны которые можно перевести в белки. Из-за его биологической важности и того факта, что он составляет менее 2% генома, секвенирование экзома стало первой важной вехой проекта «Геном человека».
Количество генов, кодирующих белок. Около 20000 человеческих белков аннотированы в таких базах данных, как Uniprot.[35] Исторически оценки количества белковых генов широко варьировались, достигая 2000000 в конце 1960-х годов.[36] но несколько исследователей отметили в начале 1970-х годов, что оценочная мутационная нагрузка от вредных мутаций был установлен верхний предел примерно 40 000 для общего числа функциональных локусов (включая гены, кодирующие белок, и гены, не кодирующие функциональные группы).[37] Количество генов, кодирующих белок человека, ненамного больше, чем у многих менее сложных организмов, таких как аскарида и плодовая муха. Это различие может быть результатом широкого использования альтернативный сплайсинг пре-мРНК у человека, что обеспечивает способность создавать очень большое количество модульных белков за счет избирательного включения экзонов.
Способность кодирования белков на хромосому. Гены, кодирующие белки, распределены по хромосомам неравномерно, от нескольких десятков до более 2000, с особенно высоким плотность генов в хромосомах 19, 11 и 1 (таблица 1). Каждая хромосома содержит различные богатые генами и бедные генами области, которые могут коррелировать с полосы хромосом и GC-контент.[38] Значение этих неслучайных паттернов плотности генов до конца не изучено.[39]
Размер генов, кодирующих белок. Размер генов, кодирующих белок, в геноме человека очень разнообразен (таблица 2). Средний размер гена, кодирующего белок, составляет 26 288 п.н. (среднее значение = 66 577 п.н .; Таблица 2 в[40]). Например, ген гистон H1a (HIST1HIA) относительно небольшой и простой, лишенный интронов и кодирующий последовательности мРНК из 781 нуклеотидов и белка из 215 аминокислот (648 нуклеотидов). открытая рамка чтения ). Дистрофин (DMD) - самый крупный белок-кодирующий ген в эталонном геноме человека, охватывающий в общей сложности 2,2 МБ, в то время как Титин (TTN) имеет самую длинную кодирующую последовательность (114 414 п.н.), наибольшее количество экзоны (363),[41] и самый длинный одиночный экзон (17 106 п.н.). Во всем геноме средний размер экзона составляет 122 п.н. (среднее = 145 п.н.), среднее количество экзонов составляет 7 (среднее = 8,8), а средняя кодирующая последовательность кодирует 367 аминокислот (среднее = 447 аминокислот; Таблица 21 в[17]).
| Протеин | Хром | Ген | Длина | Экзоны | Длина экзона | Длина интрона | Альтернативная сварка |
|---|---|---|---|---|---|---|---|
| Белок восприимчивости к раку груди 2 типа | 13 | BRCA2 | 83,736 | 27 | 11,386 | 72,350 | да |
| Регулятор трансмембранной проводимости при муковисцидозе | 7 | CFTR | 202,881 | 27 | 4,440 | 198,441 | да |
| Цитохром b | MT | MTCYB | 1,140 | 1 | 1,140 | 0 | нет |
| Дистрофин | Икс | DMD | 2,220,381 | 79 | 10,500 | 2,209,881 | да |
| Глицеральдегид-3-фосфатдегидрогеназа | 12 | GAPDH | 4,444 | 9 | 1,425 | 3,019 | да |
| Бета-субъединица гемоглобина | 11 | HBB | 1,605 | 3 | 626 | 979 | нет |
| Гистон H1A | 6 | HIST1H1A | 781 | 1 | 781 | 0 | нет |
| Титин | 2 | TTN | 281,434 | 364 | 104,301 | 177,133 | да |
Таблица 2. Примеры генов, кодирующих человеческий белок. Хром, хромосома. Альтернативный сплайсинг, альтернативный сплайсинг пре-мРНК. (Источник данных: Браузер генома ансамбля выпуск 68, июль 2012 г.)
Недавно был проведен систематический метаанализ обновленных данных генома человека.[40] обнаружили, что самый большой ген, кодирующий белок в эталонном геноме человека, является RBFOX1 (РНК-связывающий белок, гомолог 1 fox-1), всего 2,47 МБ. Во всем геноме, учитывая тщательно подобранный набор кодирующих белок генов, средний размер экзона в настоящее время оценивается в 133 п.н. (среднее значение = 309 п.н.), среднее количество экзонов в настоящее время оценивается в 8 (среднее значение = 11 ), а средняя кодирующая последовательность в настоящее время оценивается как кодирующая 425 аминокислот (среднее значение = 553 аминокислоты; таблицы 2 и 5 в[40]).
Некодирующая ДНК (нкДНК)
Некодирующая ДНК определяется как все последовательности ДНК в геноме, которые не обнаруживаются в экзонах, кодирующих белок, и поэтому никогда не представлены в аминокислотной последовательности экспрессируемых белков. Согласно этому определению, более 98% геномов человека состоит из нкДНК.
Были идентифицированы многочисленные классы некодирующей ДНК, включая гены некодирующей РНК (например, тРНК и рРНК), псевдогены, интроны, нетранслируемые области мРНК, регуляторные последовательности ДНК, повторяющиеся последовательности ДНК и последовательности, относящиеся к мобильным генетическим элементам.
Многочисленные последовательности, включенные в гены, также определяются как некодирующие ДНК. К ним относятся гены для некодирующей РНК (например, тРНК, рРНК) и нетранслируемые компоненты генов, кодирующих белок (например, интроны и 5 'и 3' нетранслируемые области мРНК).
Последовательности, кодирующие белок (в частности, кодирующие экзоны ) составляют менее 1,5% генома человека.[17] Кроме того, около 26% генома человека интроны.[42] Помимо генов (экзонов и интронов) и известных регуляторных последовательностей (8–20%), геном человека содержит участки некодирующей ДНК. Точное количество некодирующей ДНК, которая играет роль в физиологии клетки, является предметом горячих споров. Недавний анализ КОДИРОВАТЬ Проект показывает, что 80% всего генома человека либо транскрибируется, либо связывается с регуляторными белками, либо связано с какой-либо другой биохимической активностью.[15]
Однако остается спорным, вносит ли вся эта биохимическая активность вклад в физиологию клетки или значительная ее часть является результатом транскрипционного и биохимического шума, который должен активно отфильтровываться организмом.[43] За исключением кодирующих белки последовательностей, интронов и регуляторных областей, большая часть некодирующей ДНК состоит из: многих последовательностей ДНК, которые не играют роли в экспрессия гена имеют важные биологические функции. Сравнительная геномика исследования показывают, что около 5% генома содержит последовательности некодирующей ДНК, которые консервированный, иногда во временных масштабах, представляющих сотни миллионов лет, подразумевая, что эти некодирующие области находятся под сильным эволюционный давление и положительный выбор.[44]
Многие из этих последовательностей регулируют структуру хромосом, ограничивая области гетерохроматин формирование и регулирование структурных особенностей хромосом, таких как теломеры и центромеры. Другие некодирующие области служат истоки репликации ДНК. Наконец, несколько областей транскрибируются в функциональную некодирующую РНК, которая регулирует экспрессию генов, кодирующих белок (например,[45] ), трансляции и стабильности мРНК (см. miRNA ), структура хроматина (включая гистон модификации, например[46] ), Метилирование ДНК (например,[47] ), Рекомбинация ДНК (например,[48] ) и перекрестно регулируют другие некодирующие РНК (например,[49] ). Также вероятно, что многие транскрибируемые некодирующие области не играют никакой роли и что эта транскрипция является продуктом неспецифической РНК-полимераза Мероприятия.[43]
Псевдогены
Псевдогены - это неактивные копии генов, кодирующих белок, часто генерируемые дупликация гена, которые стали нефункциональными из-за накопления инактивирующих мутаций. Таблица 1 показывает, что количество псевдогенов в геноме человека составляет порядка 13000,[50] а в некоторых хромосомах почти столько же, сколько функциональных генов, кодирующих белок. Дублирование генов - основной механизм, с помощью которого создается новый генетический материал во время молекулярная эволюция.
Например, обонятельный рецептор Семейство генов - один из наиболее хорошо задокументированных примеров псевдогенов в геноме человека. Более 60 процентов генов этого семейства являются нефункциональными псевдогенами у людей. Для сравнения, только 20 процентов генов в семействе генов обонятельных рецепторов мышей являются псевдогенами. Исследования показывают, что это видоспецифическая характеристика, поскольку все наиболее близкие приматы имеют пропорционально меньше псевдогенов. Это генетическое открытие помогает объяснить менее острое обоняние у людей по сравнению с другими млекопитающими.[51]
Гены некодирующей РНК (нкРНК)
Молекулы некодирующей РНК играют в клетках множество важных ролей, особенно во многих реакциях синтез белка и Обработка РНК. Некодирующие РНК включают тРНК, рибосомальный РНК, микроРНК, мяРНК и другие гены некодирующих РНК, включая около 60 000 длинные некодирующие РНК (днРНК).[15][52][53][54] Хотя количество зарегистрированных генов днРНК продолжает расти, а точное количество в геноме человека еще предстоит определить, многие из них считаются нефункциональными.[55]
Многие нкРНК являются критическими элементами в регуляции и экспрессии генов. Некодирующая РНК также участвует в эпигенетике, транскрипции, сплайсинге РНК и трансляционном аппарате. Роль РНК в генетической регуляции и заболеваниях предлагает новый потенциальный уровень неизученной сложности генома.[56]
Интроны и нетранслируемые участки мРНК
В дополнение к молекулам нкРНК, которые кодируются дискретными генами, начальные транскрипты генов, кодирующих белок, обычно содержат обширные некодирующие последовательности в виде интроны, 5'-непереведенные области (5'-UTR), и 3'-непереведенные области (3'-UTR). В большинстве кодирующих белок генов человеческого генома длина последовательностей интронов в 10-100 раз превышает длину последовательностей экзонов (таблица 2).
Регуляторные последовательности ДНК
В геноме человека много разных регуляторные последовательности которые имеют решающее значение для контроля экспрессия гена. Консервативные оценки показывают, что эти последовательности составляют 8% генома,[57] однако экстраполяции из КОДИРОВАТЬ проект дает это 20[58]-40%[59] генома является регуляторной последовательностью гена. Некоторые типы некодирующей ДНК являются генетическими «переключателями», которые не кодируют белки, но регулируют, когда и где экспрессируются гены (называемые усилители ).[60]
Регуляторные последовательности известны с конца 1960-х годов.[61] Первая идентификация регуляторных последовательностей в геноме человека была основана на технологии рекомбинантной ДНК.[62] Позже, с появлением геномного секвенирования, идентификация этих последовательностей могла быть выведена путем эволюционной консервации. Эволюционная ветвь между приматы и мышь, например, произошло 70–90 миллионов лет назад.[63] Итак, компьютерные сравнения последовательностей генов, которые определяют консервативные некодирующие последовательности будет показателем их важности в таких обязанностях, как регулирование генов.[64]
Другие геномы были секвенированы с тем же намерением, чтобы помочь методам, ориентированным на сохранение, например, рыба фугу геном.[65] Однако регуляторные последовательности исчезают и снова эволюционируют в процессе эволюции с высокой скоростью.[66][67][68]
С 2012 года усилия переместились в сторону поиска взаимодействий между ДНК и регуляторными белками с помощью техники ChIP-Seq, или пробелы, где ДНК не упакована гистоны (Сайты гиперчувствительности к ДНКазе ), оба из которых говорят о наличии активных регуляторных последовательностей в исследуемом типе клеток.[57]
Повторяющиеся последовательности ДНК
Повторяющиеся последовательности ДНК составляют примерно 50% генома человека.[69]
Около 8% генома человека состоит из тандемных массивов ДНК или тандемных повторов, повторяющихся последовательностей низкой сложности, которые имеют несколько смежных копий (например, «CAGCAGCAG ...»).[70] Тандемные последовательности могут иметь разную длину от двух нуклеотидов до десятков нуклеотидов. Эти последовательности сильно различаются даже среди близкородственных людей, и поэтому используются для генеалогическое тестирование ДНК и судебно-медицинский анализ ДНК.[71]
Повторяющиеся последовательности менее десяти нуклеотидов (например, динуклеотидный повтор (AC)п) называются микросателлитными последовательностями. Среди микросателлитных последовательностей особое значение имеют тринуклеотидные повторы, которые иногда встречаются внутри кодирующие области генов белков и может привести к генетическим нарушениям. Например, болезнь Хантингтона возникает в результате увеличения тринуклеотидного повтора (CAG).п в пределах Хантингтин ген на хромосоме 4 человека. Теломеры (концы линейных хромосом) оканчиваются микросателлитным гексануклеотидным повтором последовательности (TTAGGG)п.
Тандемные повторы более длинных последовательностей (массивы повторяющихся последовательностей длиной от 10 до 60 нуклеотидов) называются мини-спутники.
Мобильные генетические элементы (транспозоны) и их реликвии
Переносные генетические элементы Последовательности ДНК, которые могут реплицироваться и вставлять свои копии в другие места в геноме хозяина, являются обильным компонентом генома человека. Самая многочисленная линия транспозонов, Алу, имеет около 50 000 активных копий,[72] и могут быть вставлены во внутригенные и межгенные области.[73] Еще одна линия, LINE-1, имеет около 100 активных копий на геном (количество варьируется у разных людей).[74] Вместе с нефункциональными остатками старых транспозонов они составляют более половины всей ДНК человека.[75] Транспозоны, иногда называемые «прыгающими генами», сыграли важную роль в формировании генома человека. Некоторые из этих последовательностей представляют эндогенные ретровирусы, Копии ДНК вирусных последовательностей, которые навсегда интегрировались в геном и теперь передаются следующим поколениям.
Мобильные элементы в геноме человека можно разделить на LTR ретротранспозоны (8,3% от общего генома), СИНУСЫ (13,1% от общего генома) в том числе Элементы Alu, ЛИНИИ (20,4% от общего генома), SVA и Транспозоны ДНК класса II (2,9% от общего генома).
Геномная изменчивость у людей
Контрольный геном человека
За исключением однояйцевых близнецов, у всех людей наблюдаются значительные вариации в последовательностях геномной ДНК. Человек эталонный геном (HRG) используется как стандартная ссылка на последовательность.
Есть несколько важных моментов, касающихся эталонного генома человека:
- HRG представляет собой гаплоидную последовательность. Каждая хромосома представлена один раз.
- HRG представляет собой сложную последовательность и не соответствует никакому реальному человеку.
- HRG периодически обновляется для исправления ошибок, двусмысленностей и неизвестных «пробелов».
- HRG никоим образом не представляет «идеального» или «совершенного» человека. Это просто стандартизованное представление или модель, которая используется для сравнительных целей.
В Консорциум ссылок на геном отвечает за обновление HRG.Версия 38 была выпущена в декабре 2013 года.[76]
Измерение генетической изменчивости человека
Большинство исследований генетических вариаций человека были сосредоточены на однонуклеотидные полиморфизмы (SNP), которые представляют собой замены в отдельных основаниях вдоль хромосомы. По оценкам большинства анализов, SNP встречаются в среднем 1 из 1000 пар оснований в эухроматический геном человека, хотя они не имеют однородной плотности. Отсюда следует популярное утверждение, что «мы все, независимо от гонка, генетически на 99,9% то же самое »,[77] хотя большинство генетиков определенно это признают. Например, сейчас считается, что гораздо большая часть генома участвует в изменение количества копий.[78] Крупномасштабные совместные усилия по каталогизации вариаций SNP в геноме человека предпринимаются Международный проект HapMap.
Геномные локусы и длина некоторых типов мелких повторяющиеся последовательности сильно различаются от человека к человеку, что является основой Дактилоскопия ДНК и ДНК-тестирование на отцовство технологии. В гетерохроматический части человеческого генома, которые составляют несколько сотен миллионов пар оснований, также считаются весьма изменчивыми в пределах человеческой популяции (они настолько повторяющиеся и такие длинные, что их невозможно точно секвенировать с помощью современных технологий). Эти области содержат мало генов, и неясно, есть ли какие-либо значимые фенотипический Эффект является результатом типичного изменения повторов или гетерохроматина.
Наиболее грубые геномные мутации в гамета половые клетки, вероятно, приводят к появлению нежизнеспособных эмбрионов; однако ряд заболеваний человека связан с крупномасштабными геномными аномалиями. Синдром Дауна, Синдром Тернера, и ряд других заболеваний возникает в результате нерасхождение целых хромосом. Рак клетки часто имеют анеуплоидия хромосом и хромосомных плеч, хотя причина и следствие Связь между анеуплоидией и раком не установлена.
Картирование геномных вариаций человека
В то время как последовательность генома перечисляет порядок каждой основы ДНК в геноме, карта генома определяет ориентиры. Карта генома менее подробна, чем последовательность генома, и помогает ориентироваться в геноме.[79][80]
Примером карты вариантов является HapMap, разрабатываемый Международный проект HapMap. HapMap - это гаплотип карта генома человека, «которая будет описывать общие закономерности изменения последовательности ДНК человека».[81] Он каталогизирует образцы небольших вариаций в геноме, которые включают отдельные буквы или основания ДНК.
Исследователи опубликовали в журнале первую основанную на последовательностях карту крупномасштабных структурных вариаций генома человека. Природа в мае 2008 г.[82][83] Крупномасштабные структурные вариации - это различия в геномах людей, которые варьируются от нескольких тысяч до нескольких миллионов оснований ДНК; некоторые из них представляют собой прирост или потерю участков последовательности генома, а другие проявляются как изменение расположения участков последовательности. Эти варианты включают различия в количестве копий люди имеют определенный ген, делеции, транслокации и инверсии.
Частота SNP в геноме человека
Однонуклеотидные полиморфизмы (SNP) не возникают однородно в геноме человека. На самом деле существует огромное разнообразие в SNP частота между генами, отражающая различное избирательное давление на каждый ген, а также различную скорость мутаций и рекомбинации в геноме. Однако исследования SNP смещены в сторону кодирующих областей, данные, полученные из них, вряд ли отражают общее распределение SNP по геному. Следовательно Консорциум SNP Протокол был разработан для идентификации SNP без предвзятости в отношении кодирующих регионов, а 100 000 SNP Консорциума в целом отражают разнообразие последовательностей в хромосомах человека. В Консорциум SNP стремится увеличить количество SNP, идентифицированных в геноме, до 300 000 к концу первого квартала 2001 года.[84]

Изменения в некодирующая последовательность и синонимичные изменения в кодирующая последовательность обычно более распространены, чем несинонимичные изменения, что отражает большее селективное давление, снижающее разнообразие в положениях, определяющих идентичность аминокислот. Переходные изменения встречаются чаще, чем трансверсии, при этом динуклеотиды CpG показывают самую высокую скорость мутаций, предположительно из-за дезаминирования.
Персональные геномы
Последовательность личного генома (почти) полная последовательность пар химических оснований, составляющих ДНК одного человека. Потому что медицинские процедуры по-разному влияют на разных людей из-за генетических различий, таких как однонуклеотидные полиморфизмы (SNP), анализ личных геномов может привести к персонализированному лечению на основе индивидуальных генотипов.[85]
Первой личной последовательностью генома, которую необходимо было определить, была последовательность Крейг Вентер в 2007 году. Персональные геномы не были секвенированы в рамках общественного проекта «Геном человека» для защиты личности добровольцев, предоставивших образцы ДНК. Эта последовательность была получена из ДНК нескольких добровольцев из разных популяций.[86] Тем не менее, в начале возглавляемой Вентером Celera Genomics Усилия по секвенированию генома было принято решение перейти от секвенирования составного образца к использованию ДНК одного человека, который, как позже выяснилось, был сам Вентер. Таким образом, последовательность генома человека Celera, выпущенная в 2000 году, в основном принадлежала одному человеку. Последующая замена ранних составных данных и определение диплоидной последовательности, представляющей оба набора хромосомы, а не гаплоидная последовательность, о которой первоначально сообщалось, позволила высвободить первый личный геном.[87] В апреле 2008 г. Джеймс Уотсон также был завершен. В 2009 году Стивен Квейк опубликовал свою собственную последовательность генома, полученную с помощью разработанного им секвенатора Heliscope.[88] Команда Стэнфорда во главе с Юан Эшли опубликовал основу для медицинской интерпретации геномов человека, реализованную на геноме Quake, и впервые принял медицинские решения с учетом всего генома.[89] Эта команда расширила этот подход на семью Веста, первую семью, секвенированную в рамках программы индивидуального секвенирования генома Illumina.[90] С тех пор были выпущены сотни персональных последовательностей генома,[91] в том числе Десмонд Туту,[92][93] и из Палеоэскимосский.[94] В 2012 году были обнародованы полные последовательности геномов двух семейных троек среди 1092 геномов.[3] В ноябре 2013 года испанская семья сделала четыре личных набора данных экзома (около 1% генома) общедоступными в рамках Лицензия Creative Commons в области общественного достояния.[95][96] В Персональный проект генома (запущен в 2005 г.) является одним из немногих, сделавших общедоступными как последовательности генома, так и соответствующие медицинские фенотипы.[97][98]
Секвенирование отдельных геномов еще больше выявило уровни генетической сложности, которые ранее не оценивались. Личная геномика помогла выявить значительный уровень разнообразия в геноме человека, связанный не только с SNP, но и с структурными вариациями. Однако применение этих знаний в лечении болезней и в медицине находится только в самом начале.[99] Секвенирование экзома становится все более популярным как инструмент, помогающий в диагностике генетических заболеваний, поскольку экзом составляет только 1% геномной последовательности, но на него приходится примерно 85% мутаций, которые вносят значительный вклад в заболевание.[100]
Человеческие нокауты
В людях, нокауты генов естественно происходит как гетерозиготный или гомозиготный Потеря функции нокауты генов. Эти нокауты часто трудно отличить, особенно внутри неоднородный генетический фон. Их также трудно найти, поскольку они встречаются на низких частотах.

Популяции с высокими показателями кровное родство в странах с высоким уровнем браков двоюродных братьев и сестер наблюдается самая высокая частота нокаутов гомозиготных генов. К таким группам населения относятся Пакистан, Исландия и амиши. Эти популяции с высоким уровнем родительского родства были предметом нокаутированных исследований на людях, которые помогли определить функцию определенных генов у людей. Выявляя определенные нокауты, исследователи могут использовать фенотипический анализ этих людей, чтобы охарактеризовать нокаутный ген.

Нокауты в определенных генах могут вызывать генетические заболевания, потенциально иметь положительные эффекты или даже не приводить к фенотипическому эффекту. Однако определение фенотипического эффекта нокаута и у людей может быть сложной задачей. Проблемы, связанные с характеристикой и клинической интерпретацией нокаутов, включают трудность вызова вариантов ДНК, определение нарушения функции белка (аннотации) и учет степени влияния мозаика имеет по фенотипу.[101]
Одним из крупных исследований, посвященных нокауту людей, является исследование риска инфаркта миокарда в Пакистане. Было обнаружено, что люди, обладающие гетерозиготным нокаутом гена потери функции для APOC3 У гена были более низкие триглицериды в крови после употребления пищи с высоким содержанием жиров по сравнению с людьми без мутации. Однако люди, обладающие гомозиготными нокаутами гена потери функции гена APOC3, показали самый низкий уровень триглицеридов в крови после теста с жировой нагрузкой, поскольку они не производят функционального белка APOC3.[102]
Генетические нарушения человека
Большинство аспектов биологии человека включают как генетические (наследственные), так и негенетические (экологические) факторы. Некоторые унаследованные изменения влияют на аспекты нашей биологии, которые не носят медицинского характера (рост, цвет глаз, способность ощущать вкус или запах определенных соединений и т. Д.). Более того, некоторые генетические нарушения вызывают заболевание только в сочетании с соответствующими факторами окружающей среды (такими как диета). С этими оговорками генетические нарушения могут быть описаны как клинически определенные заболевания, вызванные вариацией последовательности геномной ДНК. В самых простых случаях заболевание может быть связано с вариацией одного гена. Например, кистозный фиброз вызывается мутациями в гене CFTR и является наиболее распространенным рецессивным заболеванием в кавказских популяциях, где известно более 1300 различных мутаций.[103]
Мутации, вызывающие заболевание, в определенных генах обычно тяжелы с точки зрения функции генов и, к счастью, редки, поэтому генетические нарушения также редки индивидуально. Однако, поскольку существует множество генов, которые могут вызывать генетические нарушения, в совокупности они составляют значительный компонент известных заболеваний, особенно в педиатрической медицине. Молекулярно охарактеризованные генетические нарушения - это те, для которых был идентифицирован основной причинный ген. В настоящее время в справочнике аннотировано около 2200 таких расстройств. OMIM база данных.[103]
Исследования генетических нарушений часто проводятся с помощью семейных исследований. В некоторых случаях используются популяционные подходы, особенно в случае так называемых популяций-основателей, например, в Финляндии, Канаде, Франции, Юте, Сардинии и т. Д. Диагностика и лечение генетических заболеваний обычно выполняются специалистами. генетик -врач, прошедший подготовку в области клинической / медицинской генетики. Результаты Проект генома человека вероятно обеспечат повышенную доступность генетическое тестирование для генных заболеваний и, в конечном итоге, улучшенное лечение. Родители могут быть проверены на наследственные заболевания и советовал о последствиях, вероятности наследования и о том, как избежать или улучшить его у их потомков.
Существует много различных видов вариаций последовательностей ДНК, от полных лишних или отсутствующих хромосом до единичных нуклеотидных изменений. Обычно предполагается, что большая часть естественных генетических вариаций в человеческих популяциях фенотипически нейтральна, то есть оказывает незначительное влияние на физиологию индивида или не оказывает никакого заметного влияния на него (хотя могут быть частичные различия в приспособленности, определяемые в течение эволюционных временных рамок). Генетические нарушения могут быть вызваны любым или всеми известными типами вариации последовательности. Чтобы молекулярно охарактеризовать новое генетическое заболевание, необходимо установить причинную связь между конкретным вариантом геномной последовательности и исследуемым клиническим заболеванием. Такие исследования составляют область молекулярной генетики человека.
С появлением генома человека и Международный проект HapMap стало возможным исследовать тонкие генетические влияния на многие распространенные болезненные состояния, такие как диабет, астма, мигрень, шизофрения и т. д. публичность в средствах массовой информации, обычно это не считается генетическим заболеванием как таковой поскольку их причины сложны и включают множество различных генетических факторов и факторов окружающей среды. Таким образом, в отдельных случаях могут возникать разногласия относительно того, следует ли определять конкретное заболевание как генетическое заболевание.
Упомянутые дополнительные генетические нарушения: Синдром Каллмана и Синдром Пфайффера (ген FGFR1), Дистрофия роговицы Фукса (ген TCF4), Болезнь Гиршпрунга (гены RET и FECH), синдром Барде-Бидля 1 (гены CCDC28B и BBS1), синдром Барде-Бидля 10 (ген BBS10) и фациоскапуло-плечевая мышечная дистрофия 2 типа (гены D4Z4 и SMCHD1).[104]
Секвенирование генома теперь может сузить геном до определенных участков, чтобы более точно находить мутации, которые приведут к генетическому заболеванию. Копировать варианты номеров (CNV) и однонуклеотидные варианты (SNV) также могут быть обнаружены одновременно с секвенированием генома с помощью более новых доступных процедур секвенирования, называемых Секвенирование следующего поколения (NGS). Это анализирует только небольшую часть генома, около 1-2%. Результаты этого секвенирования могут быть использованы для клинической диагностики генетического состояния, в том числе Синдром Ашера, заболевания сетчатки, нарушения слуха, диабет, эпилепсия, Болезнь Ли, наследственные онкологические заболевания, нервно-мышечные заболевания, первичные иммунодефициты, тяжелый комбинированный иммунодефицит (ТКИД) и заболевания митохондрий.[105] NGS также можно использовать для выявления носителей заболеваний до зачатия. Заболевания, которые можно обнаружить в этом секвенировании, включают: Болезнь Тея-Сакса, Синдром Блума, Болезнь Гоше, Болезнь Канавана, семейная дисавтономия, кистозный фиброз, спинальная мышечная атрофия, и синдром ломкой Х-хромосомы. Секвенирование следующего генома может быть сужено, чтобы специально искать заболевания, более распространенные в определенных этнических группах.[106]
В приведенной ниже таблице с разбивкой по категориям представлена распространенность, а также гены или хромосомы, связанные с некоторыми генетическими заболеваниями человека.
| Беспорядок | Распространенность | Вовлеченная хромосома или ген |
|---|---|---|
| Хромосомные состояния | ||
| Синдром Дауна | 1:600 | Хромосома 21 |
| Синдром Клайнфельтера | 1: 500–1000 мужчин | Дополнительная Х-хромосома |
| Синдром Тернера | 1: 2000 сук | Потеря Х-хромосомы |
| Серповидноклеточная анемия | 1 из 50 рождений в некоторых частях Африки; реже в других местах | β-глобин (на хромосоме 11) |
| Синдром Блума | 1: 48000 евреев ашкенази | BLM |
| Рак | ||
| Грудь /Рак яичников (восприимчивость) | ~ 5% случаев этих видов рака | BRCA1, BRCA2 |
| ФАП (наследственная неполипозная кишечная палочка) | 1:3500 | APC |
| Синдром Линча | 5–10% всех случаев рака кишечника | MLH1, MSH2, MSH6, PMS2 |
| Анемия Фанкони | 1: 130000 рождений | FANCC |
| Неврологические состояния | ||
| Болезнь Хантингтона | 1:20000 | Хантингтин |
| болезнь Альцгеймера - раннее начало | 1:2500 | PS1, PS2, ПРИЛОЖЕНИЕ |
| Tay-Sachs | 1: 3600 рождений у евреев ашкенази | Ген HEXA (на хромосоме 15) |
| Болезнь Канавана | 2,5% восточноевропейского еврейского происхождения | СПА ген (на 17 хромосоме) |
| Семейная дизавтономия | 600 известных случаев по всему миру с момента открытия | Ген IKBKAP (на хромосоме 9) |
| Синдром ломкой Х-хромосомы | 1,4: 10000 у мужчин, 0,9: 10000 у женщин | Ген FMR1 (на Х-хромосоме) |
| Муколипидоз IV типа | От 1:90 до 1: 100 у евреев ашкенази | MCOLN1 |
| Прочие условия | ||
| Кистозный фиброз | 1:2500 | CFTR |
| Мышечная дистрофия Дюшенна | 1: 3500 мальчиков | Дистрофин |
| Мышечная дистрофия Беккера | 1,5-6: 100000 самцов | DMD |
| Бета-талассемия | 1:100000 | HBB |
| Врожденная гиперплазия надпочечников | 1: 280 у коренных американцев и эскимосов-юпиков 1: 15000 у американских кавказцев | CYP21A2 |
| Болезнь накопления гликогена типа I | 1: 100000 рождений в Америке | G6PC |
| Заболевание мочи кленовым сиропом | 1: 180000 в США. 1: 176 в общинах меннонитов / амишей 1: 250000 в Австрии | BCKDHA BCKDHB DBT DLD |
| Болезнь Ниманна – Пика, ассоциированная с SMPD1 | 1200 случаев по всему миру | SMPD1 |
| Синдром Ашера | 1: 23000 в США. 1: 28000 в Норвегии 1: 12500 в Германии | CDH23 MYO7A PCDH15 USH1C USH1G USH2A GPR98 DFNB31 CLRN1 |
Эволюция
Сравнительная геномика исследования геномов млекопитающих предполагают, что примерно 5% генома человека было сохранено эволюцией с момента расхождения существующих линий примерно 200 миллионов лет назад, содержащих подавляющее большинство генов.[107][108] Опубликованный шимпанзе Геном отличается от генома человека на 1,23% при прямом сравнении последовательностей.[109] Около 20% этой цифры объясняется вариациями внутри каждого вида, оставляя лишь ~ 1,06% последовательного расхождения последовательностей между людьми и шимпанзе в общих генах.[110] Этот нуклеотид по нуклеотидной разнице меньше, чем часть каждого генома, которая не является общей, включая около 6% функциональных генов, уникальных для человека или шимпанзе.[111]
Другими словами, значительные наблюдаемые различия между людьми и шимпанзе могут быть связаны в большей или большей степени с вариациями на уровне генома в количестве, функции и экспрессии генов, а не с изменениями последовательности ДНК в общих генах. Действительно, даже у людей было обнаружено ранее недооцененное количество вариаций числа копий (CNV), которое может составлять до 5-15% генома человека. Другими словами, между людьми может быть +/- 500000000 пар оснований ДНК, некоторые из которых являются активными генами, другие инактивированы или активны на разных уровнях. Полное значение этого открытия еще предстоит увидеть. В среднем, типичный ген, кодирующий белок человека, отличается от его гена шимпанзе. ортолог только двумя аминокислота замены; почти треть генов человека имеют точно такую же трансляцию белка, как их ортологи шимпанзе. Основное различие между двумя геномами - это человеческий хромосома 2, что эквивалентно продукту слияния хромосом 12 и 13 шимпанзе.[112] (позже переименованы в хромосомы 2А и 2В соответственно).
Люди понесли огромную потерю обонятельный рецептор гены во время нашей недавней эволюции, что объясняет наше относительно грубое представление о запах по сравнению с большинством других млекопитающих. Эволюционные данные свидетельствуют о том, что появление цветовое зрение у людей и некоторых других примат вид уменьшил потребность в обонянии.[113]
В сентябре 2016 года ученые сообщили, что на основании генетических исследований ДНК человека все неафриканцы в современном мире можно проследить до единое население это покинул Африку между 50 000 и 80 000 лет назад.[114]
Митохондриальная ДНК
Человек митохондриальная ДНК представляет огромный интерес для генетиков, так как он, несомненно, играет роль в митохондриальная болезнь. Это также проливает свет на эволюцию человека; например, анализ вариаций митохондриального генома человека привел к постулированию недавнего общего предка для всех людей по материнской линии происхождения (см. Митохондриальная Ева ).
Из-за отсутствия системы проверки ошибок копирования,[нужна цитата ] митохондриальная ДНК (мтДНК) имеет более высокую скорость изменения, чем ядерная ДНК. Это 20-кратное[требуется проверка ] более высокая частота мутаций позволяет использовать мтДНК для более точного отслеживания материнского происхождения.[нужна цитата ] Исследования мтДНК в популяциях позволили проследить древние пути миграции, такие как миграция Коренные американцы от Сибирь[нужна цитата ] или Полинезийцы с юго-востока Азия[нужна цитата ]. Он также использовался, чтобы показать, что нет никаких следов Неандерталец ДНК в европейской смеси генов унаследована исключительно по материнской линии.[115] Из-за ограничительного полного или нулевого способа наследования мтДНК этот результат (отсутствие следов мтДНК неандертальцев) был бы вероятен, если бы не был большой процент предков неандертальцев или не было сильного положительного отбора для этой мтДНК (например, 5 поколений, только 1 из 32 ваших предков внес свой вклад в вашу мтДНК, поэтому, если бы один из этих 32 был чистым неандертальцем, вы могли бы ожидать, что ~ 3% вашей аутосомной ДНК будет неандертальского происхождения, но у вас будет ~ 97% шанс иметь никаких следов мтДНК неандертальца).[нужна цитата ]
Эпигеном
Эпигенетика описывает множество особенностей генома человека, которые выходят за рамки его первичной последовательности ДНК, например: хроматин упаковка гистон модификации и Метилирование ДНК, которые важны для регуляции экспрессии генов, репликации генома и других клеточных процессов. Эпигенетические маркеры усиливают и ослабляют транскрипцию определенных генов, но не влияют на фактическую последовательность нуклеотидов ДНК. Метилирование ДНК - основная форма эпигенетического контроля над экспрессией генов и одна из наиболее изученных тем в эпигенетике. В процессе развития профиль метилирования ДНК человека претерпевает кардинальные изменения. В ранних клетках зародышевой линии геном имеет очень низкие уровни метилирования. Эти низкие уровни обычно описывают активные гены. По мере развития родительские метки импринтинга приводят к повышенной активности метилирования.[116][117]
Эпигенетические паттерны могут быть идентифицированы между тканями внутри человека, а также между самими людьми. Идентичные гены, различающиеся только эпигенетическим состоянием, называются эпиаллели. Эпиаллели можно разделить на три категории: те, которые непосредственно определяются генотипом человека, те, на которые влияет генотип, и те, которые полностью независимы от генотипа. На эпигеном также значительно влияют факторы окружающей среды. Диета, токсины и гормоны влияют на эпигенетическое состояние. Исследования диетических манипуляций показали, что диеты с дефицитом метила связаны с гипометилированием эпигенома. Такие исследования показывают, что эпигенетика является важным связующим звеном между окружающей средой и геномом.[118]
Смотрите также
использованная литература
- ^ «ГРЧ38.п13». NCBI. Консорциум ссылок на геном. Получено 8 июн 2020.
- ^ Браун Т.А. (2002). Геном человека (2-е изд.). Оксфорд: Wiley-Liss.
- ^ а б Абекасис Г. Р., Аутон А., Брукс Л. Д., ДеПристо М. А., Дурбин Р. М., Хандакер Р. Э., Канг Х. М., Март Г. Т., Маквин Г. А. (ноябрь 2012 г.). «Интегрированная карта генетических вариаций из 1092 геномов человека». Природа. 491 (7422): 56–65. Bibcode:2012Натура 491 ... 56Т. Дои:10.1038 / природа11632. ЧВК 3498066. PMID 23128226.
- ^ Аутон А., Брукс Л.Д., Дурбин Р.М., Гаррисон Е.П., Кан Х.М., Корбел Дж.О. и др. (Октябрь 2015 г.). «Глобальный справочник генетических вариаций человека». Природа. 526 (7571): 68–74. Bibcode:2015 Натур.526 ... 68 т. Дои:10.1038 / природа15393. ЧВК 4750478. PMID 26432245.
- ^ Секвенирование шимпанзе; Консорциум анализа (2005 г.). «Исходная последовательность генома шимпанзе и сравнение с геномом человека» (PDF). Природа. 437 (7055): 69–87. Bibcode:2005Натура 437 ... 69.. Дои:10.1038 / природа04072. PMID 16136131. S2CID 2638825.
- ^ Варки А., Альтейде Т.К. (декабрь 2005 г.). «Сравнение геномов человека и шимпанзе: поиск иголок в стоге сена». Геномные исследования. 15 (12): 1746–58. Дои:10.1101 / гр.3737405. PMID 16339373.
- ^ Международный консорциум по секвенированию генома человека публикует последовательность и анализ генома человека
- ^ Pennisi E (февраль 2001 г.). «Геном человека». Наука. 291 (5507): 1177–80. Дои:10.1126 / science.291.5507.1177. PMID 11233420. S2CID 38355565.
- ^ а б Международный консорциум по секвенированию генома человека (октябрь 2004 г.). «Завершение эухроматической последовательности генома человека». Природа. 431 (7011): 931–45. Bibcode:2004Натура.431..931H. Дои:10.1038 / природа03001. PMID 15496913.
- ^ Molteni M (19 ноября 2018 г.). «Теперь вы можете секвенировать весь свой геном всего за 200 долларов». Проводной.
- ^ Уэйд Н. (23 сентября 1999 г.). «Число генов человека составляет 140 000, значительный прирост». Нью-Йорк Таймс.
- ^ Ezkurdia I, Juan D, Rodriguez JM, Frankish A, Diekhans M, Harrow J, Vazquez J, Valencia A, Tress ML (ноябрь 2014 г.). «Многочисленные цепочки свидетельств предполагают, что может быть всего 19 000 генов, кодирующих человеческий белок». Молекулярная генетика человека. 23 (22): 5866–78. Дои:10.1093 / hmg / ddu309. ЧВК 4204768. PMID 24939910.
- ^ Saey TH (17 сентября 2018 г.). "Пересчет человеческих генов увеличивает число как минимум до 46 831". Новости науки.
- ^ Аллес Дж., Фельманн Т., Фишер У., Бэкес С., Галата В., Минет М. и др. (Апрель 2019 г.). «Оценка общего количества истинных человеческих miRNA». Исследования нуклеиновых кислот. 47 (7): 3353–3364. Дои:10.1093 / nar / gkz097. ЧВК 6468295. PMID 30820533.
- ^ а б c Pennisi E (сентябрь 2012 г.). «Геномика. Проект ENCODE пишет панегирик мусорной ДНК». Наука. 337 (6099): 1159–1161. Дои:10.1126 / science.337.6099.1159. PMID 22955811.
- ^ Чжан С. (28 ноября 2018 г.). "300 миллионов букв ДНК отсутствуют в геноме человека". Атлантический океан.
- ^ а б c d Международный консорциум по секвенированию генома человека (февраль 2001 г.). "Начальная последовательность и анализ человеческого генома". Природа. 409 (6822): 860–921. Bibcode:2001Натура.409..860л. Дои:10.1038/35057062. PMID 11237011.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Pollack A (2 июня 2016 г.). «Ученые анонсируют проект HGP-Write по синтезу генома человека». Газета "Нью-Йорк Таймс. Получено 2 июн 2016.
- ^ Боке Дж. Д., Черч Дж., Хессель А., Келли Н. Дж., Аркин А., Кай Й и др. (Июль 2016 г.). «Проект-Геном». Наука. 353 (6295): 126–7. Bibcode:2016Научный ... 353..126B. Дои:10.1126 / science.aaf6850. PMID 27256881. S2CID 206649424.
- ^ Чжан, Сара (28 ноября 2018 г.). «300 миллионов букв ДНК отсутствуют в геноме человека». Атлантический океан. Получено 16 августа 2019.
- ^ Chaisson MJ, Huddleston J, Dennis MY, Sudmant PH, Malig M, Hormozdiari F, Antonacci F, Surti U, Sandstrom R, Boitano M, Landolin JM, Стаматояннопулос Ж.А., Hunkapiller MW, Korlach J, Eichler EE (январь 2015 г.). «Разрешение сложности генома человека с помощью секвенирования одной молекулы». Природа. 517 (7536): 608–11. Bibcode:2015Натура. 517..608C. Дои:10.1038 / природа13907. ЧВК 4317254. PMID 25383537.
- ^ Мига, Карен Х .; Корень, Сергей; Ри, Аранг; Vollger, Mitchell R .; Гершман, Ариэль; Бзикадзе, Андрей; Брукс, Шелиз; Хау, Эдмунд; Порубский, Давид; Logsdon, Glennis A .; Шнайдер, Валери А. (сентябрь 2020 г.). «Сборка теломер-теломер полной Х-хромосомы человека». Природа. 585 (7823): 79–84. Дои:10.1038 / s41586-020-2547-7. ISSN 1476-4687. ЧВК 7484160. PMID 32663838.
- ^ Piovesan A, Pelleri MC, Antonaros F, Strippoli P, Caracausi M, Vitale L (февраль 2019 г.). «О длине, весе и содержании ГК генома человека». BMC Research Notes. 12 (1): 106. Дои:10.1186 / s13104-019-4137-z. ЧВК 6391780. PMID 30813969.
- ^ Salzberg SL (август 2018 г.). «Открытые вопросы: сколько у нас генов?». BMC Биология. 16 (1): 94. Дои:10.1186 / с12915-018-0564-х. ЧВК 6100717. PMID 30124169.
- ^ "Статистика генкода, версия 28". Архивировано из оригинал 2 марта 2018 г.. Получено 12 июля 2018.
- ^ «Статистика ансамбля для версии 92.38, соответствующей Gencode v28». Получено 12 июля 2018.
- ^ "Аннотации NCBI Homo sapiens, выпуск 108". НАЦИОНАЛЬНЫЕ ИНСТИТУТЫ ЗДРАВООХРАНЕНИЯ США. 2016 г.
- ^ «ШАХМАТНАЯ статистика, версия 2.0». Центр вычислительной биологии. Университет Джона Хопкинса.
- ^ «Завершение проекта« Геном человека »: часто задаваемые вопросы». Национальный институт исследования генома человека (NHGRI). Получено 2 февраля 2019.
- ^ Кристли С., Лу И, Ли Ц, Се Х (январь 2009 г.). «Геномы человека как вложения электронной почты». Биоинформатика. 25 (2): 274–5. Дои:10.1093 / биоинформатика / btn582. PMID 18996942.
- ^ Лю Зи (2008). «Покрытие последовательностей, энтропия геномов и возможность обнаружения нечеловеческой ДНК в образцах человека». BMC Genomics. 9: 509. Дои:10.1186/1471-2164-9-509. ЧВК 2628393. PMID 18973670., Инжир. 6, используя Лемпель-Зив оценки скорости энтропии.
- ^ Waters K (7 марта 2007 г.). «Молекулярная генетика». Стэнфордская энциклопедия философии. Получено 18 июля 2013.
- ^ Ганнетт Л. (26 октября 2008 г.). «Проект генома человека». Стэнфордская энциклопедия философии. Получено 18 июля 2013.
- ^ Круговая диаграмма PANTHER на домашней странице Системы классификации PANTHER. Проверено 25 мая 2011 г.
- ^ Список белков человека в эталонном протеоме Uniprot Human; доступ 28 января 2015 г.
- ^ Кауфман С.А. (март 1969 г.). «Метаболическая стабильность и эпигенез в случайно построенных генетических сетях». Журнал теоретической биологии. 22 (3): 437–67. Дои:10.1016/0022-5193(69)90015-0. PMID 5803332.
- ^ Оно С (1972). «Аргумент в пользу генетической простоты человека и других млекопитающих». Журнал эволюции человека. 1 (6): 651–662. Дои:10.1016/0047-2484(72)90011-5.
- ^ Семон М., Муширу Д., Дюре Л. (февраль 2005 г.). «Связь между экспрессией генов и GC-содержанием у млекопитающих: статистическая значимость и биологическая значимость». Молекулярная генетика человека. 14 (3): 421–7. Дои:10.1093 / hmg / ddi038. PMID 15590696.
- ^ М. Хуан, Х. Чжу, Б. Шэнь, Г. Гао, «Неслучайная походка по геному человека», 3-я Международная конференция по биоинформатике и биомедицинской инженерии (UCBBE, 2009), 1–3.
- ^ а б c Piovesan A, Caracausi M, Antonaros F, Pelleri MC, Vitale L (2016). «GeneBase 1.1: инструмент для обобщения данных из наборов генных данных NCBI и его применение для обновления статистики генов человека». База данных: журнал биологических баз данных и курирования. 2016: baw153. Дои:10.1093 / база данных / baw153. ЧВК 5199132. PMID 28025344.
- ^ Банг М.Л., Центнер Т, Форнофф Ф, Гич А.Дж., Готтхардт М., Макнабб М., Витт С.К., Лабейт Д., Грегорио С.К., Гранзье Х., Лабейт С. (2001). «Полная последовательность гена тайтина, экспрессия необычной изоформы тайтина массой около 700 кДа и ее взаимодействие с обскурином определяют новую систему связывания Z-линии с I-полосой». Циркуляционные исследования. 89 (11): 1065–72. Дои:10.1161 / ч2301.100981. PMID 11717165.
- ^ Грегори Т.Р. (сентябрь 2005 г.). «Синергия между последовательностью и размером в крупномасштабной геномике». Природа Обзоры Генетика. 6 (9): 699–708. Дои:10.1038 / nrg1674. PMID 16151375. S2CID 24237594.
- ^ а б Палаццо AF, Акеф А (июнь 2012 г.). «Ядерный экспорт как ключевой арбитр« идентичности мРНК »у эукариот». Biochimica et Biophysica Acta (BBA) - механизмы регуляции генов. 1819 (6): 566–77. Дои:10.1016 / j.bbagrm.2011.12.012. PMID 22248619.
- ^ Людвиг М.З. (декабрь 2002 г.). «Функциональная эволюция некодирующей ДНК». Текущее мнение в области генетики и развития. 12 (6): 634–9. Дои:10.1016 / S0959-437X (02) 00355-6. PMID 12433575.
- ^ Мартенс Дж. А., Лапрад Л., Уинстон Ф (июнь 2004 г.). «Межгенная транскрипция необходима для репрессии гена SER3 Saccharomyces cerevisiae». Природа. 429 (6991): 571–4. Bibcode:2004Натура 429..571М. Дои:10.1038 / природа02538. PMID 15175754. S2CID 809550.
- ^ Цай М.К., Поместье О, Ван И, Мосаммапараст Н, Ван Дж.К., Лан Ф, Ши И, Сегал Э, Чанг ХЙ (Август 2010 г.). «Длинная некодирующая РНК как модульный каркас комплексов модификации гистонов». Наука. 329 (5992): 689–93. Bibcode:2010Sci ... 329..689T. Дои:10.1126 / science.1192002. ЧВК 2967777. PMID 20616235.
- ^ Бартоломей М.С., Земель С., Тилгман С.М. (май 1991 г.). «Родительский импринтинг мышиного гена H19». Природа. 351 (6322): 153–5. Bibcode:1991Натура.351..153Б. Дои:10.1038 / 351153a0. PMID 1709450. S2CID 4364975.
- ^ Кобаяши Т., Гэнли А.Р. (сентябрь 2005 г.). «Регуляция рекомбинации посредством индуцированной транскрипцией диссоциации когезина в повторах рДНК». Наука. 309 (5740): 1581–4. Bibcode:2005Наука ... 309.1581K. Дои:10.1126 / science.1116102. PMID 16141077. S2CID 21547462.
- ^ Салмена Л., Полисено Л., Тай Й, Кац Л., Пандольфи П. П. (август 2011 г.). "Гипотеза цРНК: Розеттский камень скрытого языка РНК?". Ячейка. 146 (3): 353–8. Дои:10.1016 / j.cell.2011.07.014. ЧВК 3235919. PMID 21802130.
- ^ Пей Б., Сису С., Фрэнкиш А., Ховальд С., Хабеггер Л., Му XJ, Харт Р., Баласубраманиан С., Танзер А., Диханс М., Реймонд А., Хаббард Т. Дж., Харроу Дж., Герштейн МБ (2012). «Псевдогенный ресурс GENCODE». Геномная биология. 13 (9): R51. Дои:10.1186 / gb-2012-13-9-r51. ЧВК 3491395. PMID 22951037.
- ^ Гилад Й, Ман О, Паабо С., Ланцет Д. (март 2003 г.). «Человеческая специфическая потеря генов обонятельных рецепторов». Труды Национальной академии наук Соединенных Штатов Америки. 100 (6): 3324–7. Bibcode:2003ПНАС..100.3324Г. Дои:10.1073 / pnas.0535697100. ЧВК 152291. PMID 12612342.
- ^ Айер М.К., Никнафс Ю.С., Малик Р., Сингхал Ю., Саху А., Хосоно И., Барретт Т. Р., Пренснер Дж. Р., Эванс Дж. Р., Чжао С., Поляков А., Цао Х, Дханасекаран С. М., Ву Ю. М., Робинсон Д. Р., Бир Д. Г., Фэн Ф. , Айер Х.К., Чиннайян А.М. (март 2015 г.). «Пейзаж длинных некодирующих РНК в транскриптоме человека». Природа Генетика. 47 (3): 199–208. Дои:10,1038 / нг.3192. ЧВК 4417758. PMID 25599403.
- ^ Эдди С.Р. (декабрь 2001 г.). «Некодирующие гены РНК и современный мир РНК». Природа Обзоры Генетика. 2 (12): 919–29. Дои:10.1038/35103511. PMID 11733745. S2CID 18347629.
- ^ Манагадзе Д., Лобковский А.Е., Вольф Ю.И., Шабалина С.А., Рогозин И.Б., Кунин Е.В. (2013). «Обширный консервативный lincRNome млекопитающих». PLOS вычислительная биология. 9 (2): e1002917. Bibcode:2013PLSCB ... 9E2917M. Дои:10.1371 / journal.pcbi.1002917. ЧВК 3585383. PMID 23468607.
- ^ Палаццо AF, Ли ES (2015). «Некодирующая РНК: что функционально, а что нежелательно?». Границы генетики. 6: 2. Дои:10.3389 / fgene.2015.00002. ЧВК 4306305. PMID 25674102.
- ^ Маттик Дж. С., Макунин И. В. (апрель 2006 г.). «Некодирующая РНК». Молекулярная генетика человека. 15 Спец. № 1: Р17–29. Дои:10.1093 / hmg / ddl046. PMID 16651366.
- ^ а б Бернштейн Б.Е., Бирни Е., Данхэм И., Грин Э.Д., Гюнтер С., Снайдер М. (сентябрь 2012 г.). «Интегрированная энциклопедия элементов ДНК в геноме человека». Природа. 489 (7414): 57–74. Bibcode:2012Натура 489 ... 57т. Дои:10.1038 / природа11247. ЧВК 3439153. PMID 22955616.
- ^ Бирни Э. (5 сентября 2012 г.). "ENCODE: Мои собственные мысли". Блог Юана: биоинформатик в целом.
- ^ Стаматояннопулос Я.А. (сентябрь 2012 г.). "Что кодирует наш геном?". Геномные исследования. 22 (9): 1602–11. Дои:10.1101 / гр.146506.112. ЧВК 3431477. PMID 22955972.
- ^ Кэрролл С.Б., Гомпель Н., Прюдом Б. (май 2008 г.). «Регулируя эволюцию». Scientific American. 298 (5): 60–67. Bibcode:2008SciAm.298e..60C. Дои:10.1038 / scientificamerican0508-60. PMID 18444326.
- ^ Миллер Дж. Х., Иппен К., Скайф Дж. Г., Беквит Дж. Р. (1968). «Промотор-операторная область lac-оперона Escherichia coli». J. Mol. Биол. 38 (3): 413–20. Дои:10.1016/0022-2836(68)90395-1. PMID 4887877.
- ^ Райт С., Розенталь А., Флавелл Р., Гросвельд Ф. (1984). «Последовательности ДНК, необходимые для регулируемой экспрессии генов бета-глобина в мышиных клетках эритролейкемии». Ячейка. 38 (1): 265–73. Дои:10.1016/0092-8674(84)90548-8. PMID 6088069. S2CID 34587386.
- ^ Nei M, Xu P, Glazko G (февраль 2001 г.). «Оценка времени дивергенции мультипротеиновых последовательностей для нескольких видов млекопитающих и нескольких отдаленно родственных организмов». Труды Национальной академии наук Соединенных Штатов Америки. 98 (5): 2497–502. Bibcode:2001ПНАС ... 98.2497Н. Дои:10.1073 / pnas.051611498. ЧВК 30166. PMID 11226267.
- ^ Лутс Г.Г., Локсли Р.М., Бланкеспур С.М., Ван З.Э., Миллер В., Рубин Е.М., Фрейзер К.А. (апрель 2000 г.). «Идентификация регулятора координат интерлейкинов 4, 13 и 5 путем сравнения последовательностей между видами». Наука. 288 (5463): 136–40. Bibcode:2000Sci ... 288..136L. Дои:10.1126 / science.288.5463.136. PMID 10753117.Резюме
- ^ Менье М. «Genoscope и Уайтхед объявляют о высоком уровне охвата генома Tetraodon nigroviridis». Геноскоп. Архивировано из оригинал 16 октября 2006 г.. Получено 12 сентября 2006.
- ^ Ромеро И.Г., Рувинский I, Гилад Y (июль 2012 г.). «Сравнительные исследования экспрессии генов и эволюции регуляции генов». Природа Обзоры Генетика. 13 (7): 505–16. Дои:10.1038 / nrg3229. ЧВК 4034676. PMID 22705669.
- ^ Schmidt D, Wilson MD, Ballester B, Schwalie PC, Brown GD, Marshall A, Kutter C, Watt S, Martinez-Jimenez CP, Mackay S, Talianidis I, Flicek P, Odom DT (май 2010 г.). «ChIP-seq пяти позвоночных обнаруживает эволюционную динамику связывания транскрипционного фактора». Наука. 328 (5981): 1036–40. Bibcode:2010Sci ... 328.1036S. Дои:10.1126 / science.1186176. ЧВК 3008766. PMID 20378774.
- ^ Wilson MD, Barbosa-Morais NL, Schmidt D, Conboy CM, Vanes L, Tybulewicz VL, Fisher EM, Tavaré S, Odom DT (октябрь 2008 г.). «Видоспецифическая транскрипция у мышей, несущих хромосому 21 человека». Наука. 322 (5900): 434–8. Bibcode:2008Sci ... 322..434W. Дои:10.1126 / наука.1160930. ЧВК 3717767. PMID 18787134.
- ^ Treangen TJ, Salzberg SL (январь 2012 г.). «Повторяющаяся ДНК и секвенирование следующего поколения: вычислительные задачи и решения». Природа Обзоры Генетика. 13 (1): 36–46. Дои:10.1038 / nrg3117. ЧВК 3324860. PMID 22124482.
- ^ Дуйтама Дж., Заблоцкая А., Гмайель Р., Янсен А., Белет С., Вермеш Дж. Р., Верстрепен К. Дж., Фройен Г. (май 2014 г.). «Масштабный анализ вариабельности тандемных повторов в геноме человека». Исследования нуклеиновых кислот. 42 (9): 5728–41. Дои:10.1093 / нар / gku212. ЧВК 4027155. PMID 24682812.
- ^ Пирс Б.А. (2012). Генетика: концептуальный подход (4-е изд.). Нью-Йорк: W.H. Фримен. С. 538–540. ISBN 978-1-4292-3250-0.
- ^ Беннетт Э.А., Келлер Х., Миллс Р.Э., Шмидт С., Моран СП, Вайхенридер О., Дивайн С.Е. (декабрь 2008 г.). «Активные ретротранспозоны Alu в геноме человека». Геномные исследования. 18 (12): 1875–83. Дои:10.1101 / гр.081737.108. ЧВК 2593586. PMID 18836035.
- ^ Лян К. Х., Йе СТ (2013). «Сеть ограничения экспрессии генов, опосредованная смысловыми и антисмысловыми последовательностями Alu, расположенными на кодирующих белки информационных РНК». BMC Genomics. 14: 325. Дои:10.1186/1471-2164-14-325. ЧВК 3655826. PMID 23663499.
- ^ Бруха Б., Шустак Дж., Бейдж Р.М., Лутц-Пригге С., Фарли А.Х., Моран СП, Казазиан Х.Х. (апрель 2003 г.). «Горячие L1 составляют основную часть ретротранспозиции в человеческой популяции». Труды Национальной академии наук Соединенных Штатов Америки. 100 (9): 5280–5. Bibcode:2003ПНАС..100.5280Б. Дои:10.1073 / pnas.0831042100. ЧВК 154336. PMID 12682288.
- ^ Бартон Н.Х., Бриггс Д.Е., Эйзен Дж. А., Гольдштейн Д. Б., Патель Н.Х. (2007). Эволюция. Колд-Спринг-Харбор, Нью-Йорк: Лаборатория Колд-Спринг-Харбор. ISBN 978-0-87969-684-9.
- ^ NCBI. «GRCh38 - hg38 - Геном - Сборка - NCBI». ncbi.nlm.nih.gov. Получено 15 марта 2019.
- ^ "из обращения Билла Клинтона о положении страны в 2000 году". Архивировано из оригинал 21 февраля 2017 г.. Получено 14 июн 2007.
- ^ Редон Р., Исикава С., Fitch KR, Феук Л., Перри Г. Х., Эндрюс Т. Д. и др. (Ноябрь 2006 г.). «Глобальные вариации числа копий в геноме человека». Природа. 444 (7118): 444–54. Bibcode:2006Натура.444..444R. Дои:10.1038 / природа05329. ЧВК 2669898. PMID 17122850.
- ^ "Что такое геном?". Genomenewsnetwork.org. 15 января 2003 г.. Получено 31 мая 2009.
- ^ NCBI_user_services (29 марта 2004 г.). «Картографический информационный бюллетень». Ncbi.nlm.nih.gov. Архивировано из оригинал 19 июля 2010 г.. Получено 31 мая 2009.
- ^ «О проекте». HapMap. Получено 31 мая 2009.
- ^ «Выпуск 2008 г .: исследователи составили первую карту последовательностей крупномасштабных структурных изменений в геноме человека». genome.gov. Получено 31 мая 2009.
- ^ Кидд Дж. М., Купер Г. М., Донахью В. Ф., Хайден Х. С., Сампас Н., Грейвс Т. и др. (Май 2008 г.). «Картирование и секвенирование структурных вариаций восьми геномов человека». Природа. 453 (7191): 56–64. Bibcode:2008 Натур.453 ... 56K. Дои:10.1038 / природа06862. ЧВК 2424287. PMID 18451855.
- ^ Грей IC, Кэмпбелл Д.А., Сперр Н.К. (2000). «Полиморфизмы одиночных нуклеотидов как инструменты в генетике человека». Молекулярная генетика человека. 9 (16): 2403–2408. Дои:10.1093 / hmg / 9.16.2403. PMID 11005795.
- ^ Лай Э (июнь 2001 г.). «Применение SNP-технологий в медицине: извлеченные уроки и вызовы будущего». Геномные исследования. 11 (6): 927–9. Дои:10.1101 / гр.192301. PMID 11381021.
- ^ «Завершение проекта« Геном человека »: часто задаваемые вопросы». genome.gov. Получено 31 мая 2009.
- ^ Певица Е (4 сентября 2007 г.). "Геном Крейга Вентера". Обзор технологий MIT. Получено 25 мая 2010.
- ^ Пушкарев Дмитрий; Нефф, Норма Ф; Quake, Стивен Р. (сентябрь 2009 г.). «Одномолекулярное секвенирование индивидуального генома человека». Природа Биотехнологии. 27 (9): 847–850. Дои:10.1038 / nbt.1561.
- ^ Эшли, Юан А; Бьютт, Атул Дж; Уиллер, Мэтью Т; Чен, Ронг; Klein, Teri E; Дьюи, Фредерик Э; Дадли, Джоэл Т; Ормонд, Келли Э; Павлович, Александра; Морган, Александр А; Пушкарев Дмитрий; Нефф, Норма Ф; Хаджинс, Луанн; Гонг, Ли; Ходжес, Лаура М; Берлин, Дорит С; Торн, Кэролайн Ф; Сангкуль, Катрин; Hebert, Joan M; Вун, Марк; Сагрейя, Херш; Уэйли, Райан; Ноулз, Джошуа В.; Чоу, Майкл Ф; Такурия, Джозеф V; Розенбаум, Авраам М; Заранек, Александр Ждут; Церковь, Джордж М; Грили, Генри Т; Quake, Стивен Р.; Альтман, Расс Б. (май 2010 г.). «Клиническая оценка с использованием личного генома». Ланцет. 375 (9725): 1525–1535. Дои:10.1016 / S0140-6736 (10) 60452-7.
- ^ Дьюи, Фредерик Э .; Чен, Ронг; Cordero, Sergio P .; Ормонд, Келли Э .; Калешу, Коллин; Karczewski, Konrad J .; Whirl-Carrillo, Мишель; Уиллер, Мэтью Т .; Дадли, Джоэл Т .; Бирнс, Джейк К .; Cornejo, Omar E .; Ноулз, Джошуа В .; Вун, Марк; Сангкуль, Катрин; Гонг, Ли; Торн, Кэролайн Ф .; Hebert, Joan M .; Каприотти, Эмидио; Дэвид, Шон П .; Павлович, Александра; Уэст, Энн; Такурия, Джозеф V .; Болл, Мадлен П .; Заранек, Александр В .; Rehm, Heidi L .; Церковь, Джордж М .; West, John S .; Bustamante, Carlos D .; Снайдер, Майкл; Альтман, Русь Б .; Klein, Teri E .; Butte, Atul J .; Эшли, Юан А. (15 сентября 2011 г.). «Поэтапный геномный риск всего генома в семейном квартете с использованием контрольной последовательности главного аллеля». PLoS Genetics. 7 (9): e1002280. Дои:10.1371 / journal.pgen.1002280.
- ^ «Complete Genomics добавляет 29 полных наборов данных для секвенирования генома человека с широким охватом в свой публичный геномный репозиторий».
- ^ Образец I (17 февраля 2010 г.). «Геном Десмонда Туту секвенирован в рамках исследования генетического разнообразия». Хранитель.
- ^ Schuster SC, Miller W., Ratan A, Tomsho LP, Giardine B, Kasson LR, et al. (2010). «Полные геномы койсанов и банту из южной части Африки». Природа. 463 (7283): 943–7. Bibcode:2010Натура.463..943С. Дои:10.1038 / природа08795. ЧВК 3890430. PMID 20164927.
- ^ Расмуссен М., Ли Ю., Линдгрин С., Педерсен Дж. С., Альбрехтсен А., Мольтке И. и др. (Февраль 2010 г.). «Древняя последовательность генома человека вымершего палео-эскимоса». Природа. 463 (7282): 757–62. Bibcode:2010Натура.463..757R. Дои:10.1038 / природа08835. ЧВК 3951495. PMID 20148029.
- ^ Corpas M, Кариазо М., Колетта А., Вайс Д., Харрисон А. П., Моран Ф., Ян Х. (12 ноября 2013 г.). «Полный набор данных общедоступной семейной геномики». bioRxiv 10.1101/000216.
- ^ Corpas M (Июнь 2013). «Краудсорсинг корпасомы». Исходный код для биологии и медицины. 8 (1): 13. Дои:10.1186/1751-0473-8-13. ЧВК 3706263. PMID 23799911.
- ^ Мао Кью, Чотлос С., Чжан Р.Ю., Болл М.П., Чин Р., Карневали П. и др. (Октябрь 2016 г.). «Последовательности всего генома и экспериментально фазированные гаплотипы более 100 личных геномов». GigaScience. 5 (1): 42. Дои:10.1186 / s13742-016-0148-z. ЧВК 5057367. PMID 27724973.
- ^ Цай Б., Ли Б., Кига Н., Тусберг Дж., Бергквист Т., Чен Ю.С. и др. (Сентябрь 2017 г.). «Сопоставление фенотипов с полными геномами: уроки, извлеченные из четырех итераций задач сообщества проекта личного генома». Человеческая мутация. 38 (9): 1266–1276. Дои:10.1002 / humu.23265. ЧВК 5645203. PMID 28544481.
- ^ Гонзага-Хореги К., Лупски-младший, Гиббс Р.А. (2012). «Секвенирование генома человека в условиях здоровья и болезней». Ежегодный обзор медицины. 63: 35–61. Дои:10.1146 / annurev-med-051010-162644. ЧВК 3656720. PMID 22248320.
- ^ Чой М., Шолл У.И., Джи В., Лю Т., Тихонова И.Р., Зумбо П., Наир А., Баккалоглу А., Озен С., Санжад С., Нельсон-Уильямс С., Фархи А., Мане С., Лифтон Р.П. (ноябрь 2009 г.). «Генетическая диагностика путем захвата всего экзома и массового параллельного секвенирования ДНК». Труды Национальной академии наук Соединенных Штатов Америки. 106 (45): 19096–101. Bibcode:2009PNAS..10619096C. Дои:10.1073 / pnas.0910672106. ЧВК 2768590. PMID 19861545.
- ^ а б Нарасимхан В.М., Сюэ И., Тайлер-Смит К. (апрель 2016 г.). "Нокаутирующие люди: мертвые, больные, здоровые или улучшенные?". Тенденции в молекулярной медицине. 22 (4): 341–351. Дои:10.1016 / j.molmed.2016.02.006. ЧВК 4826344. PMID 26988438.
- ^ Салехин Д., Натараджан П., Армеан И.М., Чжао В., Рашид А., Хетарпал С.А. и др. (Апрель 2017 г.). «Нокауты человека и фенотипический анализ в когорте с высоким уровнем кровного родства». Природа. 544 (7649): 235–239. Bibcode:2017Натура.544..235S. Дои:10.1038 / природа22034. ЧВК 5600291. PMID 28406212.
- ^ а б Хамош А., Скотт А.Ф., Амбергер Дж., Боккини С., Валле Д., МакКусик В.А. (январь 2002 г.). «Онлайн-Менделирующее наследование в человеке (OMIM), база знаний о генах человека и генетических нарушениях». Исследования нуклеиновых кислот. 30 (1): 52–5. Дои:10.1093 / nar / 30.1.52. ЧВК 99152. PMID 11752252.
- ^ Кацанис Н. (ноябрь 2016 г.). «Континуум причинности в генетических нарушениях человека». Геномная биология. 17 (1): 233. Дои:10.1186 / s13059-016-1107-9. ЧВК 5114767. PMID 27855690.
- ^ Вонг, Ли-Джун С. (2017), Вонг, Ли-Джун С. (редактор), «Обзор клинической полезности секвенирования следующего поколения в молекулярной диагностике генетических заболеваний человека», Клиническая молекулярная диагностика генетических заболеваний человека на основе секвенирования нового поколения, Springer International Publishing, стр. 1–11, Дои:10.1007/978-3-319-56418-0_1, ISBN 978-3-319-56418-0
- ^ Федик А., Чжан Дж. (2017). Вонг LC (ред.). Следующее поколение проверки носителей информации. Клиническая молекулярная диагностика генетических заболеваний человека на основе секвенирования нового поколения. Издательство Springer International. С. 339–354. Дои:10.1007/978-3-319-56418-0_16. ISBN 978-3-319-56418-0.
- ^ Уотерстон Р.Х., Линдблад-То К., Бирни Э., Роджерс Дж., Абрил Дж. Ф., Агарвал П., Агарвала Р., Эйнскау Р., Александерсон М. и др. (Декабрь 2002 г.). «Первоначальное секвенирование и сравнительный анализ генома мыши». Природа. 420 (6915): 520–62. Bibcode:2002 Натур. 420..520Вт. Дои:10.1038 / природа01262. PMID 12466850.
доля небольших (50–100 п.н.) сегментов в геноме млекопитающих, подвергающихся (очищающей) селекции, может быть оценена примерно в 5%. Эта пропорция намного выше, чем может быть объяснена только последовательностями, кодирующими белок, подразумевая, что геном содержит множество дополнительных функций (таких как нетранслируемые области, регуляторные элементы, гены, не кодирующие белки, и структурные элементы хромосом) при отборе по биологической функции. .
- ^ Бирни Э., Стаматояннопулос Дж. А., Дутта А., Гиго Р., Джингерас Т. Р., Маргулиес Э. Х. и др. (Июнь 2007 г.). «Идентификация и анализ функциональных элементов в 1% генома человека в рамках пилотного проекта ENCODE». Природа. 447 (7146): 799–816. Bibcode:2007Натура.447..799Б. Дои:10.1038 / природа05874. ЧВК 2212820. PMID 17571346.
- ^ Секвенирование шимпанзе; Консорциум анализа (сентябрь 2005 г.). «Исходная последовательность генома шимпанзе и сравнение с геномом человека». Природа. 437 (7055): 69–87. Bibcode:2005Натура 437 ... 69.. Дои:10.1038 / природа04072. PMID 16136131.
Мы подсчитали, что расхождение нуклеотидов по всему геному между человеком и шимпанзе составляет 1,23%, подтверждая недавние результаты более ограниченных исследований.
- ^ Секвенирование шимпанзе; Консорциум анализа (сентябрь 2005 г.). «Исходная последовательность генома шимпанзе и сравнение с геномом человека». Природа. 437 (7055): 69–87. Bibcode:2005Натура 437 ... 69.. Дои:10.1038 / природа04072. PMID 16136131.
мы оцениваем, что полиморфизм составляет 14–22% наблюдаемой скорости расхождения, и, таким образом, фиксированная дивергенция составляет ~ 1,06% или меньше.
- ^ Демут Дж. П., Де Би Т., Стаджич Дж. Э., Кристианини Н., Хан М. В. (2006). «Эволюция семейств генов млекопитающих». PLOS ONE. 1 (1): e85. Bibcode:2006PLoSO ... 1 ... 85D. Дои:10.1371 / journal.pone.0000085. ЧВК 1762380. PMID 17183716.
Наши результаты предполагают, что люди и шимпанзе различаются по крайней мере на 6% (1418 из 22000 генов) по своему набору генов, что резко контрастирует с часто цитируемой разницей в 1,5% между ортологичными нуклеотидными последовательностями.
- ^ Секвенирование шимпанзе; Консорциум анализа (сентябрь 2005 г.). «Исходная последовательность генома шимпанзе и сравнение с геномом человека». Природа. 437 (7055): 69–87. Bibcode:2005Натура 437 ... 69.. Дои:10.1038 / природа04072. PMID 16136131.
Хромосома 2 человека возникла в результате слияния двух наследственных хромосом, которые остались отдельными в линии шимпанзе.
Олсон М.В., Варки А. (январь 2003 г.). «Секвенирование генома шимпанзе: понимание эволюции человека и болезней». Природа Обзоры Генетика. 4 (1): 20–8. Дои:10.1038 / nrg981. PMID 12509750. S2CID 205486561.Теперь предстоит крупномасштабное секвенирование генома шимпанзе.
- ^ Gilad Y, Wiebe V, Przeworski M, Lancet D, Pääbo S (январь 2004 г.). «Утрата генов обонятельных рецепторов совпадает с приобретением полного трихроматического зрения у приматов». PLOS Биология. 2 (1): E5. Дои:10.1371 / journal.pbio.0020005. ЧВК 314465. PMID 14737185.
Наши результаты позволяют предположить, что ухудшение обонятельного репертуара произошло одновременно с приобретением полного трехцветного цветового зрения у приматов.
- ^ Циммер С (21 сентября 2016 г.). «Как мы сюда попали: ДНК указывает на единственную миграцию из Африки». Газета "Нью-Йорк Таймс. Получено 22 сентября 2016.
- ^ Сайкс Б. (9 октября 2003 г.). «Митохондриальная ДНК и история человечества». Геном человека. Архивировано из оригинал 7 сентября 2015 г.. Получено 19 сентября 2006.
- ^ Мистели Т. (февраль 2007 г.). «Вне последовательности: клеточная организация функции генома». Ячейка. 128 (4): 787–800. Дои:10.1016 / j.cell.2007.01.028. PMID 17320514. S2CID 9064584.
- ^ Бернштейн Б.Е., Мейснер А., Ландер Е.С. (февраль 2007 г.). «Эпигеном млекопитающих». Ячейка. 128 (4): 669–81. Дои:10.1016 / j.cell.2007.01.033. PMID 17320505. S2CID 2722988.
- ^ Шин А.Дж., Жуниен К. (май – июнь 2012 г.). «[Эпигенетика, интерфейс между окружающей средой и генами: роль в сложных заболеваниях]». Revue Médicale de Liège. 67 (5–6): 250–7. PMID 22891475.
внешние ссылки
- Ансамбль В Ансамбль Проект браузера Genome
- Программа просмотра генома человека Национальной медицинской библиотеки
- Браузер генома UCSC.
- Проект генома человека.
- Национальный институт исследования генома человека *Национальное управление геномики общественного здравоохранения
- Простая программа просмотра генома человека
