Триборациклопропенил - Википедия - Triboracyclopropenyl

В триборациклопропенил фрагмент - это циклический структурный мотив в бор химия, названная за ее геометрическое сходство с циклопропен. В отличие от неплоских борановые кластеры которые показывают выше координационные номера у бора (например, через 3-центральные 2-электронные связи к мосту гидриды или катионы ), структуры типа триборациклопропенила представляют собой кольца из трех атомов бора, где заместители у каждого бора также являются копланарный на ринг. Соединения, содержащие триборациклопропенил, являются крайними случаями неорганических ароматичность. Это самые легкие и мельчайшие циклические структуры, которые, как известно, демонстрируют связывающие и магнитные свойства, которые происходят от полного делокализованные электроны на орбиталях σ и π симметрия. Хотя трехчленные кольца бора часто бывают такими очень напряженный поскольку экспериментально недоступны, академический интерес к их отличительной ароматичности и возможной роли как промежуточных звеньев боран пиролиз мотивировал обширные вычислительные исследования химики-теоретики.[1][2][3][4] Начиная с конца 1980-х гг. масс-спектрометрии работа Андерсона и другие. на полностью борных кластерах экспериментальные исследования триборациклопропенилов в течение десятилетий ограничивались исключительно газофазными исследованиями простейших колец (ионы B3).[4][5][6] Однако более поздняя работа стабилизировала триборациклопропенильный фрагмент посредством координации с донорской лиганды или переходные металлы, резко расширив сферу своей химии.[7][8][9][10]
Синтез
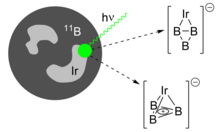
Для газофазных спектроскопических исследований триборациклопропенилсодержащие соединения получают методом лазерная абляция борных мишеней и коллимация образовавшегося плазменного облака в потоке инертного газа-носителя, такого как гелий. Затем интересующие заряженные молекулы выбираются по массе с помощью время полета масс-спектрометрии. Добавление газов, таких как N2 или CO к потоку газа дает соответствующий аддукты, а добавление металлов, таких как иридий и ванадий к мишени B дает соответствующие легированные металлом кластеры.[11]
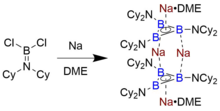
Единственный выделяемый пример триборациклопропенильного аниона, который сохраняется в растворе и в твердом состоянии, был идентифицирован Брауншвейгом и сотрудниками, которые синтезировали его путем восстановления аминоборан Cl2B = NCy2 (Cy = циклогексил ) с мелкодисперсным металлическим натрием в диметоксиэтан (DME).[7] Охлаждение полученного оранжево-красного раствора димерной формы Na4[B3(NCy2)3]2 • 2 DME привели к кристаллам, пригодным для дифракция рентгеновских лучей, по которому определялась структура. Хотя подробный механизм восстановления неизвестен, было высказано предположение, что субвалентный R2Промежуточные соединения N-B участвуют в образовании таких кластеров бора.[12]
Структура и склеивание
Из-за их особого статуса как простейших ароматических циклов электронная структура триборациклопропенильных производных была проанализирована с помощью различных методов в вычислительная химия. Они варьировались от канонических теория молекулярных орбиталей к альтернативным формулировкам связи, таким как адаптивная теория распределения естественной плотности,[13] то квантовая теория атомов в молекулах, теория орбиталей естественных облигаций, естественные орбитали для химической валентности[14] и функция локализации электронов анализ. НИКС и расчеты кольцевого тока также использовались для характеристики ароматичности в таких системах с использованием магнитных критериев.[15] В общем, чрезвычайно малый размер этих циклов означает, что их связывающие электроны испытывают значительное кулоновское отталкивание, что приводит к аномально высокому напряжение кольца.[16] Этот эффект частично компенсируется стабилизацией, обеспечиваемой ароматической делокализацией.
B3+
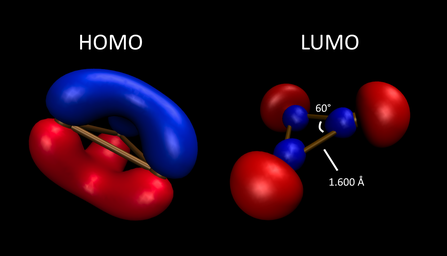
B3+ показывает π ароматичность, связанную с его а2'' -симметричный HOMO. В своем синглет электронное основное состояние, это Hückel 2π-электронная система, аналогичная катион циклопропения, но он слишком реактивен, чтобы изолировать его. Он треугольный, с D3ч симметрия - все его атомы B и расстояния связей B-B химически эквивалентны. Газофазные аддукты B3(N2)3+ и B3(CO)3+ были вычислительно изучены с помощью теории ETS-NOCV (расширенное переходное состояние - естественные орбитали для химической валентности), которая анализирует изменения энергии и электронной плотности, возникающие в результате получения молекулы из эталонного состояния невзаимодействующих фрагментов.[17] Анализ энергетического разложения ETS-NOCV предполагает, что N2 и CO-аддукты в основном стабилизируются (-83,6 и -112,3 ккал / моль соответственно) через σ-донорство экзоциклических лигандов в борное кольцо с высоким электронодефицитным состоянием. В результате каждый был интерпретирован как B3+ часть, поддерживаемая дательный падеж от N2 или CO. Плотность деформации электронов, построенная из NOCV этой системы, вместе с зарядами, полученными из естественных орбитальных популяций связей, указывает на поток электронов от экзоциклического лиганда в кольцо, которое индуцирует все эквивалентные связи B3+ ядро укоротить примерно к 16:00. π-симметричные взаимодействия наблюдаются как со слабым σ-донором N2 и сильный π-акцепторный лиганд CO. Однако внеплоскостное π-бэкдонирование (из π-системы B3 кольцо к π-акцепторным орбиталям каждого лиганда) менее стабилизирует, чем плоскостное π-бэкдонирование, с силой -26,7 и -19,6 ккал / моль для [B3(CO)2+ + CO] система. Это предполагает, что конфигурация молекулы с минимальной энергией - это такая конфигурация, которая сохраняет максимальную π ароматичность в B3+ ядро.
Так же ароматические виды, как циклопентадиенил анион и катион циклопропения может координироваться с переходными металлами, недавно было продемонстрировано, что B3+ кольцо может связываться с металлическими центрами.[18] Лазерная абляция смешанной мишени B / Ir дает два изомера IrB3−, а Б3+ кольцо согласовано с формальным Ir2- анион. Это псевдоплоские η2 аддукт и тетраэдр η3 аддукт, последний из которых содержит ароматический триборациклопропенильный фрагмент. Оба почти идентичны по энергии и сосуществуют в генерируемом кластерном пучке.

Расчеты показывают, что B3+ может даже связывать атомы инертных благородных газов с образованием необычного семейства соединений B3(Rg)3+ (Rg = редкий / благородный газ), с весьма незначительной прочностью связи (от 15-30 ккал / моль), которая проистекает из р-орбитальной σ-доничности Rg и значительной степени переноса заряда от Rg к B3+. Возможность нового соединения благородных газов которые образуются экзотермически и самопроизвольно - это возможность для экспериментальной работы.[19][21]
B3
B3 обладает одиноким1'HOMO (SOMO), который состоит из σ-симметричных орбиталей, ориентированных к сердцевине кольца, связанных с σ-делокализацией и немного более короткими длинами связей B-B по сравнению с B3+. Он парамагнитен с основным состоянием дублета.[22] Он неполярный, плоский и треугольный, имеет D3ч симметрия.
B3−
B3−, с заполненным1'HOMO в D3ч симметрия, считается «дважды» ароматической и относительно стабильной - он одновременно обладает сильно делокализованными σ- и π-электронами в своих HOMO и HOMO-1 соответственно.[23][24]
B3р32-
B3р32-, сформулированный с разделяющими электроны связями B-R, а не дательными стрелками, изоэлектронен B3+. 8 электронов отнесены к триборациклопенильному остову, 6 - на σ-связывающих орбиталях и 2 - в π-системе, что приводит к ароматичности Хюккеля. Единственное экспериментально охарактеризованное соединение этого класса - Na4[B3(NCy2)3]2 • 2 DME, димер сложенного B3р32- единицы, которые сами по себе являются ароматическими.[7] Анализ орбиталей естественных связей показывает, что это соединение высоко стабилизировано (примерно на 45 ккал / моль) за счет донорно-акцепторного взаимодействия локализованных связующих орбиталей B-B с соответствующей антисвязывающей орбиталью B-N поперек кольца, в дополнение к связыванию вместе электростатическое притяжение к мостиковому Na+ катионы идентифицированы в кристаллической структуре. DFT расчеты показывают, что HOMO и HOMO-1 представляют собой антисимметричные и симметричные комбинации π HOMO отдельного кольца, соответственно - свойство, общее с металлоцены. Как и ожидалось для разновидностей со связями B-B, которые имеют формальный порядок связи MO средняя длина связи B-B 1,62 Å ближе к длине катион-радикала диборена (R-B = B-R), чем одинарная связь B − B примерно 1,75 Å.
Спектроскопия и спектрометрия
Соединения, производные триборациклопропенила, были впервые идентифицированы по соотношению их массы к заряду как временные частицы в масс-спектрометрии сложных смесей катионных кластеров бора.[5] Исследования реактивного рассеяния с O2 вскоре последовал, обнаружив относительно прочную связь внутри легких кластеров бора.[6] Впоследствии B3 был изолированные в матрицах замороженных благородных газов и электронный парамагнитный резонанс были зарегистрированы спектры, которые подтвердили его D3ч геометрия.[22] Сверхтонкое взаимодействие неспаренного электрона с 11Ядро B обеспечило оценку 15% s-орбитального характера для a1'HOMO. Маленький и неполярный B3 кольца могли свободно кувыркаться и вращаться, даже когда они были заключены в матрицу.
В целом, триборациклопропенилсодержащие соединения были слишком короткоживущими и производились в недостаточном количестве для передачи. инфракрасная спектроскопия. Однако диссоциация B3(N2)3+ с инфракрасным светом и наблюдение за распадом соответствующего сигнала массы-заряда с помощью масс-спектрометрии позволило получить эффективный инфракрасный спектр B3(N2)3+ для записи.[17][25] Этот колебательный спектр фотодиссоциации содержал только одну обнаруживаемую вибрацию с красным смещением 98 см.−1 относительно газообразного N2, предполагая высокосимметричный B3(N2)3+ аддукт со слегка ослабленной связью N≡N.
Отрицательно заряженные ионы, содержащие триборациклопропенил, оказались пригодными для изучения. фотоэлектронная спектроскопия. От Теорема Купмана, пренебрегая влиянием сильного электронная корреляция кинетические энергии электронов, оторванных рентгеновскими лучами, могут быть отображены на энергии связи отдельных орбиталей и выявить молекулярную электронную структуру.[26][27] Разделение полученных спектральных пиков от "колебательная прогрессия "(согласно Франк-Кондон принцип) показывает, как ионизация при разных энергиях изменяет определенные частоты колебаний молекулы, и такие эффекты на связи интерпретируются с точки зрения изменений электронной конфигурации. В B3−наблюдалась необычно интенсивная и высокоэнергетическая полоса, соответствующая многоэлектронному или «встряхивающему» переходу (отщепление связанных электронов и электронное возбуждение), что указывает на сильную корреляцию электронов, присутствующую в триборациклопропенильном фрагменте.[4] Для IrB3−, колебательная прогрессия от растягивающих и дыхательных колебаний IrB3 может быть отнесен к наложенным спектрам обоих изомеров, присутствующих в кластерном пучке. По сравнению с расчетами, минимальная энергетическая структура IrB3 можно было бы тогда сформулировать как тетраэдр с неповрежденным ароматическим B3+ часть.[8]
Реактивность
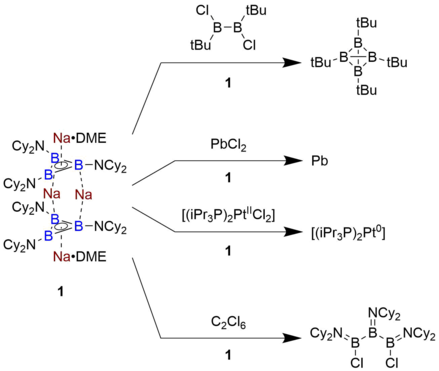
Реакционная способность триборациклопропенилсодержащих соединений относительно недостаточно изучена, так как только один пример был получен в фазе раствора. Соединение, указанное Брауншвейгом, Na4[B3(NCy2)3]2 • 2 ДМЭ является чрезвычайно сильным восстановителем с окислительным потенциалом -2,42 В по сравнению с парой ферроцен / ферроцений. В результате он способен восстанавливать хлоробораны с образованием тетраэдрических B-кластеров наряду с восстановлением PbCl.2 непосредственно на металлический Pb. Кроме того, он подвергнется реакции раскрытия кольца в точке B3 фрагмента путем абстрагирования атомов хлора от гексахлорэтан. Этот уровень восстанавливающей способности примерно сравним с щелочным металлом и ранее не наблюдался ни для одной молекулы на основе органического каркаса.[7]
Хотя большинство примеров трехъядерных кластеров бора, легированных переходными металлами, не содержат ароматический триборациклопропенильный фрагмент, реакционная способность таких частиц с небольшими молекулами, вероятно, вызовет растущий научный интерес. В условиях масс-спектрометрии показано, что VB3+ дегидрогенизирует метан с получением продуктов VB3CH2+ и H2. Незначительная побочная реакция, вызывающая VH+ и исключает B3CH3 также действует.[10]
Смотрите также
использованная литература
- ^ Макки, Майкл Л .; Бюль, Майкл; Чаркин, Олег П .; Шлейер, Пол против Р. (1993-10-01). «Теоретическое исследование четырехцентровой двухэлектронной связи с участием производных бора». Неорганическая химия. 32 (21): 4549–4554. Дои:10.1021 / ic00073a014. ISSN 0020-1669.
- ^ Коркин, Анатолий А .; Schleyer, Paul v. R .; Макки, Майкл Л. (1995-02-01). «Теоретическое ab Initio исследование нейтральных и заряженных B3Hn (n = 3-9) видов. Важность ароматичности в определении структурных предпочтений». Неорганическая химия. 34 (4): 961–977. Дои:10.1021 / ic00108a031. ISSN 0020-1669.
- ^ Ян, К. Л; Чжу, З. Х (27 августа 2001 г.). «Основное синглетное и низколежащее триплетное электронные состояния B3 +». Журнал молекулярной структуры: ТЕОХИМА. 571 (1): 225–229. Дои:10.1016 / S0166-1280 (01) 00558-9. ISSN 0166-1280.
- ^ а б c Чжай, Хуа-Цзинь; Ван, Лай-Шэн; Александрова Анастасия Н .; Болдырев, Александр I .; Закжевский, Вячеслав Г. (01.11.2003). "Фотоэлектронная спектроскопия и ab Initio исследование анионов B3 и B4 и их нейтралов". Журнал физической химии A. 107 (44): 9319–9328. Bibcode:2003JPCA..107.9319Z. Дои:10.1021 / jp0357119. ISSN 1089-5639.
- ^ а б Хэнли, Люк .; Андерсон, Скотт Л. (1987-09-01). «Образование и диссоциация малых кластерных ионов бора при столкновении». Журнал физической химии. 91 (20): 5161–5163. Дои:10.1021 / j100304a007. ISSN 0022-3654.
- ^ а б Хэнли, Люк; Андерсон, Скотт Л. (1988-09-01). «Окисление кислородом малых кластерных ионов бора (B + 1–13)». Журнал химической физики. 89 (5): 2848–2860. Bibcode:1988ЖЧФ..89.2848Н. Дои:10.1063/1.454989. ISSN 0021-9606.
- ^ а б c d е ж Купфер, Томас; Брауншвейг, Хольгер; Радацки, Кшиштоф (07.12.2015). "Триборациклопропенил Дианион: Легчайший из возможных элементов основной группы Hückel π Aromatic". Angewandte Chemie International Edition. 54 (50): 15084–15088. Дои:10.1002 / anie.201508670. PMID 26530854.
- ^ а б c Чекнер, Джозеф; Cheung, Ling Fung; Кочерил, Г. Стивен; Куличенко Максим; Болдырев, Александр I .; Ван, Лай-Шэн (24.06.2019). "Фотоэлектронное изображение высокого разрешения IrB 3 -: наблюдение π-ароматического кольца B 3 +, координированного с переходным металлом". Angewandte Chemie International Edition. 58 (26): 8877–8881. Дои:10.1002 / anie.201902406.
- ^ Чен, Синь; Чен, Тэн-Тенг; Ли, Ван-Лу; Лу, Джун-Бо; Чжао, Ли-цзюань; Цзянь, Тиан; Ху, Хань-Ши; Ван, Лай-Шэн; Ли, июнь (2019-01-07). «Лантаноиды с необычно низким уровнем окисления в кластерах боридов PrB 3 и PrB 4». Неорганическая химия. 58 (1): 411–418. Дои:10.1021 / acs.inorgchem.8b02572. ISSN 0020-1669. PMID 30543295.
- ^ а б Чен, Цян; Чжао, Янь-Ся; Цзян Ли-Сюэ; Ли, Хай-Фанг; Чен, Цзяо-Цзяо; Чжан, Тин; Лю, Цин-Ю; Он, Шэн-Гуй (2018). «Термическая активация метана кластерными катионами борида ванадия VB n + (n = 3–6)». Физическая химия Химическая физика. 20 (7): 4641–4645. Bibcode:2018PCCP ... 20.4641C. Дои:10.1039 / C8CP00071A. ISSN 1463-9076. PMID 29379936.
- ^ Цзянь, Тиан; Чен, Сюэнянь; Ли, Си-Диан; Болдырев, Александр I .; Ли, Цзюнь; Ван, Лай-Шэн (2019). «Исследование структур и связывание выбранных по размеру кластеров бора и легированного бора». Обзоры химического общества. 48 (13): 3550–3591. Дои:10.1039 / C9CS00233B. ISSN 0306-0012. PMID 31120469.
- ^ Wrackmeyer, Бернд (2016). "Циклотриборан дианион и триборон катион:" легкие концы "правила Хюккеля". Angewandte Chemie International Edition. 55 (6): 1962–1964. Дои:10.1002 / anie.201510689. ISSN 1521-3773.
- ^ Ткаченко, Николай В .; Болдырев Александр Иванович (2019-05-08). «Анализ химической связи возбужденных состояний с использованием метода адаптивного распределения естественной плотности». Физическая химия Химическая физика. 21 (18): 9590–9596. Bibcode:2019PCCP ... 21.9590T. Дои:10.1039 / C9CP00379G. ISSN 1463-9084.
- ^ Mitoraj, Mariusz P .; Михалак, Артур; Зиглер, Том (14 апреля 2009 г.). «Комбинированная схема разложения заряда и энергии для анализа облигаций». Журнал химической теории и вычислений. 5 (4): 962–975. Дои:10.1021 / ct800503d. ISSN 1549-9618. PMID 26609605.
- ^ Фам, Хунг Тан; Лим, Ки Дзэн; Havenith, Remco W. A .; Нгуен, Минь Тхо (28 апреля 2016 г.). «Ароматический характер плоских кластеров на основе бора, пересмотренный расчетами кольцевого тока». Физическая химия Химическая физика. 18 (17): 11919–11931. Bibcode:2016PCCP ... 1811919P. Дои:10.1039 / C5CP07391J. HDL:1854 / LU-8549871. ISSN 1463-9084. PMID 26956732.
- ^ Химмель, Ханс-Йорг (19.08.2019). «Электронодефицитные триборановые и тетраборановые кольцевые соединения: синтез, структура и связывание». Angewandte Chemie International Edition. 58 (34): 11600–11617. Дои:10.1002 / anie.201900563. PMID 30786130.
- ^ а б Джин, Джайе; Ван, Гуаньцзюнь; Чжоу, Минфэй; Андрада, Диего М .; Германн, Маркус; Френкинг, Гернот (05.02.2016). «Комплексы [B 3 (NN) 3] + и [B 3 (CO) 3] + с наименьшими π-ароматическими разновидностями B 3+». Angewandte Chemie International Edition. 55 (6): 2078–2082. Дои:10.1002 / anie.201509826. PMID 26836340.
- ^ Lichtenberger, Dennis L .; Hoppe, Martin L .; Субраманиан, Лалита; Кобер, Эдвард М .; Hughes, Russell P .; Хаббард, Джон Л .; Такер, Дэвид С. (1993-06-01). "Распределение электронов и связывание в комплексах .eta.3-циклопропенил-металл". Металлоорганические соединения. 12 (6): 2025–2031. Дои:10.1021 / om00030a011. ISSN 0276-7333.
- ^ а б c Ли, Чжо Чжэ; Ли, Ан Ён (2017-07-26). «Моноциклические ароматические соединения BnRgn (n − 2) + бора и инертных газов». Физическая химия Химическая физика. 19 (29): 19109–19119. Bibcode:2017PCCP ... 1919109L. Дои:10.1039 / C7CP00316A. ISSN 1463-9084. PMID 28702603.
- ^ Лу, Тиан; Чен, Фейу (2012). «Multiwfn: многофункциональный анализатор волновых функций». Журнал вычислительной химии. 33 (5): 580–592. Дои:10.1002 / jcc.22885. ISSN 1096-987X. PMID 22162017.
- ^ Саха, Ранаджит; Пан, Судип; Мандал, Субхаджит; Ороско, Месиас; Мерино, Габриэль; Чаттарадж, Пратим К. (17 августа 2016 г.). «Благородный газ поддерживает кластер B3 +: образование прочных ковалентных связей благородный газ-бор». RSC Advances. 6 (82): 78611–78620. Дои:10.1039 / C6RA16188J. ISSN 2046-2069.
- ^ а б Hamrick, Y.M .; Van Zee, R.J .; Велтнер, В. (1992-02-01). «Электронно-спиновой резонанс и основные состояния тримеров бора и алюминия». Журнал химической физики. 96 (3): 1767–1775. Bibcode:1992ЖЧФ..96.1767Н. Дои:10.1063/1.462132. ISSN 0021-9606.
- ^ Александрова Анастасия Н .; Болдырев, Александр I .; Чжай, Хуа-Цзинь; Ван, Лай-Шэн (01.11.2006). «Полностью борные ароматические кластеры как потенциальные новые неорганические лиганды и строительные блоки в химии». Обзоры координационной химии. 18-я основная группа по химии. 250 (21): 2811–2866. Дои:10.1016 / j.ccr.2006.03.032. ISSN 0010-8545.
- ^ Ян, Ли-минь; Ван, Цзянь; Дин, И-хун; Сунь, Чиа-чжун (2007-08-29). "Исследование типичной треугольной структуры B 3 в химии бора: понимание голых полностью борных кластеров, используемых в качестве лигандов или строительных блоков". Журнал физической химии A. 111 (37): 9122–9129. Bibcode:2007JPCA..111.9122Y. Дои:10.1021 / jp074645y. ISSN 1089-5639. PMID 17725336.
- ^ Ван, Гуаньцзюнь; Чи, Чаосянь; Син, Сяопэн; Дин, ЧуаньФан; Чжоу, Минфэй (01.01.2014). «Коллинеарный тандемный времяпролетный масс-спектрометр для инфракрасной спектроскопии фотодиссоциации масс-отобранных ионов». Наука Китай Химия. 57 (1): 172–177. Дои:10.1007 / s11426-013-4979-5. ISSN 1869-1870.
- ^ Линебергер, В. Карл (1 апреля 2013 г.). «Однажды Анион: Рассказ о фотоотлучении». Ежегодный обзор физической химии. 64 (1): 21–36. Bibcode:2013ARPC ... 64 ... 21л. Дои:10.1146 / annurev-physchem-032511-143753. ISSN 0066-426X.
- ^ Truhlar, Donald G .; Hiberty, Philippe C .; Шайк, Сэсон; Гордон, Марк С .; Данович, Дэвид (2019-09-02). "Орбитали и интерпретация экспериментов по фотоэлектронной спектроскопии и (e, 2e) ионизации". Angewandte Chemie International Edition. 58 (36): 12332–12338. Дои:10.1002 / anie.201904609.


