Хронический миелолейкоз - Chronic myelogenous leukemia
| Хронический миелолейкоз | |
|---|---|
| Другие имена | Хронический миелолейкоз, хронический гранулоцитарный лейкоз (ХГЛ) |
 | |
| В Филадельфийская хромосома как видно флуоресцентная гибридизация in situ (РЫБЫ). | |
| Специальность | Гематология и онкология |
| Частота | 298,000 (2015)[1] |
| Летальные исходы | 32,200 (2015)[2] |
Хронический миелолейкоз (CML), также известный как хронический миелоидный лейкоз, это рак белые кровяные клетки. Это форма лейкемия характеризуется повышенным и нерегулируемым ростом миелоидный ячейки в Костный мозг и накопление этих клеток в крови. ХМЛ - это клональный костный мозг стволовая клетка расстройство, при котором происходит увеличение зрелых гранулоциты (нейтрофилы, эозинофилы и базофилы ) и их предшественников. Это тип миелопролиферативное новообразование связанный с характеристикой хромосомная транслокация называется Филадельфийская хромосома.
ХМЛ в основном лечат с помощью таргетных препаратов, называемых ингибиторы тирозинкиназы (TKI), которые привели к значительному повышению показателей долгосрочной выживаемости с 2001 года. Эти препараты произвели революцию в лечении этого заболевания и позволяют большинству пациентов иметь хорошее качество жизни по сравнению с предыдущими химиотерапевтическими препаратами. В западных странах на ХМЛ приходится 15-25% всех лейкозов у взрослых и 14% лейкозов в целом (включая педиатрическое население, где ХМЛ встречается реже).[3]
Признаки и симптомы
То, как проявляется ХМЛ, зависит от стадии заболевания на момент постановки диагноза, так как известно, что в некоторых случаях он пропускает стадии.[4]
У большинства пациентов (~ 90%) диагноз ставится на хронической стадии, которая чаще всего протекает бессимптомно. В этих случаях случайно может быть диагностировано повышенное лейкоцит рассчитывайте на рутинный лабораторный анализ. Он также может проявляться симптомами, указывающими на: гепатоспленомегалия и возникающая в результате боль в верхнем квадранте. Увеличенный селезенка может оказывать давление на желудок, вызывая потерю аппетита и, как следствие, потерю веса. Он также может проявляться легкой лихорадкой и ночным потоотделением из-за повышенного базального уровня метаболизма.[4]
Некоторые (<10%) диагностируются во время ускоренной стадии, которая чаще всего проявляется кровотечением, петехии и экхимоз.[4] У этих пациентов лихорадка чаще всего является результатом оппортунистических инфекций.[4]
Некоторым пациентам первоначально ставят диагноз в фазе бласта, при которой наиболее вероятными симптомами являются лихорадка, боль в костях и увеличение фиброза костного мозга.[4]
Причина
В большинстве случаев очевидную причину ХМЛ выделить невозможно.[5]
Факторы риска
ХМЛ чаще встречается у мужчин, чем у женщин (соотношение мужчин и женщин 1,4: 1), и чаще возникает у пожилых людей со средним возрастом при постановке диагноза 65 лет.[5] Воздействие ионизирующей радиации, по-видимому, является фактором риска, поскольку заболеваемость ХМЛ среди выживших после ядерных бомбардировок в Хиросиме и Нагасаки в 50 раз выше.[5] Частота ХМЛ у этих людей достигает пика примерно через 10 лет после заражения.[5]
Патофизиология

ХМЛ был первым раком, который был связан с явной генетической аномалией, хромосомная транслокация известный как Филадельфийская хромосома. Эта хромосомная аномалия названа так потому, что она была впервые обнаружена и описана в 1960 году двумя учеными из Филадельфия, Пенсильвания, США: Питер Новелл из Пенсильванский университет и Дэвид Хангерфорд из Онкологический центр Fox Chase.[6]
В этой транслокации части двух хромосом (9-я и 22-я) меняются местами. В результате часть BCR ("область кластера точки останова") ген из хромосомы 22 слит с ABL ген на хромосоме 9. Это ненормальное «слияние» генерирует белок с массой p210 или иногда p185 (p210 является сокращением от 210 кДа белок, сокращение, используемое для характеристики белков, основанных исключительно на размере). Поскольку abl содержит домен, который может добавлять фосфат группы к остаткам тирозина (a тирозинкиназа ), bcr-abl Продукт гена слияния также является тирозинкиназой.[7][8]

Слитый белок BCR-ABL взаимодействует с рецептор интерлейкина 3бета (с) субъединица. Транскрипт BCR-ABL постоянно активен и не требует активации другими клеточными белками обмена сообщениями. В свою очередь, BCR-ABL активирует каскад белков, контролирующих клеточный цикл, ускоряя деление клеток. Кроме того, белок BCR-ABL ингибирует Ремонт ДНК, вызывая нестабильность генома и делая клетку более восприимчивой к развитию дальнейших генетических аномалий. Действие белка BCR-ABL является патофизиологической причиной хронического миелолейкоза. С улучшенным пониманием природы белка BCR-ABL и его действия как тирозинкиназы, таргетная терапия (первый из которых был иматиниб ), которые специфически ингибируют активность белка BCR-ABL. Эти ингибиторы тирозинкиназы могут вызывать полную ремиссию при ХМЛ, подтверждая центральную важность bcr-abl как причины ХМЛ.[8]
Диагностика

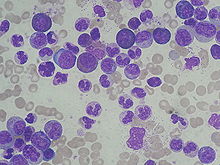

ХМЛ часто подозревают на основании полный анализ крови, что показывает повышенный гранулоциты всех типов, включая зрелые миелоидные клетки. Базофилы и эозинофилы почти повсеместно увеличены; эта функция может помочь отличить CML от лейкемоидная реакция. А биопсия костного мозга часто выполняется как часть оценки на ХМЛ, и ХМЛ диагностируется цитогенетикой, которая обнаруживает транслокацию t (9; 22) (q34; q11.2), которая включает ген ABL1 в хромосоме 9 и ген BCR в хромосоме 22.[9] В результате этой транслокации хромосома выглядит меньше, чем ее хромосома-гомолог, и этот вид известен как филадельфийская хромосома. хромосомная аномалия. Таким образом, это нарушение может быть обнаружено обычным цитогенетика, а вовлеченные гены BCR-ABL1 могут быть обнаружены с помощью флуоресцентная гибридизация in situ, а также ПЦР.[10]
Споры существуют по поводу так называемых Ph-отрицательный ХМЛ или случаи подозрения на ХМЛ, при которых невозможно определить филадельфийскую хромосому. Многие такие пациенты на самом деле имеют сложные хромосомные аномалии, которые маскируют транслокацию (9; 22), или имеют доказательства транслокации посредством РЫБЫ или же ОТ-ПЦР несмотря на обычное рутинное кариотипирование.[11] Небольшую группу пациентов без обнаруживаемых молекулярных свидетельств слияния BCR-ABL1 лучше классифицировать как недифференцированных. миелодиспластическое / миелопролиферативное заболевание, так как их клиническое течение обычно отличается от пациентов с ХМЛ.[12]
ХМЛ следует отличать от лейкемоидная реакция, который может иметь похожий вид на мазок крови.[10]
Классификация
ХМЛ часто делят на три фазы на основании клинических характеристик и лабораторных данных. При отсутствии вмешательства ХМЛ обычно начинается в хронический фазе, и в течение нескольких лет переходит в ускоренный фазе и в конечном итоге взрывной кризис. Взрывной криз является терминальной фазой ХМЛ и клинически ведет себя как острый лейкоз. Медикаментозное лечение обычно останавливает это прогрессирование, если его начать рано. Одной из движущих сил перехода от хронической фазы к ускорению и взрывному кризису является приобретение новых хромосомных аномалий (в дополнение к филадельфийской хромосоме).[7] Некоторые пациенты к моменту постановки диагноза могут уже находиться в ускоренной фазе или бластном кризе.[10]
Хроническая фаза
Приблизительно 85% пациентов с ХМЛ на момент постановки диагноза находятся в хронической фазе. Во время этой фазы у пациентов обычно отсутствуют симптомы или наблюдаются лишь легкие симптомы усталости, боли в левом боку, суставов и / или бедер или полноты в животе. Продолжительность хронической фазы варьируется и зависит от того, как рано было диагностировано заболевание, а также от используемых методов лечения. При отсутствии лечения заболевание переходит в ускоренную фазу.[10] Точное определение стадии пациента на основе клинических маркеров и личного геномного профиля, вероятно, окажется полезным при оценке истории болезни с точки зрения риска прогрессирования.[13]
Ускоренная фаза
Критерии диагностики перехода в ускоренную фазу несколько изменчивы; наиболее широко используются критерии, предложенные исследователями Онкологический центр доктора медицины Андерсона,[14] Сокалом и др.,[15] и Всемирная организация здоровья.[12][16] Критерии ВОЗ[17] пожалуй, наиболее широко используются и определяют ускоренную фазу по наличию ≥1 из следующих гематологических / цитогенетических критериев или предварительных критериев, касающихся ответа на терапию ингибитором тирозинкиназы (TKI)
- Гематологические / цитогенетические критерии
- Постоянно или повышается высокое количество лейкоцитов (> 10 × 109/ L), не реагирует на терапию
- Стойкая или нарастающая спленомегалия, не поддающаяся лечению
- Стойкий тромбоцитоз (> 1000 × 109/ L), не реагирует на терапию
- Стойкая тромбоцитопения (<100 × 109/ Л), не связанные с терапией
- ≥ 20% базофилов в периферической крови
- 10-19% бластов в периферической крови и / или костном мозге
- Дополнительные клональные хромосомные аномалии в филадельфийских (Ph) хромосомно-положительных (Ph +) клетках на момент постановки диагноза, включая так называемые аномалии основного пути (вторая хромосома Ph, трисомия 8, изохромосома 17q, трисомия 19), сложный кариотип и аномалии 3q26. 2
- Любая новая клональная хромосомная аномалия в Ph + -клетках, возникающая во время терапии.
- Предварительный ответ на критерии TKI
- Гематологическая резистентность (или невозможность достижения полного гематологического ответа d) к первому TKI
- Любые гематологические, цитогенетические или молекулярные признаки устойчивости к двум последовательным TKI.
- Возникновение двух или более мутаций в гене слияния BCR-ABL1 во время терапии TKI
Считается, что пациент находится в ускоренной фазе, если присутствует что-либо из вышеперечисленного. Ускоренная фаза важна, потому что она сигнализирует о прогрессировании болезни и неизбежной трансформации во взрывной кризис. На поздних стадиях медикаментозное лечение часто становится менее эффективным.[12]
Взрывной кризис
Взрывной кризис является заключительной фазой в эволюции ХМЛ и ведет себя как острый лейкоз, с быстрым прогрессированием и короткой выживаемостью.[10] Бластный криз диагностируется при наличии любого из следующих признаков у пациента с ХМЛ:[18]
- > 20% бластов в крови или костном мозге
- Наличие экстрамедуллярного разрастания бластов
Уход
Единственное лечебное средство от ХМЛ - это трансплантация костного мозга или трансплантация аллогенных стволовых клеток.[19] Помимо этого, существует четыре основных метода лечения ХМЛ: лечение ингибиторами тирозинкиназы, миелосупрессивными или лейкоферез терапия (для противодействия лейкоцитоз во время раннего лечения), спленэктомия и интерферон альфа-2b лечение.[19] Из-за высокого среднего возраста пациенток с ХМЛ ХМЛ относительно редко выявляется у беременных, несмотря на это, однако, хронический миелолейкоз можно лечить с относительной безопасностью в любое время во время беременности с помощью Интерферон-альфа гормоны.[20]
Хроническая фаза
В прошлом антиметаболиты (например, цитарабин, гидроксимочевина ), алкилирующие агенты, интерферон альфа 2b, и стероиды использовались для лечения ХМЛ в хронической фазе, но с 2000-х годов были заменены Ингибиторы тирозинкиназы Bcr-Abl[21] препараты, которые специфически нацелены на BCR-ABL, конститутивно активированный гибридный белок тирозинкиназы, вызванный Филадельфийская хромосома транслокация. Несмотря на переход к замене цитотоксических противоопухолевых препаратов (стандартные противоопухолевые препараты) ингибиторами тирозинкиназы, иногда гидроксимочевина все еще используется для противодействия высокое количество лейкоцитов встречается во время лечения ингибиторами тирозинкиназы, такими как иматиниб; в этих ситуациях он может быть предпочтительным миелосупрессивным средством из-за его относительного отсутствия лейкемогенных эффектов и, следовательно, относительного отсутствия возможности возникновения вторичных гематологических злокачественных новообразований в результате лечения.[22] IRIS, международное исследование, в котором сравнивали комбинацию интерферон / цитарабин и первый из этих новых препаратов иматиниб, с долгосрочным наблюдением, продемонстрировало явное превосходство целевого ингибирования тирозинкиназы над существующими методами лечения.[23]
Иматиниб
Первым из этого нового класса препаратов был мезилат иматиниба (продается как Gleevec или Glivec), одобрено США Управление по контролю за продуктами и лекарствами (FDA) в 2001 году. Было обнаружено, что иматиниб подавляет прогрессирование ХМЛ у большинства пациентов (65–75%) в достаточной степени, чтобы добиться возобновления роста их нормальной популяции стволовых клеток костного мозга (цитогенетический ответ) со стабильными пропорциями созревающих лейкоцитов. клетки. Поскольку некоторые лейкозные клетки (по оценке ОТ-ПЦР ) сохраняются почти у всех пациентов, лечение необходимо продолжать бесконечно. С момента появления иматиниба ХМЛ стал первым раком, при котором стандартное лечение может дать пациенту нормальную продолжительность жизни.[24]
Дазатиниб, нилотиниб, радотиниб и босутиниб
Чтобы преодолеть резистентность к иматинибу и повысить чувствительность к ингибиторам ТК, позже были разработаны четыре новых агента. Первый, дазатиниб, блокирует еще несколько онкогенных белков в дополнение к более сильному ингибированию белка BCR-ABL и был первоначально одобрен в 2007 г. FDA США для лечения ХМЛ у пациентов, которые были либо устойчивы к иматинибу, либо не переносили его. Второй новый ингибитор ТК, нилотиниб, также был одобрен FDA для тех же показаний. В 2010 г. нилотиниб и дазатиниб были также одобрены для терапии первой линии, что сделало три препарата этого класса доступными для лечения впервые выявленного ХМЛ. В 2012, Радотиниб присоединился к классу новых агентов в ингибировании белка BCR-ABL и был одобрен в Южной Корее для пациентов, резистентных к иматинибу или нетерпимых к нему. Босутиниб получил одобрение FDA США и Европейского агентства по лекарственным средствам 4 сентября 2012 г. и 27 марта 2013 г. соответственно для лечения взрослых пациентов с филадельфийской хромосомно-положительной (Ph +) хронической миелогенной лейкемией (ХМЛ) с устойчивостью или непереносимостью предшествующей терапии.
Устойчивый к лечению ХМЛ
Хотя дазатиниб и нилотиниб способны вызывать значительно улучшенные ответы по сравнению с действием иматиниба, ни дазатиниб, ни нилотиниб не могут преодолеть лекарственную устойчивость, вызванную одной конкретной мутацией, обнаруженной в структуре BCR-ABL1, известной как мутация T315I (другими словами, где 315-я аминокислота мутирована из треонин остаток изолейцин остаток). В результате были разработаны два подхода к лечению ХМЛ:
В 2007, Chemgenex опубликовал результаты открытого исследования фазы 2/3 (CGX-635-CML-202), в котором изучалось использование целевого агента, не связанного с BCR-ABL омацетаксин, вводимый подкожно (под кожей) пациентам, у которых иматиниб не помог, и у которых обнаружена мутация домена киназы T315I.[25][26] Это исследование продолжается до 2014 года.[27] В сентябре 2012 года FDA одобрило омацетаксин для лечения ХМЛ в случае устойчивости к другим химиотерапевтическим средствам.[28][29]
Независимо от этого, фармацевтические препараты ARIAD, адаптировавшие химические структуры ингибиторов TK первого и второго поколения, разработали новый ингибитор pan-BCR-ABL1, который показал (впервые) эффективность против T315I, а также всех других известных мутаций онкопротеина. . Наркотик, понатиниб, получил одобрение FDA в декабре 2012 года для лечения пациентов с резистентным или непереносимым ХМЛ. Так же, как и в случае с ингибиторами ТЗ второго поколения, ранние попытки получить одобрение на распространение понатиниба также на недавно диагностированный ХМЛ.[нужна цитата ]
Вакцинация
В 2005 г. обнадеживающие, но неоднозначные результаты вакцинация сообщалось с BCR / ABL1 слитый белок p210 у пациентов со стабильным заболеванием, с GM-CSF в качестве адъюванта.[30]
Прогноз
До появления ингибиторов тирозинкиназы среднее время выживания пациентов с ХМЛ составляло около 3-5 лет с момента постановки диагноза.[3]
При использовании ингибиторов тирозинкиназы выживаемость резко улучшилась. Последующее наблюдение в 2006 году за 553 пациентами, принимавшими иматиниб (гливек), показало, что общая выживаемость через пять лет составила 89%.[31]
Последующее наблюдение в 2011 году за 832 пациентами, принимавшими иматиниб, которые достигли стабильного цитогенетического ответа, показало, что общая выживаемость через 8 лет составила 95,2%, что аналогично показателю в общей популяции. Менее 1% пациентов умерли из-за прогрессирования лейкемии.[24]
Эпидемиология
объединенное Королевство
ХМЛ составляет 8% всех лейкозов в Великобритании, и в 2011 году это заболевание было диагностировано около 680 человек.[32]
Соединенные Штаты
По оценкам Американского онкологического общества, в 2014 году было диагностировано около 5980 новых случаев хронического миелоидного лейкоза, и около 810 человек умерли от этого заболевания. Это означает, что чуть более 10% всех вновь диагностированных случаев лейкемии будет хроническим миелоидным лейкозом. Средний риск заражения этим заболеванием составляет 1 к 588. Заболевание чаще встречается у мужчин, чем у женщин, и чаще встречается у белых, чем у афроамериканцев. Средний возраст постановки диагноза - 64 года, и это заболевание редко встречается у детей.[33]
Рекомендации
- ^ Вос Т., Аллен С., Арора М., Барбер Р.М., Бхутта З.А., Браун А. и др. (Соавторы исследования ГББ 2015 по заболеваемости и распространенности заболеваний и травм) (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и годы, прожитые с инвалидностью для 310 заболеваний и травм, 1990–2015 годы: систематический анализ для исследования глобального бремени болезней 2015». Ланцет. 388 (10053): 1545–1602. Дои:10.1016 / S0140-6736 (16) 31678-6. ЧВК 5055577. PMID 27733282.
- ^ Ван Х., Нагави М., Аллен С., Барбер Р.М., Бхутта З.А., Картер А. и др. (ГББ 2015 г. Смертность и причины смерти соавторов) (октябрь 2016 г.). «Ожидаемая продолжительность жизни на глобальном, региональном и национальном уровнях, смертность от всех причин и смертность от конкретных причин для 249 причин смерти, 1980–2015 годы: систематический анализ для исследования глобального бремени болезней 2015 года». Ланцет. 388 (10053): 1459–1544. Дои:10.1016 / с0140-6736 (16) 31012-1. ЧВК 5388903. PMID 27733281.
- ^ а б Besa EC, Бюлер Б., Маркман М., Захер Р.А. (27 декабря 2013 г.). Кришнан К. (ред.). «Хронический миелолейкоз». Ссылка на Medscape. WebMD. Получено 3 января 2014.
- ^ а б c d е Besa EC, Buehler B, Markman M, Sacher RA (27 декабря 2013 г.). Кришнан К. (ред.). «Клиническая картина хронического миелолейкоза». Ссылка на Medscape. WebMD. Получено 3 января 2014.
- ^ а б c d Прован Д., Гриббен Дж. Г. (2010). «Глава 7 Хронический миелолейкоз». Молекулярная гематология (3-е изд.). Сингапур: Вили-Блэквелл. п. 76. ISBN 9781444318548.
- ^ Nowell PC (август 2007 г.). «Открытие филадельфийской хромосомы: личная перспектива». Журнал клинических исследований. 117 (8): 2033–5. Дои:10.1172 / JCI31771. ЧВК 1934591. PMID 17671636.
- ^ а б Фадерл С., Талпаз М., Эстров З., Кантарджян Х.М. (август 1999 г.). «Хронический миелолейкоз: биология и терапия». Анналы внутренней медицины. 131 (3): 207–19. Дои:10.7326/0003-4819-131-3-199908030-00008. PMID 10428738. S2CID 46260906.
- ^ а б Hehlmann R, Hochhaus A, Baccarani M (июль 2007 г.). «Хронический миелоидный лейкоз». Ланцет. 370 (9584): 342–50. Дои:10.1016 / S0140-6736 (07) 61165-9. PMID 17662883. S2CID 1420863.
- ^ Роули Дж. Д. (июнь 2013 г.). «Генетика. История обмена концами». Наука. 340 (6139): 1412–3. Bibcode:2013Научный ... 340.1412R. Дои:10.1126 / science.1241318. PMID 23788787. S2CID 206550237.
- ^ а б c d е Теффери А (2006). «Классификация, диагностика и лечение миелопролиферативных заболеваний в эпоху JAK2V617F». Гематология. Американское общество гематологии. Образовательная программа. 2006: 240–5. Дои:10.1182 / asheducation-2006.1.240. PMID 17124067.
- ^ Savage DG, Szydlo RM, Goldman JM (январь 1997 г.). «Клинические особенности при постановке диагноза у 430 пациентов с хроническим миелоидным лейкозом, наблюдаемых в специализированном центре в течение 16 лет». Британский журнал гематологии. 96 (1): 111–6. Дои:10.1046 / j.1365-2141.1997.d01-1982.x. PMID 9012696. S2CID 41243342.
- ^ а б c Теффери А., Тиле Дж., Орази А., Квасницка Х.М., Барбуи Т., Хансон К.А. и др. (Август 2007 г.). «Предложения и обоснование пересмотра диагностических критериев Всемирной организации здравоохранения для истинной полицитемии, эссенциальной тромбоцитемии и первичного миелофиброза: рекомендации специальной международной группы экспертов». Кровь. 110 (4): 1092–7. Дои:10.1182 / кровь-2007-04-083501. PMID 17488875. S2CID 7086172.
- ^ Brehme M, Koschmieder S, Montazeri M, Copland M, Oehler VG, Radich JP и др. (Апрель 2016 г.). «Комбинированная популяционная динамика и моделирование энтропии поддерживает стратификацию пациентов с хроническим миелоидным лейкозом». Научные отчеты. 6: 24057. Bibcode:2016НатСР ... 624057Б. Дои:10.1038 / srep24057. ЧВК 4822142. PMID 27048866.
- ^ Kantarjian HM, Dixon D, Keating MJ, Talpaz M, Walters RS, McCredie KB, Freireich EJ (апрель 1988 г.). «Характеристики обострения болезни при хроническом миелолейкозе». Рак. 61 (7): 1441–6. Дои:10.1002 / 1097-0142 (19880401) 61: 7 <1441 :: AID-CNCR2820610727> 3.0.CO; 2-C. PMID 3162181.
- ^ Сокал Дж. Э., Баккарани М., Руссо Д., Тура С. (январь 1988 г.). «Стадия и прогноз хронического миелолейкоза». Семинары по гематологии. 25 (1): 49–61. PMID 3279515.
- ^ Вардиман Дж. У., Харрис Н. Л., Брунинг Р. Д. (октябрь 2002 г.). «Классификация миелоидных новообразований Всемирной организации здравоохранения (ВОЗ)». Кровь. 100 (7): 2292–302. Дои:10.1182 / кровь-2002-04-1199. PMID 12239137. S2CID 9413654.
- ^ Арбер Д.А., Орази А., Хассерджян Р., Тиле Дж., Боровиц М.Дж., Ле Бо М.М. и др. (Май 2016). «Пересмотр в 2016 г. классификации миелоидных новообразований и острого лейкоза Всемирной организации здравоохранения». Кровь. 127 (20): 2391–405. Дои:10.1182 / кровь-2016-03-643544. PMID 27069254. S2CID 18338178.
- ^ Карбасиан Исфахани М., Моррис Э.Л., Датчер Дж. П., Верник PH (май 2006 г.). «Бластная фаза хронического миелолейкоза». Современные варианты лечения в онкологии. 7 (3): 189–99. Дои:10.1007 / s11864-006-0012-у. PMID 16615875. S2CID 21092684.
- ^ а б Besa EC, Buehler B, Markman M, Sacher RA (27 декабря 2013 г.). Кришнан К. (ред.). «Лечение и лечение хронического миелолейкоза». Ссылка на Medscape. WebMD. Получено 4 января 2014.
- ^ Шапира Т., Перег Д., Лишнер М. (сентябрь 2008 г.). «Как лечить острый и хронический лейкоз при беременности». Отзывы о крови. 22 (5): 247–59. Дои:10.1016 / j.blre.2008.03.006. PMID 18472198.
- ^ Kufe DW; Pollack RE; Weichselbaum RR; и др., ред. (2003). «Ингибиторы тирозинкиназы: соображения адресности». Holland-Frei Cancer Medicine (Книжная полка NCBI книга) (6-е изд.). Гамильтон, Онтарио: ДО Н.Э. Декер. ISBN 978-1-55009-213-4. Получено 27 октября, 2012.
- ^ Besa EC, Buehler B, Markman M, Sacher RA (27 декабря 2013 г.). Кришнан К. (ред.). «Хронический миелолейкоз». Ссылка на Medscape. WebMD. Получено 3 января 2014.
- ^ DeAngelo DJ, Ritz J (январь 2004 г.). «Терапия иматинибом для пациентов с хроническим миелолейкозом: живут ли пациенты дольше?» (PDF). Клинические исследования рака. 10 (1 Пет 1): 1–3. Дои:10.1158 / 1078-0432.CCR-1218-3. PMID 14734443. S2CID 1761631.
- ^ а б Gambacorti-Passerini C, Antolini L, Mahon FX, Guilhot F, Deininger M, Fava C и др. (Апрель 2011 г.). «Многоцентровая независимая оценка результатов лечения пациентов с хроническим миелолейкозом иматинибом». Журнал Национального института рака. 103 (7): 553–61. Дои:10.1093 / jnci / djr060. PMID 21422402.
- ^ Джаббур Э., Кортес Дж. Э., Джайлс Ф. Дж., О'Брайен С., Кантарджиан Х. М. (июнь 2007 г.). «Текущие и новые варианты лечения хронического миелоидного лейкоза». Рак. 109 (11): 2171–81. CiteSeerX 10.1.1.605.7683. Дои:10.1002 / cncr.22661. PMID 17431887. S2CID 46509746.
- ^ Кимура С., Ашихара Е., Маекава Т. (октябрь 2006 г.). «Новые ингибиторы тирозинкиназы в лечении хронического миелоидного лейкоза». Текущая фармацевтическая биотехнология. 7 (5): 371–9. Дои:10.2174/138920106778521532. PMID 17076652.
- ^ «Гомохаррингтонин (омацетаксина мепесукцинат) в лечении пациентов с хроническим миелоидным лейкозом (ХМЛ) с мутацией гена T315I BCR-ABL». ClinicalTrial.gov (запись в базе данных). Получено 27 октября, 2012.
- ^ «FDA одобрило Synribo для лечения хронического миелолейкоза» (Пресс-релиз). нас Управление по контролю за продуктами и лекарствами. 26 октября 2012 г.. Получено 27 октября, 2012.
- ^ «FDA одобрило новый орфанный препарат от хронического миелолейкоза» (Пресс-релиз). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 4 сентября 2012 г.. Получено 27 октября, 2012.
- ^ Bocchia M, Gentili S, Abruzzese E, Fanelli A, Iuliano F, Tabilio A и др. (2005). «Эффект мультипептидной вакцины p210, связанной с иматинибом или интерфероном, у пациентов с хроническим миелоидным лейкозом и стойким остаточным заболеванием: многоцентровое обсервационное исследование» (PDF). Ланцет. 365 (9460): 657–62. Дои:10.1016 / S0140-6736 (05) 17945-8. HDL:2108/41872. PMID 15721470. S2CID 26816784.
- ^ Друкер Б.Дж., Гилхот Ф., О'Брайен С.Г., Гатманн И., Кантарджиан Х., Гаттерманн Н. и др. (Декабрь 2006 г.). «Пятилетнее наблюдение за пациентами, получающими иматиниб по поводу хронического миелоидного лейкоза». Медицинский журнал Новой Англии. 355 (23): 2408–17. Дои:10.1056 / NEJMoa062867. PMID 17151364. S2CID 21772851.
- ^ «Статистика хронического миелоидного лейкоза (ХМЛ)». Cancer Research UK. Получено 28 октября 2014.
- ^ «Каковы основные статистические данные о хроническом миелоидном лейкозе?». Cancer.org. Американское онкологическое общество. Получено 6 января 2015.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |
- Хронический миелоидный лейкоз в Американское онкологическое общество
- Информация о CML от Общества лейкемии и лимфомы
- Хронический миелоцитарный лейкоз (ХМЛ) в Руководство по диагностике и терапии Merck Домашняя версия
