Дикобальт октакарбонил - Dicobalt octacarbonyl
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Октакарбонилдикобальт (Co — Co) | |
| Другие имена Карбонил кобальта, диму-карбонилгексакарбонилдикобальт, октакарбонил кобальта, димер тетракарбонила кобальта, карбонил дикобальта, октакарбонилдикобальт | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.030.454 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 3281 |
| |
| |
| Характеристики | |
| Co2(CO)8 | |
| Молярная масса | 341,95 г / моль |
| Внешность | красно-оранжевые кристаллы белое кристаллическое твердое вещество в чистом виде[1] |
| Плотность | 1,87 г / см3 |
| Температура плавления | От 51 до 52 ° C (от 124 до 126 ° F, от 324 до 325 K) |
| Точка кипения | 52 ° С (126 ° F, 325 К) ок. разлагается |
| нерастворимый | |
| Давление газа | 0,7 мм рт. Ст. (20 ° C)[1] |
| Структура | |
| 1.33 D (C2v изомер) 0 D (D3D изомер) | |
| Опасности | |
| Главный опасности | Очень токсичен, при разложении выделяет газообразный CO,[1] пирофорный, канцерогенный |
| Паспорт безопасности | Внешний паспорт безопасности материалов |
| Пиктограммы GHS |     |
| Сигнальное слово GHS | Опасность |
| H228, H251, H302, H312, H315, H317, H319, H330, H334, H350, H351, H361, H412 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Пирофорный [1] |
| NIOSH (Пределы воздействия на здоровье в США): | |
PEL (Допустимо) | никто[1] |
REL (Рекомендуемые) | TWA 0,1 мг / м3[1] |
IDLH (Непосредственная опасность) | N.D.[1] |
| Родственные соединения | |
Родственные карбонилы металлов | Пентакарбонил железа Дийрон нонакарбонил Тетракарбонил никеля |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Дикобальт октакарбонил это металлоорганическое соединение с составом Co2(CO)8. Этот карбонил металла используется как реагент и катализатор в металлоорганическая химия и органический синтез, и занимает центральное место в широко известных органокобальтовая химия.[2][3] Это предшественник гидроформилирование катализатор тетракарбонилгидрид кобальта.[4] Каждый молекула состоит из двух кобальт атомы, связанные с восемью монооксид углерода лиганды, хотя известно несколько различных структурных схем.[5] Некоторые карбонильные лиганды обладают высокой лабильный. Состав очень реактивен по отношению к алкины, и иногда используется как алкин защитная группа. Как кобальт-алкиновый комплекс, он играет роль в продвижении как Николай реакция[3][6][7] и Реакция Паусона-Ханда.[3][8][9]
Синтез, строение, свойства
Дикобальт октакарбонил представляет собой белое твердое вещество высокой степени чистоты, но чаще имеет оранжевый цвет, пирофорный твердое, термически нестабильное.[1] Он синтезируется высоким давлением карбонилирование кобальта (II) соли. В методе, запатентованном Джеймсом Эли Кнапом, ацетат кобальта (II) нагревается от 150 до 200 ° C и подвергается воздействию водород и монооксид углерода газы при давлении от 2000 до 6000psi:[10]
- 2 Co (CH3CO2)2 + 8 СО + 2 ч2 → Co2(CO)8 + 4 канала3COOH
Препарат часто проводят при наличии цианид, превращая соль кобальта (II) в комплекс гексацианокобальтата (II), который затем обрабатывают монооксидом углерода с получением K [Co (CO)4]. Подкисление производит тетракарбонилгидрид кобальта, HCo (CO)4, который затем может быть нагрет до октакарбонила дикобальта.[3][11] Его также можно получить, нагревая металлический кобальт до температуры выше 250 ° C в потоке монооксид углерода газ примерно от 200 до 300банкомат:[3]
- 2 Co + 8 CO → Co2(CO)8
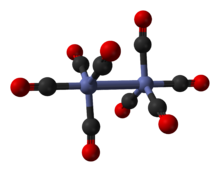
Известно, что он существует в нескольких изомерный формы, все с одинаковым составом - [Co2(CO)8] - с двумя металлическими центрами кобальта в степень окисления ноль в окружении восьми карбонилов (CO) лиганды. Эти лиганды могут быть мосты между двумя центрами кобальта или связаны с одним металлическим центром ( терминальный лиганд ).[2][3] В растворе известны два изомера, которые быстро взаимопревращаются:[5]
Главный изомер (слева на приведенном выше рисунке) равновесие process) содержит два мостиковых карбонильных лиганда, связывающих центры кобальта, и шесть концевых карбонильных лигандов, по три на каждый металл.[5] Его можно резюмировать формулой (CO)3Co (μ-CO)2Co (CO)3 и имеет C2v симметрия. Эта структура напоминает диирон нонакарбонил (Fe2(CO)9), но с одним мостиковым карбонилом меньше. Расстояние Co – Co составляет 2,52 Å, а расстояние Co – COТерминал и Co – COмост расстояния составляют 1,80 и 1,90 Å соответственно.[12] Анализ связи предполагает отсутствие прямой связи кобальт-кобальт.[13]
Минорный изомер не имеет мостиковых карбонильных лигандов, но вместо этого имеет прямую связь между центрами кобальта и восемью концевыми карбонильными лигандами, по четыре на каждый атом металла.[5] Это можно описать формулой (CO)4Co-Co (CO)4 и имеет D4d симметрия. Он имеет немостиковую связь кобальт-кобальт, длина которой составляет 2,70 Å в твердой структуре при кристаллизации вместе с C60.[14]
Реакции
Николай реакция
В Николай реакция это реакция замещения при этом алкоксигруппа, расположенная на α-углероде алкин заменяется другим нуклеофил.[6][7] Алкин сначала вступает в реакцию с октакарбонилом дикобальта, из которого образуется стабилизированный пропаргиловый катион[15][16] который вступает в реакцию с поступающим нуклеофилом, и продукт затем образуется окислительная деметалляция.[6][7]

Реакция Паусона-Ханда
В Реакция Паусона-Ханда,[8] в котором алкин, алкен и оксид углерода циклизуются с образованием циклопентенон, может катализироваться Co2(CO)8,[3][9] хотя с тех пор были разработаны новые, более эффективные методы:[17][18]

Co2(CO)8 реагирует с алкины с образованием стабильного ковалентного комплекса, который полезен в качестве защитная группа для алкина. Сам этот комплекс также может быть использован в реакции Паусона – Ханда.[8]
Возможны внутримолекулярные реакции Паусона – Ханда, в которых исходный материал содержит как алкеновые, так и алкиновые фрагменты. в асимметричный синтез из Lycopodium алкалоид huperzine-Q, Такаяма и соавторы использовали внутримолекулярную реакцию Паусона-Кханда для циклизации Enyne содержащий терт-бутилдифенилсилил (TBDPS) защищенный первичный спирт.[19] Получение циклического силоксанового фрагмента непосредственно перед введением октакарбонила дикобальта обеспечивает получение продукта с желаемым конформация.[20]


Шаг 1: Диссоциация монооксид углерода из тетракарбонилгидрид кобальта формировать HCo (CO)3, активные каталитические частицы
Шаг 2: Центр кобальта образует π связь к алкену
Шаг 3: Алкеновый лиганд вставляется в кобальт-гидридную связь
Шаг 4: Координация дополнительного карбонильного лиганда.
Шаг 5: Миграционная вставка карбонильного лиганда в кобальт-алкильную связь, превращая алкилтетракарбонильный промежуточный продукт в ацилтрикарбонильную разновидность[21]
Шаг 6: Окислительное добавление из дигидроген приводит к дигидридо комплексу
Шаг 7: Альдегидный продукт, выпускаемый восстановительное устранение,[22] регенерация активных каталитических частиц
Шаг 8: Непродуктивный и обратимый побочная реакция
Гидроформилирование
Гидрирование Ко2(CO)8 производит тетракарбонилгидрид кобальта, [HCo (CO)4]:[23]
- Co2(CO)8 + H2 → 2 HCo (CO)4
Этот гидрид используется как катализатор за гидроформилирование - преобразование терминала алкен, RCH = CH2, чтобы альдегид, RCH2CH2СНО.[4][23] В каталитический цикл для этого гидроформилирования показано на диаграмме.[4][21][22]
Снижение Co2(CO)8 с амальгама натрия дает сопряженное основание HCo (CO)4. Этот соль дает гидрид при подкислении, обеспечивая альтернативный путь синтеза для этого вида.[3] Соли этой формы также являются промежуточными продуктами в пути синтеза цианида октакарбонила дикобальта.[11]
- Co2(CO)8 + 2 Na → 2 NaCo (CO)4
- NaCo (CO)4 + H+ → HCo (CO)4 + Na+
Лиганды CO можно заменить третичными фосфин лиганды для образования Co2(CO)8−Икс(PR3)Икс. Эти объемные производные являются более селективными катализаторами реакций гидроформилирования.[3] "Жесткий "Базы Льюиса, например пиридин, причина непропорциональность:
- 12 С5ЧАС5N + 3 Co2(CO)8 → 2 [Co (C5ЧАС5N)6] [Co (CO)4]2 + 8 СО

Трикобальт нонакарбонилы
Нагревание вызывает декарбонилирование и образование тетракобальт додекакарбонил:[3][24]
- 2 Co2(CO)8 → Co4(CO)12 + 4 СО
Как и многие карбонилы металлов, октакарбонил дикобальта отделяет галогениды от алкилгалогенидов. После реакции с бромоформ, он преобразуется в метилидинетрикобальтнонакарбонил, HCCo3(CO)9, реакцией, которую можно идеализировать как:[25]
- 9 Co2(CO)8 + 4 CHBr3 → 4 HCCo3(CO)9 + 36 CO + 6 CoBr2
Рентгеновский кристаллографический Анализ показывает, что продукт содержит треугольник атомов кобальта на расстояниях около 2,48 Å, каждый из которых связан с тремя концевыми карбонильными группами, и с метилидин (CH) группа, образующая вершину треугольной пирамиды. Этот продукт структурно связан с додекакарбонилом тетракобальта,[26] теоретически путем замены метилидиновой группы четвертой Co (CO)3 часть. Однако существует разногласие между теорией и экспериментом с фактической структурой додекакарбонила тетракобальта, которая имеет три мостиковые карбонильные группы.[27][28][29]
Безопасность
Co2(CO)8 летучий источник кобальта (0), является пирофорный и релизы монооксид углерода при разложении.[30] В Национальный институт охраны труда и здоровья имеет рекомендуемые что рабочие не должны подвергаться воздействию концентраций более 0,1 мг / м3 за восемь часов, взвешенных по времени, без надлежащего дыхательного снаряжения.[31]
Рекомендации
- ^ а б c d е ж грамм час Карманный справочник NIOSH по химической опасности. "#0147". Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б Паусон, Питер Л.; Стамбули, Джеймс П .; Чжоу, Дэ-Чанг; Хонг, Бор-Чернг (2014). «Октакарбонилдикобальт». Энциклопедия реагентов для органического синтеза. Джон Уайли и сыновья. Дои:10.1002 / 047084289X.ro001.pub3.
- ^ а б c d е ж грамм час я j Дональдсон, Джон Даллас; Бейерсманн, Детмар (2005). «Соединения кобальта и кобальта». Энциклопедия промышленной химии Ульмана. Wiley-VCH. Дои:10.1002 / 14356007.a07_281.pub2.
- ^ а б c d Elschenbroich, C .; Зальцер, А. (1992). Металлоорганические соединения: краткое введение (2-е изд.). Вайнхайм: Вайли-ВЧ. ISBN 3-527-28165-7.
- ^ а б c d Sweany, Ray L .; Браун, Теодор Л. (1977). «Инфракрасные спектры матрично-изолированного октакарбонила дикобальта. Доказательства наличия третьего изомера». Неорганическая химия. 16 (2): 415–421. Дои:10.1021 / ic50168a037.
- ^ а б c Николас, Кеннет М. (1987). «Химия и синтетическая полезность пропаргильных катионов в комплексе с кобальтом». Соотв. Chem. Res. (Рассмотрение). 20 (6): 207–214. Дои:10.1021 / ar00138a001.
- ^ а б c Теобальд, Барри Дж. (2002). «Реакция Николая: использование пропаргиловых катионов, стабилизированных гексакарбонилом дикобальта, в синтезе». Тетраэдр (Рассмотрение). 58 (21): 4133–4170. Дои:10.1016 / S0040-4020 (02) 00315-0.
- ^ а б c Паусон, П.Л.; Ханд, И. У. (1977). «Использование комплексов кобальт-карбонилацетилен в органическом синтезе». Анна. Акад. Sci. 295 (1): 2–14. Дои:10.1111 / j.1749-6632.1977.tb41819.x.
- ^ а б Бланко-Ургоити, Хайме; Аньорбе, Лорето; Перес-Серрано, Летисия; Домингес, Хема; Перес-Кастельс, Хавьер (2004). «Реакция Паусона-Ханда, мощный синтетический инструмент для синтеза сложных молекул». Chem. Soc. Ред. 33 (1): 32–42. Дои:10.1039 / b300976a.
- ^ Патент США 3236597, Knap, James Eli, "Дикобальт октакарбонил высокой чистоты", выпущенный 22 февраля 1966 г., назначенный Union Carbide Corporation
- ^ а б Орчин, Милтон (1953). «Гидрирование органических соединений синтез-газом». Достижения в катализе. 5. Академическая пресса. С. 385–415. ISBN 9780080565095.
- ^ Самнер, Г. Гарднер; Klug, Harold P .; Александр, Лерой Э. (1964). «Кристаллическая структура октакарбонила дикобальта». Acta Crystallographica. 17 (6): 732–742. Дои:10.1107 / S0365110X64001803.
- ^ Грин, Дженнифер С .; Грин, Малькольм Л. Х.; Паркин, Жерар (2012). «Возникновение и представление трехцентровых двухэлектронных связей в ковалентных неорганических соединениях». Химические коммуникации. 2012 (94): 11481–11503. Дои:10.1039 / c2cc35304k.
- ^ Garcia, Thelma Y .; Феттингер, Джеймс С.; Олмстед, Мэрилин М .; Балч, Алан Л. (2009). «Великолепная симметрия: кристаллизация немостикового изомера Co2(CO)8 в Ко2(CO)8·C60". Химические коммуникации. 2009 (46): 7143–7145. Дои:10.1039 / b915083h.
- ^ Локвуд, Роза Ф .; Николас, Кеннет М. (1977). «Ионы карбения, стабилизированные переходными металлами, как синтетические промежуточные продукты. I. Ионы α - [(алкинил) дикобальта гексакарбонил] карбения в качестве пропаргилирующих агентов». Tetrahedron Lett. 18 (48): 4163–4165. Дои:10.1016 / S0040-4039 (01) 83455-9.
- ^ Николас, К. М .; Петтит Р. (1972). «О стабильности ионов α- (алкинил) дикобальта гексакарбонилкарбония». J. Organomet. Chem. 44 (1): C21 – C24. Дои:10.1016 / 0022-328X (72) 80037-8.
- ^ Шор, Нил Э. (1991). «Реакция циклоприсоединения Паусона – Ханда для синтеза циклопентенонов». Орг. Реагировать. 40: 1. Дои:10.1002 / 0471264180.or040.01.
- ^ Гибсон, Сьюзан Э .; Стивенацци, Андреа (2003). «Реакция Паусона – Ханда: настал каталитический век!». Энгью. Chem. Int. Эд. 42 (16): 1800–1810. Дои:10.1002 / anie.200200547.
- ^ Накаяма, Ацуши; Когуре, Нориюки; Китадзима, Марико; Такаяма, Хиромицу (2011). «Асимметричный полный синтез пентациклического Lycopodium Алкалоид: Гуперзин-Q ». Энгью. Chem. Int. Эд. 50 (35): 8025–8028. Дои:10.1002 / anie.201103550.
- ^ Хо, Це-Лок (2016). «Дикобальт октакарбонил». Реагенты Физера для органического синтеза. 28. Джон Уайли и сыновья. С. 251–252. ISBN 9781118942819.
- ^ а б Черт возьми, Ричард Ф.; Бреслоу, Дэвид С. (1961). «Реакция гидротетракарбонила кобальта с олефинами». Журнал Американского химического общества. 83 (19): 4023–4027. Дои:10.1021 / ja01480a017.
- ^ а б Халперн, Джек (2001). «Металлоорганическая химия на пороге нового тысячелетия. Ретроспектива и перспективы». Чистая и прикладная химия. 73 (2): 209–220. Дои:10.1351 / pac200173020209.
- ^ а б Pfeffer, M .; Греллье, М. (2007). «Металлоорганические соединения кобальта». Комплексная металлоорганическая химия III. 7. Эльзевир. С. 1–119. Дои:10.1016 / B0-08-045047-4 / 00096-0.
- ^ Чини, П. (1968). «Замкнутые карбонильные кластеры металлов». Inorganica Chimica Acta: отзывы. 2: 31–51. Дои:10.1016/0073-8085(68)80013-0.
- ^ Nestle, Mara O .; Hallgren, John E .; Сейферт, Дитмар; Доусон, Питер; Робинсон, Брайан Х. (1980). "μ3-Метилидин и μ3-Бензилидин-Трис (трикарбонилкобальт) ». Неорг. Synth. 20: 226–229. Дои:10.1002 / 9780470132517.ch53.
- ^ Leung, P .; Coppens, P .; McMullan, R.K .; Koetzle, T. F. (1981). «Структура нонакарбонил-μ3-метилидин-Triangulo-трикобальт. Рентгеновские и нейтронографические исследования ". Acta Crystallogr. B. 37 (7): 1347–1352. Дои:10.1107 / S0567740881005906.
- ^ Коррадини, Паоло (1959). «Строение тетракобальтдодекарбонила». Журнал химической физики. 31 (6): 1676–1677. Дои:10.1063/1.1730674.
- ^ Вэй, Цзинь Сюань (1969). «Структурные анализы додекакарбонила тетракобальта и додекакарбонила тетрародия. Кристаллографические обработки неупорядоченной структуры и двойникового композита». Неорганическая химия. 8 (11): 2384–2397. Дои:10.1021 / ic50081a030.
- ^ Фарруджа, Луи Дж .; Брага, Дарио; Грепиони, Фабриция (1999). "Переопределение структуры Co4(CO)12: Доказательства динамического беспорядка и пути миграции атомов металла в кристаллической фазе ». Журнал металлоорганической химии. 573 (1–2): 60–66. Дои:10.1016 / S0022-328X (98) 00879-1.
- ^ Паспорт безопасности материалов Коула Пармера
- ^ CDC - Карманный справочник NIOSH по химической опасности


