Дифенилкетен - Diphenylketene
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2,2-ди (фенил) этенон | |
| Другие имена Дифенилэтенон | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C14ЧАС10О | |
| Молярная масса | 194.233 г · моль−1 |
| Внешность | Красно-апельсиновое масло |
| Температура плавления | От 8 до 9 ° C (от 46 до 48 ° F; от 281 до 282 K) |
| Точка кипения | От 118 до 120 при 1 мм рт. |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Дифенилкетен это химическая субстанция из кетен семья. Дифенилкетен, как и большинство дизамещенных кетены, представляет собой масло красно-оранжевого цвета на комнатная температура и давление. За счет последовательных двойных связей в структуре кетена R1р2C = C = O, дифенилкетен является гетерокумула. Самая важная реакция дифенилкетена - это [2 + 2] циклоприсоединение при кратных связях C-C, C-N, C-O и C-S.[1]
История
Дифенилкетен был впервые выделен Герман Штаудингер в 1905 году и идентифицирован как первый пример исключительно реактивного класса кетены[2] с общей формулой R1р2С = С = O (R1= R2= фенильная группа).[3]
Подготовка
Первый синтез Х. Штаудингера был основан на 2-хлордифенилацетилхлориде (полученном из гидрокси (дифенил) уксусная кислота и тионилхлорид[4]), из которых два атома хлора отщеплены цинк в реакция дегалогенирования:[2]

Ранний синтез использует бензилмоногидразон (из Дифенилэтандион и гидразингидрат[5]), который окисляется оксид ртути (II) и сульфат кальция с образованием монодиазокетона, который затем превращается в дифенилкетен при 100 ° C при отщеплении азота с выходом 58%:[6]
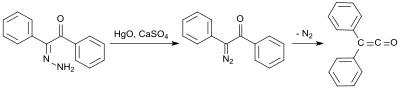
Еще один ранний синтез дифенилкетена происходит от Эдуарда Ведекинда, который уже получил дифенилкетен в 1901 г. дегидрогалогенирование дифенилацетилхлорида с триэтиламин, хотя и без изоляции и описания.[7] Этот вариант был также описан в 1911 г. Г. Штаудингером.[8]
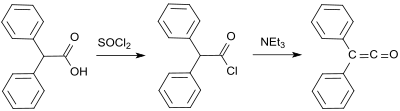
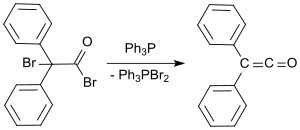
Стандартный лабораторный протокол основан на методе Штаудингера и дает дифенилкетен в виде апельсинового масла с выходом от 53 до 57%.[9] В более позднем способе 2-бром-2,2-дифенилацетилбромид реагирует с трифенилфосфин с выходом до 81% дифенилкетена.[10]
В последнее время синтез дифенилкетена из дифенилуксусной кислоты и Реагент Хендриксона (трифторметансульфонат ангидрида трифенилфосфония)[11] с удалением воды с выходом 72%.[12]

Характеристики
Дифенилкетен представляет собой при комнатной температуре масло от оранжевого до красного цвета (с цветом концентрированного раствор дихромата калия[2]), который смешивается с неполярными органическими растворителями (такими как диэтиловый эфир, ацетон, бензол, тетрагидрофуран, хлороформ )[13] и затвердевает на холоде с образованием желтых кристаллов.[2] Состав легко окисляется воздухом, но может храниться в плотно закрытых емкостях при 0 ° C в течение нескольких недель без разложения.[9] или в атмосфере азота с добавлением небольшого количества гидрохинон как ингибитор полимеризации.[6]
Реактивность
Дифенилкетен может подвергаться атаке со стороны множества нуклеофилы, включая спирты, амины, и енолирует с довольно медленными темпами. Эти ставки могут быть увеличены при наличии катализаторы. В настоящее время механизм Об атаке неизвестно, но ведутся работы по определению точного механизма.
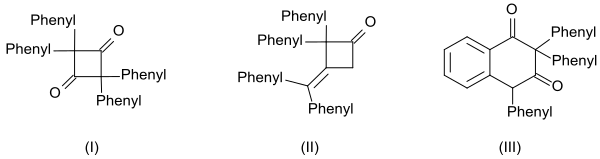
Высокая реакционная способность дифенилкетена также проявляется в образовании трех димеров:[14]
- циклический дикетон 2,2,4,4-тетрафенилциклобутан-1,3-дион (I) путем нагревания с хинолин
- β-лактон 4- (дифенилметилен) -3,3-дифенилоксетан-2-он (II) нагреванием с метоксид натрия и
- производное тетралина 2,2,4-трифенилнафталин-1,3- (2ЧАС,4ЧАС) -дион (III) нагреванием с бензоилхлорид
и олигомеры произведено оттуда.
Заявление
Кетены (общей формулы R1р2C = C = O) имеют много параллелей с изоцианаты (общей формулы R-N = C = O) по своему строению, а также по их реакционной способности.
Дифенилкетен реагирует с водой в реакция присоединения формировать дифенилуксусная кислота, с этиловый спирт до дифенилуксусного этилового эфира или с аммиаком до соответствующего амида.[2] Карбоновые кислоты производят смешанные ангидриды дифенилуксусной кислоты, которые можно использовать для активации защищенных аминокислоты за пептидная связь.
Защищенный дипептид Таким образом, Z-Leu-Phe-OEt (этиловый эфир N-бензилоксикарбонил-L-лейцил-L-фенилаланина) получают с выходом 59% путем активации Z-лейцина дифенилкетеном и последующей реакции с этиловым эфиром фенилаланина.[15]
Дифенилкетен склонен к самоокисление, в котором соответствующий полиэфир образуется при температурах выше 60 ° C через промежуточный дифенилацетолактон.[16]

В Реакция Виттига, аллены можно приготовить из дифенилкетена.[17]

С трифенилфосфиндифенилметиленом и дифенилкетеном, напр. грамм. При 140 ° C и под давлением образуются тетрафенилаллены с выходом 70%.[18]
Синтетически наиболее интересными реакциями дифенилкетена являются [2 + 2] циклоприсоединения, например реакция с циклопентадиен с образованием аддукта Дильса-Альдера.[19]

Imines Такие как бензаланилин форма β-лактамы с дифенилкетеном.
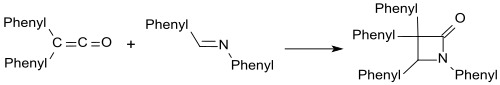
Аналогично с карбонильными соединениями образуются β-лактоны.[19]
[2 + 2] циклоприсоединение дифенилкетена к фенилацетилену сначала приводит к циклобутенон который термически ароматизируется до фенилвинилкетена и циклизуется в [4 + 2] циклоприсоединении к 3,4-дифенил-1-нафтолу с выходом 81%.[20]

На основе этой так называемой реакции Смита-Хёна был разработан общий метод синтеза замещенных фенолов и хинонов.[3]
Рекомендации
- ^ Ульрих, Х. (1967), Реакции циклоприсоединения гетерокумуленов., Нью-Йорк: Academic Press, стр. 374
- ^ а б c d е Штаудингер, Х. (1905). "Ketene, eine neue Körperklasse". Бер. Dtsch. Chem. Ges. (на немецком). 38 (2): 1735–1739. Дои:10.1002 / cber.19050380283.
- ^ а б Тидвелл, Т.Т. (2005), «Первый век кетенов (1905–2005): рождение разностороннего семейства реактивных промежуточных продуктов», Энгью. Chem., 44 (36), стр. 5778–5785, Дои:10.1002 / anie.200500098, PMID 16149113
- ^ King, F.E .; Холмс, Д. (1947), "Синтетические мидриатики. Дифенилхлорацетилхлорид как реагент для получения бензиловых эфиров третичных аминоспиртов", J. Chem. Soc., стр. 164–168, Дои:10.1039 / JR9470000164, PMID 20238643
- ^ Курций, Т .; Тун, К. (1891), "Einwirkung von Hydrazinhydrat auf Monoketone und Orthodiketone", J. Prakt. Chem., 44 (2), стр. 161–186, Дои:10.1002 / prac.18910440121
- ^ а б Smith, L.I .; Hoehn, HH (1940). «Дифенилкетен [Кетен, дифенил-]». Органический синтез. 20: 47. Дои:10.15227 / orgsyn.020.0047.; Коллективный объем, 3, п. 356
- ^ Ведекинд, Э. (1901), "Ueber die Gewinnung von Säureanhydriden mit Hülfe von tertiären Aminen", Бер. Dtsch. Chem. Ges., 34 (2), стр. 2070–2077, Дои:10.1002 / cber.190103402122
- ^ Штаудингер, Х. (1911), "Über Ketene.XIX. Über Bildung und Darstellung des Diphenylketens", Бер. Dtsch. Chem. Ges., 44 (2), стр. 1619–1623, Дои:10.1002 / cber.19110440258
- ^ а б Taylor, E.C .; Маккиллоп, А; Ястребы, Г. (1972). «Дифенилкетен [этенон, дифенил-]». Органический синтез. 52: 36. Дои:10.15227 / orgsyn.052.0036.; Коллективный объем, 6, п. 549
- ^ Darling, S.D .; Кидвелл, Р.Л. (1968), "Дифенилкетен. Дегалогенирование трифенилфосфином α-бромдифенилацетилбромида", J. Org. Chem., 33 (10), стр. 3974–3975, Дои:10.1021 / jo01274a074
- ^ Макколи, Дж. (2012), «Реагент Хендриксона (трифторметансульфонат ангидрида трифенилфосфония», Synlett, 23 (20), стр. 2999–3000, Дои:10.1055 / с-0032-1317486
- ^ Мусса, З. (2012), «Реагент Хендриксона« ПОП »и его аналоги: синтез, структура и применение в органическом синтезе», Аркивок, 2012 (1): 432–490, Дои:10.3998 / ark.5550190.0013.111
- ^ Лихи, Дж. (2001). «Дифенилкетен». Энциклопедия реагентов для органического синтеза. Дои:10.1002 / 047084289X.rd421. ISBN 0471936235.
- ^ Бросаться.; Койман, Э. К. (1965). «Олигомеры дифенилкетена». Recueil des Travaux Chimiques des Pays-Bas. 84 (8): 965–978. Дои:10.1002 / recl.19650840802.
- ^ Losse, G .; Демут, Э. (1961), "Diphenylketen als Reagens zur Knüpfung von Peptidbindungen", Бер. Dtsch. Chem. Ges. (на немецком), 94 (7), стр. 1762–1766, Дои:10.1002 / cber.19610940713
- ^ Staudinger, H .; Dyckerhoff, K .; Klever, H.W .; Ruzicka, L. (1925), "Uber Autoxidation organischer Verbindungen. IV .: Uber Autoxidation der Ketene", Бер. Dtsch. Chem. Ges. (на немецком), 58 (6), стр. 1079–1087, Дои:10.1002 / cber.19250580618
- ^ Wittig, G .; Haag, A. (1963), "Uber Phosphin-алкилен als olefinbildende Reagenzien, VIII. Allelderivate aus Ketenen", Бер. Dtsch. Chem. Ges. (на немецком), 96 (6), стр. 1535–1543, Дои:10.1002 / cber.19630960609
- ^ Люшер, Г. (1922). Beitrag zur Konstitution der aliphatischen Diazokörper und Hydrazone. Neue Organische Phosphorverbindungen (PDF) (Докторская диссертация) (на немецком языке). Eidgenössische Technische Hochschule Zurich. Дои:10.3929 / ethz-a-000096667. HDL:20.500.11850/134328.
- ^ а б Штаудингер, Х. (1907), "Zur Kenntnis der Ketene. Diphenylketen", Liebigs Ann. Chem. (на немецком), 356 (1–2), стр. 51–123, Дои:10.1002 / jlac.19073560106
- ^ Smith, L.I .; Hoehn, H.H. (1939), "Реакция дифенилкетена и фенилацетилена", Варенье. Chem. Soc., 61 (10), стр. 2619–2624, Дои:10.1021 / ja01265a015

![{displaystyle {ce {(фенил) 2C = C = O -> [{} поверх {ext {Z-Leu}}] (фенил) 2CO-O-CO - {}}} {ext {Z-Leu}} { ce {-> [{} на {ce {H-Phe-OEt}}]}} {ext {Z-Leu}} {ce {-Phe-OEt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7b4b915bc917b7c77143009ead9cc799bd83acc)