Внутримолекулярная сила - Intramolecular force
Эта статья нужны дополнительные цитаты для проверка. (Октябрь 2017 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
An внутримолекулярная сила есть ли сила что связывает воедино атомы составляя молекула или составной, не путать с межмолекулярные силы, которые представляют собой силы, существующие между молекулами.[1] Тонкая разница в названии происходит от латинских корней английского языка со значением интер. между или среди и внутреннее значение внутри.[2] Например, химические связи считаются внутримолекулярными силами. Эти силы часто сильнее, чем межмолекулярные силы, которые присутствуют между атомами или молекулами, которые не связаны.
Типы
Классическая модель выделяет три основных типа химических связей - ионную, ковалентную и металлическую, - различающихся степенью разделения зарядов между участвующими атомами.[3] Характеристики образующейся связи можно предсказать по свойствам составляющих атомов, а именно по электроотрицательности. Они различаются по величине своего энтальпии связи, мера прочности связи и, таким образом, по-разному влияет на физические и химические свойства соединений. % ионного характера прямо пропорционален разнице электроотрицательности связанного атома.[требуется разъяснение ]
Ионная связь
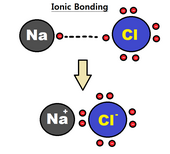
An ионная связь можно представить как полный перенос одного или нескольких валентных электронов атомов, участвующих в образовании связи, в результате чего положительный ион и отрицательный ион связаны вместе электростатическими силами.[4] Электроны в ионной связи стремятся к быть в основном найденным вокруг одного из двух составляющих атомов из-за большого электроотрицательность разница между двумя атомами (большая разница в электроотрицательности приводит к более прочной связи); это часто описывается как один атом отдает электроны другому. Этот тип связи обычно образуется между металл и неметалл, Такие как натрий и хлор в NaCl. Натрий отдает электрон хлору, образуя положительно заряженный ион натрия и отрицательно заряженный ион хлорида.
Ковалентная связь
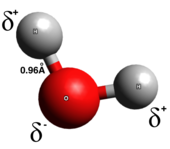
В истинном Ковалентная связь, электроны равномерно распределяются между двумя атомами связи; разделение зарядов мало или отсутствует. Ковалентные связи обычно образуются между двумя неметаллами. Есть несколько типов ковалентных связей: полярные ковалентные связи, электроны с большей вероятностью будут обнаружены вокруг одного из двух атомов, тогда как в неполярных ковалентных связях электроны распределены равномерно. Гомоядерный двухатомные молекулы чисто ковалентны. Полярность ковалентной связи определяется электроотрицательность каждого атома и, таким образом, полярная ковалентная связь имеет дипольный момент указывая от частичного положительного конца к частичному отрицательному концу.[5] Полярные ковалентные связи представляют собой промежуточный тип, в котором электроны не переносятся полностью от одного атома к другому и не разделяются равномерно.
Металлическая связка
Металлические облигации обычно образуются в чистом металле или металле сплав. Металлические электроны обычно делокализованный; результатом является большое количество свободных электронов вокруг положительного ядра, иногда называемое электронным морем.
Образование облигаций

Связи образуются атомами, поэтому они могут достигать более низкого энергетического состояния. Свободные атомы будут иметь больше энергии, чем связанный атом. Это связано с тем, что во время образования связи выделяется некоторая энергия, позволяя всей системе достичь более низкого энергетического состояния. Длина связи или минимальное разделяющее расстояние между двумя атомами, участвующими в образовании связи, определяется их силами отталкивания и притяжения в межъядерном направлении.[3] По мере того как два атома становятся все ближе и ближе, положительно заряженные ядра отталкиваются, создавая силу, которая пытается раздвинуть атомы. Когда два атома отдаляются друг от друга, силы притяжения сближают их. Таким образом достигается равновесная длина связи, что является хорошим показателем стабильности связи.
Биохимия
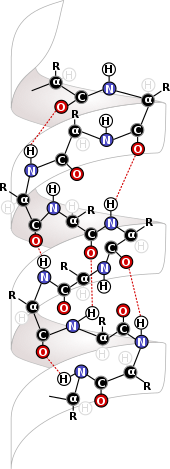
Внутримолекулярные силы чрезвычайно важны в области биохимии, где они проявляются на самых основных уровнях биологических структур. Внутримолекулярные силы, такие как дисульфидные связи дать белки и ДНК их структура. Белки получают свою структуру из внутримолекулярных сил, которые формируют их и удерживают их вместе. Основным источником структуры этих молекул является взаимодействие между аминокислота остатки, составляющие основу белков.[6] Взаимодействие между остатки тех же белков образует вторичную структуру белка, позволяя формировать бета-листы и альфа спирали, которые являются важными структурами для белков и, в случае альфа-спиралей, для ДНК.
Смотрите также
Рекомендации
- ^ Zumdahl, Steven S .; Зумдал, Сьюзен А. (2007). Химия (7-е изд.). Бостон: Хоутон Миффлин. ISBN 978-0618713707. OCLC 85824942.
- ^ "Интер vs. Интра". www.grammar.com. Получено 2018-04-26.
- ^ а б Окстоби, Дэвид В .; Gills, H.P .; Кэмпион, Алан (2012). Принципы современной химии (7-е изд.). Бельмонт, Калифорния: Обучение Брукс / Коула Сенсага. ISBN 978-0-8400-4931-5.
- ^ Bader, R. F. W .; Хеннекер, В. Х. (1965). «Ионная связь». Журнал Американского химического общества. 87 (14): 3063–3068. Дои:10.1021 / ja01092a008.
- ^ Хельменстин, Энн Мари. «Понять, что такое ковалентная связь в химии». ThoughtCo.
- ^ Нельсон, Дэвид Л .; Кокс, Майкл М .; Ленингер, Альберт Л. (2013). Принципы биохимии Ленингера (6-е изд.). Нью-Йорк: W.H. Фримен и компания. ISBN 9781429234146. OCLC 824794893.
