Иридат лития - Википедия - Lithium iridate
| |||
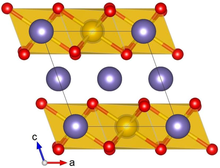 | |||
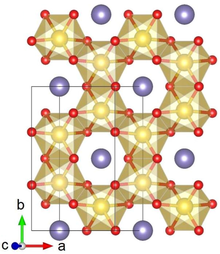 Кристаллическая структура α-Li2IrO3 При этом Ir отображается желтым, Li - фиолетовым, а O - красным | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Литий иридат | |||
| Идентификаторы | |||
| Характеристики | |||
| Ли2IrO3 | |||
| Внешность | Черные кристаллы | ||
| Структура | |||
| Моноклиника, C2 / м[2] | |||
а = 5,1633 (2) Å, б = 8,9294 (3) Å, c = 5,1219 (2) Å α = 90 °, β = 109,759 (3) °, γ = 90 ° | |||
Формула единиц (Z) | 4 | ||
| Родственные соединения | |||
Другой анионы | Лития рутенат, платинат лития | ||
Другой катионы | Иридат натрия | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Литий иридат, Ли2IrO3, представляет собой химическое соединение литий, иридий и кислород. Он образует черные кристаллы с тремя немного разными слоистыми атомными структурами: α, β и иногда γ. Иридат лития обладает металлическими свойствами, не зависит от температуры. электрическая проводимость, и меняет свое магнитное упорядочение с парамагнитный к антиферромагнитный при охлаждении до 15 К.
Структура
Ли2IrO3 обычно кристаллизуется в α- или β-фазе, и сообщалось о редкой γ-фазе. Кристаллическая структура α-Li2IrO3 состоит из чередующегося набора гексагональных слоев Li и сот из IrO с разделением кромок6 октаэдры с Ли в центре. Смещение в соседних слоях приводит к относительно низкой (моноклинной) симметрии кристалла. Ли2IrO3 кристаллы имеют обильные дефекты двойникования, где ab плоскости кристалла повернуты на 120 ° вокруг c ось.[1]
Синтез


Ли2IrO3 кристаллы могут быть выращены прямым спекание металлов Ir и Li, которые окисляются при нагревании в окружающей атмосфере. Α-фаза образуется при 750–1050 ° C, а при нагревании до более высоких температур образуется β-фаза. Использование металла Li вместо более традиционного карбонат лития, с которым легче обращаться и хранить, в результате получаются более крупные кристаллы. Γ-фаза может быть получена прокаливанием карбоната лития и оксид иридия (IV) с последующим отжигом в расплаве гидроксид лития при 700–800 ° С.[1]
Характеристики
Иридат лития имеет черный цвет и имеет относительно высокую, не зависящую от температуры, электропроводность, характерную для металлов.[2] В обеих его фазах α и β наблюдается обменная связь Китаева между магнитными спинами, происходящими от Ir4+ ионы. Эти спины образуют антиферромагнитную решетку при температурах ниже 15 К (Температура Нееля, ТN), а материал выше - парамагнитный. ТN.[1]
Возможные приложения
Иридат лития является потенциальным электродным материалом для литий-ионный аккумулятор.[2] Этому применению препятствует высокая стоимость Ir по сравнению с более дешевым Li2MnO3 альтернатива.[3]
Рекомендации
- ^ а б c d е ж грамм Freund, F .; Williams, S.C .; Johnson, R.D .; Coldea, R .; Gegenwart, P .; Еше, А. (2016). «Рост монокристаллов из разделенных исходных продуктов и его применение к оксидам переходных металлов лития». Научные отчеты. 6: 35362. arXiv:1604.04551. Bibcode:2016НатСР ... 635362Ф. Дои:10.1038 / srep35362. ЧВК 5066249. PMID 27748402.
- ^ а б c О'Мэлли, Мэтью Дж .; Verweij, Henk; Вудворд, Патрик М. (2008). «Структура и свойства упорядоченного Li2IrO3 и Ли2PtO3". Журнал химии твердого тела. 181 (8): 1803. Bibcode:2008JSSCh.181.1803O. Дои:10.1016 / j.jssc.2008.04.005.
- ^ Йошио, Масаки; Бродд, Ральф Дж .; Кодзава, Акия (17 июля 2010 г.). Литий-ионные батареи: наука и технологии. Springer Science & Business Media. п. 10. ISBN 978-0-387-34445-4.


