Бис (триметилсилил) амид лития - Википедия - Lithium bis(trimethylsilyl)amide
 Мономер (не существует) | |
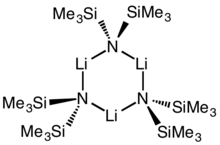 Циклический тример | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Литий 1,1,1-триметил-N- (триметилсилил) силанаминид | |
| Другие имена Гексаметилдисилазид лития Литиевая соль гексаметилдисилазана | |
| Идентификаторы | |
3D модель (JSmol ) |
|
| ChemSpider | |
| ECHA InfoCard | 100.021.569 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C6ЧАС18LiNSi2 | |
| Молярная масса | 167,326 г / моль |
| Внешность | Белое твердое вещество |
| Плотность | 0,86 г / см3 при 25 ° C |
| Температура плавления | От 71 до 72 ° C (от 160 до 162 ° F, от 344 до 345 K) |
| Точка кипения | От 80 до 84 ° C (от 176 до 183 ° F; от 353 до 357 K) (0,001 мм рт. Ст.) |
| разлагается | |
| Растворимость | Самые апротонные растворители THF, гексан, толуол |
| Кислотность (пKа) | 26 |
| Опасности | |
| Главный опасности | легковоспламеняющийся, коррозионный |
| Родственные соединения | |
Родственные соединения | Бис (триметилсилил) амид натрия Бис (триметилсилил) амид калия |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Литий бис (триметилсилил) амид литиированный кремнийорганическое соединение с формулой LiN (SiMe3)2. Обычно его сокращают как LiHMDS (Литиий часexaмэтилdяsилазид - ссылка на его конъюгированная кислота HMDS ) и в основном используется как сильный ненуклеофильное основание и как лиганд. Как и многие литиевые реагенты, он имеет тенденцию к агрегации и образует циклический тример при отсутствии координирующих видов.
Подготовка
LiHMDS коммерчески доступен, но его также можно получить депротонированием бис (триметилсилил) амин с н-бутиллитий.[1] Эту реакцию можно провести на месте.[2]
- HN (SiMe3)2 + C4ЧАС9Li → LiN (SiMe3)2 + C4ЧАС10
После образования соединение может быть очищено сублимация или же дистилляция.
Реакции и заявки
В качестве базы
LiHMDS часто используется в органической химии в качестве сильного ненуклеофильное основание.[3] Его конъюгированная кислота имеет pKa из ~ 26,[4] делая его менее основным, чем другие литиевые основы, такие как LDA (рКа конъюгированной кислоты ~ 36), но больше стерически затрудненный и, следовательно, меньше нуклеофильный. Его можно использовать для формирования различных литийорганический соединения, в том числе ацетилиды[3] или литий енолирует.[2]

По существу, он находит применение в ряде реакций сочетания, особенно в реакциях образования углерод-углеродной связи, таких как Алкилирование Фратера-Зеебаха и смешанный Клейзеновские конденсации.
Альтернативный синтез тетранитрид тетрасеры влечет за собой использование [(Me3Si)2N]2S в качестве предшественника с предварительно сформированными связями S – N. [(Мне3Si)2N]2S получают реакцией бис (триметилсилил) амида лития и дихлорид серы (SCl2).
- 2 [(CH3)3Si]2NLi + SCl2 → [((CH3)3Si)2N]2S + 2 LiCl
[((CH3)3Si)2N]2S реагирует с комбинацией SCl2 и сульфурилхлорид (ТАК2Cl2) с образованием S4N4, триметилсилилхлорид, и диоксид серы:[5]
- 2 [((CH3)3Si)2N]2S + 2SCl2 + 2SO2Cl2 → S4N4 + 8 (CH3)3SiCl + 2SO2
Как лиганд
LiHMDS может реагировать с широким спектром галогениды металлов, автор реакция метатезиса солей, давать бис (триметилсилил) амиды металлов.
- MXИкс + x Li (hmds) → M (hmds)Икс + x LiX
- (X = Cl, Br, I и иногда F)
Бис (триметилсилил) амидные комплексы металлов являются липофильными благодаря лиганду и, следовательно, растворимы в диапазоне неполярные органические растворители, это часто делает их более реактивными, чем соответствующие галогениды металлов, солюбилизация которых может быть затруднена. В стерический большая часть лигандов делает их комплексы дискретными и мономерными; дальнейшее повышение их реактивности. Имея встроенное основание, эти соединения обычно реагируют с предшественниками протонных лигандов с образованием других комплексов металлов и, следовательно, являются важными предшественниками более сложных координационные соединения.[6]
Ниша использует
LiHMDS является летучим и обсуждался для использования в осаждение атомного слоя соединений лития.[7]
Структура
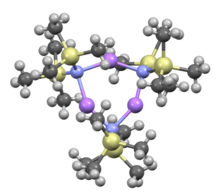
Как и многие литийорганический реагенты, бис (триметилсилил) амид лития может образовывать агрегаты в растворе. Степень агрегации зависит от растворителя. В координирующих растворителях, таких как эфиры[8] и амины,[9] в мономер и димер распространены. В мономерном и димерном состоянии одна или две молекулы растворителя связываются с литиевыми центрами. С аммиаком в качестве донорного основания бис (триметилсилил) амид лития образует трисольватированный мономер, который стабилизируется межмолекулярными водородными связями.[10][11] В некоординирующих растворителях, таких как ароматика или же пентан, комплекс олигомеры преобладают, включая тример.[9] В твердом состоянии структура является тримерной.[12]
 | ||||
 LiHMDS аддукт с TMEDA |  THF сольватированный димер: (LiHMDS)2• THF2 |  Тример, без растворителей: (LiHMDS)3 | ||
Смотрите также
Рекомендации
- ^ Amonoo-Neizer, E.H .; Shaw, R.A .; Сковлин, Д. О .; Смит, Б. С. (1966). "Бис (триметилсилил) амид лития и Трис (триметилсилил) амин ". Неорг. Synth. Неорганические синтезы. 8: 19–22. Дои:10.1002 / 9780470132395.ch6. ISBN 978-0-470-13239-5.
- ^ а б Danheiser, R. L .; Миллер, Р. Ф .; Брисбуа, Р. Г. (1990). «Перенос диазогрупп с детрифторацетилированием: (E) -1-диазо-4-фенил-3-бутен-2-он ». Органический синтез. 73: 134.; Коллективный объем, 9, п. 197
- ^ а б Ву, Джордж; Хуан, Миншэн (июль 2006 г.). «Литийорганические реагенты в фармацевтических асимметричных процессах». Химические обзоры. 106 (7): 2596–2616. Дои:10.1021 / cr040694k. PMID 16836294.
- ^ Фрейзер, Роберт Р .; Мансур, Тарек С .; Савар, Сильвен (август 1985). «Измерение кислотности пиридинов в тетрагидрофуране с использованием литированных силиламинов». Журнал органической химии. 50 (17): 3232–3234. Дои:10.1021 / jo00217a050.
- ^ Maaninen, A .; Shvari, J .; Laitinen, R. S .; Чиверс, Т. (2002). Coucouvanis, Дмитрий (ред.). «Компаунды общего интереса». Неорганические синтезы. Нью-Йорк: John Wiley & Sons, Inc. 33: 196–199. Дои:10.1002 / 0471224502.ch4.
- ^ Майкл Лапперт, Андрей Протченко, Филип Пауэр, Александра Сибер (2009). Химия амидов металлов. Вайнхайм: Wiley-VCH. Дои:10.1002/9780470740385. ISBN 0-470-72184-7.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Хямяляйнен, Яни; Холопайнен, Яни; Мунник, Франс; Хатанпяя, Тимо; Хейккиля, Микко; Ритала, Микко; Лескеля, Маркку (2012). "Тонкие пленки фосфата лития, полученные путем осаждения атомных слоев". Журнал Электрохимического общества. 159 (3): A259 – A263. Дои:10.1149 / 2.052203jes.
- ^ Lucht, Brett L .; Коллум, Дэвид Б. (1995). «Эфирная сольватация гексаметилдисилазида лития: неожиданные отношения числа сольватации, энергии сольватации и состояния агрегации». Журнал Американского химического общества. 117 (39): 9863–9874. Дои:10.1021 / ja00144a012.
- ^ а б Lucht, Brett L .; Коллум, Дэвид Б. (1996). «Литий-ионная сольватация: аминные и ненасыщенные углеводородные сольваты гексаметилдисилазида лития (LiHMDS)». Журнал Американского химического общества. 118 (9): 2217–2225. Дои:10.1021 / ja953029p.
- ^ Neufeld, R .; Michel, R .; Herbst-Irmer, R .; Schöne, R .; Сталке, Д. (2016). «Введение донора водородной связи в слабонуклеофильное основание Бренстеда: гексаметилдисилазиды щелочных металлов (MHMDS, M = Li, Na, K, Rb и Cs) с аммиаком». Chem. Евро. Дж. 22: 12340–12346. Дои:10.1002 / chem.201600833. PMID 27457218.
- ^ Нойфельд, Р .: Определение молекулярной массы с помощью внешней калибровочной кривой DOSY как ценный метод определения реактивных промежуточных продуктов в растворе. В: eDiss, Георг-Август-Университет Геттингена. 2016.
- ^ Роджерс, Робин Д .; Этвуд, Джерри Л .; Грюнинг, Райнер (1978). "Кристаллическая структура N-литиогексаметилдисилазан, [LiN (SiMe3)2]3". J. Organomet. Chem. 157 (2): 229–237. Дои:10.1016 / S0022-328X (00) 92291-5.
