Вестерн-блоттинг - Western blot

В вестерн-блот (иногда называют белковый иммуноблот), или вестерн-блоттинг, является широко используемым аналитическая техника в молекулярная биология и иммуногенетика для выявления конкретных белки в образце тканевого гомогената или экстракта.
Короче говоря, образец подвергается протеиновому денатурация, с последующим гель-электрофорез. А синтетический или животного происхождения антитело (известный как первичное антитело ) создается, который распознает и связывается с конкретным целевым белком. Мембрана для электрофореза промывается раствором, содержащим первичное антитело, перед тем, как смыть избыток антител. Добавляется вторичное антитело, которое распознает первичное антитело и связывается с ним. Вторичное антитело визуализируется различными методами, такими как окрашивание, иммунофлуоресценция и радиоактивность, что позволяет косвенно определять конкретный целевой белок.
Другие связанные методы включают точечный блот анализ, количественный дот-блот, иммуногистохимия и иммуноцитохимия, где антитела используются для обнаружения белков в тканях и клетках путем иммуноокрашивание, и иммуноферментный анализ (ИФА).
Название вестерн-блот это игра на Саузерн-блот, техника для ДНК открытие названо в честь его изобретателя, английского биолога Эдвин Саузерн. Точно так же обнаружение РНК называется северное пятно.[1] Термин «вестерн-блоттинг» был дан В. Нилом Бернеттом в 1981 г.[2] хотя сам метод зародился в 1979 году в лаборатории Гарри Тобина в Институт Фридриха Мишера в Базель, Швейцария.[3] В период с 1979 по 2019 год "он был упомянут в заголовках, рефератах и ключевых словах более 400 000 PubMed опубликованных в списке публикаций »и, возможно, по-прежнему является наиболее часто используемым методом анализа белков.[4]
Приложения
Вестерн-блот широко используется в биохимия для качественного обнаружения отдельных белков и модификаций белков (таких как посттрансляционные модификации ). По оценкам, не менее 8-9% всех публикаций, связанных с белками, используют вестерн-блоттинг.[4] Он используется в качестве общего метода для определения присутствия конкретного отдельного белка в сложной смеси белков. Полуколичественная оценка белка может быть получена по размеру и интенсивности цвета полосы белка на мембране блота. Кроме того, применяя серия разбавления очищенного белка известных концентраций можно использовать для более точной оценки концентрации белка. Вестерн-блот обычно используется для проверки производство белка после клонирование. Он также используется в медицинской диагностике, например, в Тест на ВИЧ или BSE -Тест.
Подтверждающий тест на ВИЧ использует вестерн-блоттинг для обнаружения антител к ВИЧ у человека. сыворотка образец. Белки из известных ВИЧ -инфицированные клетки отделяют и наносят на мембрану, как указано выше. Затем тестируемая сыворотка применяется на стадии инкубации первичных антител; свободное антитело смывается и добавляется вторичное антитело против человека, связанное с сигналом фермента. Окрашенные полосы затем указывают на белки, к которым сыворотка пациента содержит антитела. [5]Вестерн-блот также используется в качестве окончательного теста на вариант болезни Крейтцфельдта-Якоба, тип прионной болезни, связанной с употреблением зараженной говядины крупного рогатого скота с Губчатая энцефалопатия (ГЭКРС, обычно называемое «коровьим бешенством»).[6]
Другое приложение - диагностика туляремии. Оценка способности вестерн-блоттинга выявлять антитела против F. tularensis показала, что его чувствительность составляет почти 100%, а специфичность - 99,6%.[7]
Некоторые формы Болезнь Лайма Для тестирования используют вестерн-блоттинг.[8] Вестерн-блоттинг также можно использовать в качестве подтверждающего теста на инфекцию гепатита B и инфекцию HSV-2 (герпес 2 типа). [9] [10] В ветеринарии иногда используется вестерн-блоттинг для подтверждения FIV + статус у кошек. [11]
Другие применения метода вестерн-блоттинга включают его использование Всемирным антидопинговым агентством. (ВАДА). Кровяной допинг - это неправильное использование определенных методов и / или веществ для увеличения массы эритроцитов, что позволяет телу доставлять больше кислорода к мышцам и, следовательно, повышать выносливость и работоспособность. Существует три широко известных вещества или метода, используемых для допинга крови, а именно, эритропоэтин (ЭПО), синтетические переносчики кислорода и переливание крови. Каждый из них запрещен Списком запрещенных веществ и методов ВАДА. Метод вестерн-блоттинга использовался во время чемпионата мира по футболу 2014 года в рамках антидопинговой кампании на этом мероприятии.[12] В общей сложности было собрано и проанализировано более 1000 образцов Reichel et al.[13] в аккредитованной ВАДА лаборатории в Лозанне, Швейцария. Недавние исследования с использованием метода вестерн-блоттинга показали улучшенное обнаружение ЭПО в крови и моче на основе новых сборных горизонтальных гелей Velum SAR, оптимизированных для рутинного анализа.[14] С принятием горизонтального SAR-PAGE в сочетании с готовыми гелями Velum SAR на пленочной основе, избирательная способность микродозного нанесения rEPO была значительно увеличена.
Процедура
Метод вестерн-блоттинга состоит из гель-электрофорез для разделения нативных белков по 3-D структуре или денатурированных белков по длине полипептида с последующим электрофоретическим переносом на мембрану (в основном ПВДФ или Нитроцеллюлоза ) и процедура иммуноокрашивания для визуализации определенного белка на мембране блота. SDS-СТРАНИЦА обычно используется для денатурирующего электрофоретического разделения белков. SDS обычно используется в качестве буфера (а также в геле), чтобы придать всем присутствующим белкам однородный отрицательный заряд, поскольку белки могут быть заряжены положительно, отрицательно или нейтрально. Этот тип электрофореза известен как SDS-PAGE (электрофорез в SDS-полиакриламидном геле). Перед электрофорезом образцы белков часто кипятят, чтобы денатурировать присутствующие белки. Это гарантирует разделение белков по размеру и предотвращает разложение образцов протеазами (ферментами, расщепляющими белки). После электрофоретического разделения белки переносятся на мембрану (обычно нитроцеллюлоза или ПВДФ ), где они блокируются молоком (или другими блокирующими агентами) для предотвращения неспецифического связывания антител, а затем окрашиваются антитела специфичен для целевого белка.[3][15] Наконец, мембрана будет окрашена вторичным антителом, распознающим первое окрашивание антителом, которое затем может быть использовано для обнаружения различными методами. Этап гель-электрофореза включен в вестерн-блот-анализ для решения проблемы перекрестная реактивность антител.
Гель-электрофорез
Белки образца разделяют с помощью гель-электрофорез. Разделение белков может быть изоэлектрическая точка (число Пи), молекулярный вес, электрический заряд или сочетание этих факторов. Характер разделения зависит от обработки образца и природы геля.
Безусловно, наиболее распространенный тип гель-электрофореза использует полиакриламид гели и буферы с додецилсульфат натрия (SDS). SDS-СТРАНИЦА (Электрофорез в полиакриламидном геле в SDS) поддерживает полипептиды в денатурированном состоянии после того, как они были обработаны сильными восстановителями для удаления вторичной и третичной структуры (например, дисульфидных связей [SS] с сульфгидрильными группами [SH и SH]) и, таким образом, позволяет разделить белки с помощью их молекулярная масса. Отобранные белки покрываются отрицательно заряженным SDS, фактически становясь анионными, и мигрируют к положительно заряженному (более высокому напряжению) аноду (обычно имеющему красный провод) через акриламид сетка из геля. Более мелкие белки быстрее мигрируют через эту сетку, и, таким образом, белки разделяются по размеру (обычно измеряется в килодальтонах, кДа ). Концентрация акриламида определяет разрешение геля - чем больше концентрация акриламида, тем лучше разрешение белков с более низким молекулярным весом. Чем ниже концентрация акриламида, тем лучше разрешение белков с более высокой молекулярной массой. Для большинства блотов белки перемещаются по гелю только в одном измерении.
Образцы загружаются в колодцы в геле. Одна полоса обычно зарезервирована для маркер или лестница, который представляет собой коммерчески доступную смесь белков с известной молекулярной массой, обычно окрашенную для образования видимых окрашенных полос. Когда Напряжение наносится вдоль геля, белки перемещаются через него с разной скоростью в зависимости от их размера. Эти разные темпы продвижения (разные электрофоретическая подвижность ) разделить на группы внутри каждого полоса дороги. Затем полосы белков можно сравнить с полосами лестничной диаграммы, что позволяет оценить молекулярную массу белка.

Также можно использовать двумерный гель который распределяет белки из одного образца в двух измерениях. Белки разделяются в соответствии с изоэлектрической точкой (pH, при котором они имеют нейтральный общий заряд) в первом измерении и в соответствии с их молекулярной массой во втором измерении.
Передача
Чтобы сделать белки доступными для обнаружения антител, они перемещаются из геля на мембрану, состоящую из нитроцеллюлоза (NC) или поливинилидендифторид (ПВДФ). Наиболее часто используемый метод переноса белков называется электроблоттинг. Электроблоттинг использует электрический ток для вытягивания отрицательно заряженных белков из геля к положительно заряженному аноду и в мембрану PVDF или NC. Белки перемещаются изнутри геля на мембрану, сохраняя при этом свою организацию в геле. Более старый метод переноса включает размещение мембраны поверх геля и стопки фильтровальной бумаги поверх нее. Вся стопка помещается в буферный раствор, который перемещает бумагу вверх на капиллярное действие, принося с собой белки. На практике этот метод обычно не используется из-за длительного времени процедуры.
В результате любого процесса переноса белки экспонируются на тонком слое мембраны для обнаружения. Обе разновидности мембраны выбраны из-за их неспецифических свойств связывания с белками (т.е. одинаково хорошо связывает все белки). Связывание с белками основано на гидрофобных взаимодействиях, а также на заряженных взаимодействиях между мембраной и белком. Мембраны из нитроцеллюлозы дешевле, чем ПВДФ, но они гораздо более хрупкие и не выдерживают повторных испытаний.

Окрашивание общего белка
Окрашивание общего белка позволяет визуализировать общий белок, который был успешно перенесен на мембрану, что позволяет пользователю проверить однородность переноса белка и выполнить последующую нормализацию целевого белка с фактическим количеством белка на дорожке. Нормализация с помощью так называемого «контроля загрузки» была основана на иммуноокрашивании белков домашнего хозяйства по классической процедуре, но в последнее время идет к общему окрашиванию белка из-за множества преимуществ.[16] Для нормализации вестерн-блоттинга описано как минимум семь различных подходов к окрашиванию общего белка: Понсо С, без пятен, Sypro Ruby, Эпикокконон, Кумасси Р-350, Амидо Блэк, и Cy5.[16] Во избежание шума сигнала перед блокировкой мембраны следует провести окрашивание общего белка. Тем не менее, также описаны пост-антитела окрашивания.[17]
Блокировка
Поскольку мембрана была выбрана из-за ее способности связывать белок и поскольку и антитела, и мишень являются белками, необходимо предпринять шаги для предотвращения взаимодействий между мембраной и антителом, используемым для обнаружения целевого белка. Блокирование неспецифического связывания достигается путем помещения мембраны в разбавленный раствор белка - обычно 3-5%. бычий сывороточный альбумин (BSA) или обезжиренное сухое молоко (оба недорогие) в трис-забуференный физиологический раствор (TBS) или I-Block с минутным процентным содержанием (0,1%) моющего средства, например Подросток 20 или Тритон Х-100. Хотя обезжиренное сухое молоко является предпочтительным из-за его доступности, необходим соответствующий блокирующий раствор, поскольку не все белки в молоке совместимы со всеми полосами обнаружения.[18] Белок в разбавленном растворе прикрепляется к мембране во всех местах, где не прикрепились целевые белки. Таким образом, когда добавляется антитело, оно не может связываться с мембраной, и, следовательно, единственным доступным сайтом связывания является конкретный целевой белок. Это снижает фон в конечном продукте вестерн-блоттинга, что приводит к более четким результатам и исключает ложноположительные результаты.
Инкубация
В процессе обнаружения мембрана «зондируется» на предмет интересующего белка с помощью модифицированного антитела, связанного с репортерным ферментом; при воздействии подходящего субстрата этот фермент запускает колориметрическую реакцию и производит окраску. По ряду причин это обычно происходит в два этапа, хотя теперь для некоторых приложений доступны одноэтапные методы обнаружения.
Первичное антитело
В первичные антитела образуются, когда вид-хозяин или культура иммунных клеток подвергаются воздействию интересующего белка (или его части). Обычно это часть иммунного ответа, тогда как здесь они собираются и используются в качестве чувствительных и специфических инструментов обнаружения, которые напрямую связывают белок.
После блокирования раствор первичного антитела (обычно от 0,5 до 5 мкг / мл), разбавленный в промывочном буфере PBS или TBST, инкубируют с мембраной при осторожном перемешивании в течение обычно часа при комнатной температуре или в течение ночи при 4 ° C.°C. Раствор антител инкубируют с мембраной в течение от 30 минут до ночи. Его также можно инкубировать при разных температурах, при этом более низкие температуры связаны с большим связыванием, как специфическим (для целевого белка, «сигнал»), так и неспецифическим («шум»). После инкубации мембрану несколько раз промывают промывочным буфером, чтобы удалить несвязанное первичное антитело и тем самым минимизировать фон.[18] Обычно промывочный буферный раствор состоит из забуференного физиологического раствора с небольшим процентным содержанием детергента, а иногда и сухого молока или BSA.
Вторичное антитело
После промывки мембраны для удаления несвязанного первичного антитела мембрана подвергается воздействию другого антитела, известного как вторичное антитело. Антитела происходят из животных источников (или из животных гибридома культур). Вторичное антитело распознает видоспецифичную часть первичного антитела и связывается с ней. Следовательно, вторичное антитело против мыши будет связываться практически с любым первичным антителом, полученным от мыши, и может называться «антивидовым» антителом (например, антимышиным, антикозьим и т. Д.). Для обнаружения целевого белка вторичное антитело обычно связывают с биотин или репортер фермент такие как щелочная фосфатаза или пероксидаза хрена. Это означает, что несколько вторичных антител будут связываться с одним первичным антителом и усиливать сигнал, позволяя обнаруживать белки с гораздо более низкой концентрацией, чем можно было бы увидеть только с помощью SDS-PAGE.
Пероксидаза хрена (HRP) обычно связана со вторичными антителами, что позволяет обнаруживать целевой белок с помощью хемилюминесценция. Хемилюминесцентный субстрат расщепляется HRP, что приводит к образованию свечение. Следовательно, производство люминесценции пропорционально количеству вторичного антитела, конъюгированного с HRP, и, следовательно, косвенно измеряет присутствие целевого белка. Чувствительный лист фотопленки прикладывают к мембране, и воздействие света от реакции создает изображение антител, связанных с пятном. Более дешевый, но менее чувствительный подход использует 4-хлорнафтол морилка с 1% пероксид водорода; реакция пероксидных радикалов с 4-хлорнафтолом дает темно-пурпурное пятно, которое можно сфотографировать без использования специальной фотопленки.

Как и в случае с ELISPOT и ELISA После процедуры фермент может быть снабжен молекулой субстрата, которая будет преобразована ферментом в окрашенный продукт реакции, который будет виден на мембране (см. рисунок ниже с синими полосами).
Другой метод обнаружения вторичных антител использует антитело, связанное с флуорофором в ближней инфракрасной области (NIR). Свет, производимый при возбуждении флуоресцентного красителя, является статическим, что делает флуоресцентное обнаружение более точным и точным измерением разницы в сигнале, создаваемом мечеными антителами, связанными с белками, при вестерн-блоттинге. Белки могут быть точно определены количественно, поскольку сигнал, генерируемый различными количествами белков на мембранах, измеряется в статическом состоянии по сравнению с хемилюминесценцией, при которой свет измеряется в динамическом состоянии.[19]
Третья альтернатива - использовать радиоактивную метку, а не фермент, связанный со вторичным антителом, например, мечение связывающего антитело белка, такого как Стафилококк Белок А или стрептавидин с радиоактивным изотопом йода. Поскольку другие методы безопаснее, быстрее и дешевле, этот метод сейчас используется редко; однако преимуществом этого подхода является чувствительность визуализации на основе автоматической радиографии, которая позволяет с высокой точностью определять количество белка в сочетании с оптическим программным обеспечением (например, Optiquant).
Один шаг
Исторически процесс зондирования проводился в два этапа из-за относительной простоты получения первичных и вторичных антител в отдельных процессах. Это дает исследователям и корпорациям огромные преимущества с точки зрения гибкости, снижения затрат и добавляет этап усиления к процессу обнаружения. Однако, учитывая появление высокопроизводительного анализа белков и более низких пределов обнаружения, возник интерес к разработке одноэтапных систем зондирования, которые позволили бы процессу происходить быстрее и с меньшим количеством расходных материалов. Для этого требуется зондовое антитело, которое распознает интересующий белок и содержит детектируемую метку, зонды, которые часто доступны для известных белковые метки. Первичный зонд инкубируется с мембраной таким же образом, как и для первичного антитела в двухэтапном процессе, а затем готов к прямому обнаружению после серии этапов промывки.
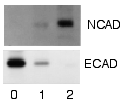
Обнаружение и визуализация
После того, как несвязанные зонды смыты, вестерн-блоттинг готов для обнаружения зондов, которые помечены и связаны с интересующим белком. С практической точки зрения, не все вестерны обнаруживают белок только в одной полосе мембраны. Приближенные размеры берутся путем сравнения окрашенных полос с полосами маркера или лестницы, загруженных во время электрофореза. Этот процесс обычно повторяется для структурного белка, такого как актин или тубулин, который не должен изменяться между образцами. Количество целевого белка составляет нормализованный к структурному белку для контроля между группами. Превосходная стратегия - нормализация общего белка, визуализированного с помощью трихлорэтанола.[20][21] или эпикокконон.[22] Эта практика обеспечивает корректировку количества общего белка на мембране в случае ошибок или неполных переносов. (увидеть нормализация вестерн-блоттинга )
Колориметрическое обнаружение
Метод колориметрического обнаружения зависит от инкубации вестерн-блоттинга с субстратом, который реагирует с репортерным ферментом (например, пероксидаза ), который связан со вторичным антителом. Это превращает растворимый краситель в нерастворимую форму другого цвета, которая осаждается рядом с ферментом и тем самым окрашивает мембрану. Затем развитие пятна останавливают смыванием растворимого красителя. Уровни протеина оцениваются с помощью денситометрия (насколько интенсивно пятно) или спектрофотометрия.
Хемилюминесцентное обнаружение
Хемилюминесцентный Методы обнаружения зависят от инкубации вестерн-блоттинга с субстратом, который будет люминесцировать при воздействии репортера на вторичное антитело. Затем свет обнаруживается камерами CCD, которые фиксируют цифровое изображение вестерн-блоттинга или фотопленки. Использование пленки для вестерн-блоттинга постепенно исчезает из-за нелинейности изображения (неточная количественная оценка). Изображение анализируется с помощью денситометрии, которая оценивает относительное количество окрашивания белка и количественно оценивает результаты с точки зрения оптической плотности. Новое программное обеспечение позволяет проводить дальнейший анализ данных, например анализ молекулярной массы, если используются соответствующие стандарты.

Радиоактивное обнаружение
Для радиоактивных меток не требуются ферментные субстраты, они позволяют размещать медицинскую рентгеновскую пленку непосредственно напротив вестерн-блоттинга, который развивается по мере воздействия на метку и создает темные области, соответствующие интересующим полосам белка (см. Изображение над). Важность методов обнаружения радиоактивных веществ снижается из-за их опасного излучения.[нужна цитата ]Поскольку это очень дорого, риски для здоровья и безопасности высоки, и ECL (усиленная хемилюминесценция) представляет собой полезную альтернативу.
Флуоресцентное обнаружение
Зонд с флуоресцентной меткой возбуждается светом, и излучение возбуждения затем детектируется фотодатчиком, таким как камера CCD, оснащенная соответствующими фильтрами излучения, который захватывает цифровое изображение вестерн-блоттинга и позволяет проводить дальнейший анализ данных, например анализ молекулярной массы и др. количественный вестерн-блот-анализ. Флуоресценция считается одним из лучших методов количественной оценки, но она менее чувствительна, чем хемилюминесценция.[23]
Вторичное зондирование
Одно из основных различий между нитроцеллюлозными и PVDF-мембранами связано со способностью каждой поддерживать «отщепление» антител и повторное использование мембраны для последующих проб антител. Несмотря на то, что существуют хорошо зарекомендовавшие себя протоколы очистки нитроцеллюлозных мембран, более прочный ПВДФ позволяет упростить очистку и использовать повторно до того, как фоновый шум ограничит эксперименты. Другое отличие состоит в том, что, в отличие от нитроцеллюлозы, PVDF перед использованием необходимо вымачивать в 95% этаноле, изопропаноле или метаноле. Мембраны из ПВДФ также имеют тенденцию быть более толстыми и более устойчивыми к повреждениям во время использования.
2-D гель-электрофорез
Двумерный SDS-PAGE использует принципы и методы, изложенные выше. 2-D SDS-PAGE, как следует из названия, включает миграцию полипептидов в двух измерениях. Например, в первом измерении полипептиды разделяются в соответствии с изоэлектрическая точка, тогда как во втором измерении полипептиды разделяются в соответствии с их молекулярный вес. Изоэлектрическая точка данного белка определяется относительным количеством положительно (например, лизин, аргинин) и отрицательно (например, глутамат, аспартат) заряженных аминокислот, причем отрицательно заряженные аминокислоты вносят вклад в низкую изоэлектрическую точку, а положительно заряженные аминокислоты вносят свой вклад до высокой изоэлектрической точки. Образцы также могут быть разделены сначала в невосстанавливающих условиях с использованием SDS-PAGE и в восстанавливающих условиях во втором измерении, которое разрушает дисульфидные связи, удерживающие субъединицы вместе. SDS-PAGE можно также сочетать с мочевиной-PAGE для получения 2-мерного геля.
В принципе, этот метод позволяет разделить все клеточные белки на одном большом геле. Основное преимущество этого метода заключается в том, что он часто различает разные изоформы определенного белка - например, белок, который был фосфорилирован (добавлением отрицательно заряженной группы). Разделенные белки можно вырезать из геля и затем проанализировать с помощью масс-спектрометрии, который определяет их молекулярную массу.
Смотрите также
- Дальневосточная клякса
- Дальневосточный блот
- Восточная клякса
- Северо-западное пятно
- Быстрый параллельный протеолиз
использованная литература
- ^ Алвин Дж, Кемп Д., Старк Дж. (1977). «Метод обнаружения специфических РНК в агарозных гелях путем переноса на диазобензилоксиметилбумагу и гибридизации с ДНК-зондами». Труды Национальной академии наук США. 74 (12): 5350–5354. Bibcode:1977PNAS ... 74.5350A. Дои:10.1073 / пнас.74.12.5350. ЧВК 431715. PMID 414220.
- ^ Burnette WN. (1981). "'Вестерн-блоттинг: электрофоретический перенос белков с додецилсульфат-полиакриламидных гелей натрия на немодифицированную нитроцеллюлозу и радиографическое обнаружение с использованием антител и радиоактивного йода протеина А ». Аналитическая биохимия. 112 (2): 195–203. Дои:10.1016/0003-2697(81)90281-5. ISSN 0003-2697. PMID 6266278.
- ^ а б Towbin H, Staehelin T, Gordon J (1979). «Электрофоретический перенос белков из полиакриламидных гелей на нитроцеллюлозные листы: процедура и некоторые применения». Труды Национальной академии наук США. 76 (9): 4350–54. Bibcode:1979PNAS ... 76.4350T. Дои:10.1073 / пнас.76.9.4350. ЧВК 411572. PMID 388439.
- ^ а б Мориц CP (2020). «40 лет вестерн-блоттингу: тост в день рождения ученых». Журнал протеомики. 212: 103575. Дои:10.1016 / j.jprot.2019.103575. PMID 31706026.
- ^ Судха, Т; Лакшми, S; Тея, В.Д. (2006). «Вестерн-блот-профиль при ВИЧ-инфекции». Индийский журнал дерматологии, венерологии и лепрологии. 72 (5). Дои:10.4103/0378-6323.27752. PMID 17050930. Получено 6 декабря 2020.
- ^ Ингроссо, Лоредана; Ветругно, Вито; Кардоне, Франко; Поккиари, Маурицио (01.06.2002). «Молекулярная диагностика трансмиссивных губчатых энцефалопатий». Тенденции в молекулярной медицине. 8 (6): 273–280. Дои:10.1016 / S1471-4914 (02) 02358-4. PMID 12067613.
- ^ SCHMITT, P .; SPLETTSTÖSSER, W .; PORSCH-ÖZCÜRÜMEZ, M .; FINKE, E.-J .; ГРУНОУ, Р. (16 февраля 2005 г.). «Новый скрининговый ELISA и подтверждающий вестерн-блоттинг, полезные для диагностики и эпидемиологических исследований туляремии». Эпидемиология и инфекция. 133 (4): 759–766. Дои:10.1017 / s0950268805003742. ISSN 0950-2688. ЧВК 2870305. PMID 16050523.
- ^ Арцоб, Харви (1993). «Вестерн-блоттинг как подтверждающий тест на болезнь Лайма». Канадский журнал инфекционных заболеваний. 4 (2): 115–116. Дои:10.1155/1993/796390. ЧВК 3250769. PMID 22346434.
- ^ Кастро, Л. Де; Йошида, C F; Гаспер, А М; Gomes, S.A. (декабрь 1996 г.). «Вестерн-блот-анализ реактивности между белками оболочки вирусов гепатита В от бразильских носителей и антителами против рекомбинантных вакцин против гепатита В». Acta Virol. 40 (5–6). PMID 9171452. Получено 6 декабря 2020.
- ^ Голден, Мэтью; Эшли-Морроу, Рода; Свенсон, Пол; Hogrefe, Wayne R; Хэндсфилд, Хантер; Уолд, Анна (декабрь 2005 г.). «Подтверждающее тестирование вестерн-блоттинга вируса простого герпеса типа 2 (ВПГ-2) среди мужчин с положительным результатом на ВПГ-2 с использованием фокусного иммуноферментного анализа в клинике заболеваний, передающихся половым путем». Венерическая болезнь. 32 (12). Дои:10.1097 / 01.olq.0000175377.88358.f3. Получено 6 декабря 2020.
- ^ «Тестирование FIV - что использовать». Catwork. Получено 6 декабря 2020.
- ^ Бауме, Норберт; Ян, Николас; Эмери, Кэролайн; Манданис, Беатрис; Швейцер, Карин; Жиро, Сильвен; Лойенбергер, Николас; Марклай, Франсуа; Николи, Рауль; Перрену, Лоран; Робинсон, Нил; Дворжак, Иржи; Соги, Марсьяль (2015). «Антидопинговая программа и биологический мониторинг до и во время чемпионата мира по футболу 2014 года в Бразилии». Британский журнал спортивной медицины. 49 (9): 614–622. Дои:10.1136 / bjsports-2015-094762. ISSN 0306-3674. ЧВК 4413745. PMID 25878079.
- ^ Райхель С., Бенетка В., Лоренц Б., Тевис М. (2016). «Оценка антитела против Epo клона AMGEN 9G8A для применения в допинг-контроле». Анальный тест на наркотики. 8 (11–12): 1131–1137. Дои:10.1002 / dta.2057. PMID 27552163.
- ^ https://precisionbiosystems.com/wp-content/uploads/2016/10/Application_Note_Improvements-for-EPO-detection_Schwenke_2015.pdf
- ^ Ренарт Дж., Райзер Дж., Старк Г.Р. (1979). «Перенос белков из гелей на диазобензилоксиметилбумагу и обнаружение с помощью антисыворотки: метод изучения специфичности антител и структуры антигена». Труды Национальной академии наук США. 76 (7): 3116–20. Bibcode:1979ПНАС ... 76.3116Р. Дои:10.1073 / pnas.76.7.3116. ЧВК 383774. PMID 91164.
- ^ а б Мориц, CP. (2017-09-20). «Тубулин или не тубулин: переход к общему окрашиванию белка в качестве контроля загрузки в вестерн-блоттинге» (PDF). Протеомика. 17 (20): 1600189. Дои:10.1002 / pmic.201600189. PMID 28941183.
- ^ Велиндер, Шарлотта; Экблад, Ларс (04.03.2011). «Окрашивание Кумасси как контроль нагрузки в Вестерн-блоттинге». Журнал протеомных исследований. 10 (3): 1416–1419. Дои:10.1021 / pr1011476. ISSN 1535-3893. PMID 21186791.
- ^ а б Махмуд, Тахрин; Ян, Пин-Чанг (сентябрь 2012 г.). "Вестерн-блоттинг: техника, теория и устранение неполадок". N Am J Med Sci. 4 (9): 429–434. Дои:10.4103/1947-2714.100998. ЧВК 3456489. PMID 23050259.
- ^ Амброз К. (20 сентября 2006 г.). «Повышение точности количественной оценки вестерн-блотов» (PDF). Анализ изображений.
- ^ Stennert, E; Арольд, Р. (1973). «Двойной наружный слуховой проход (авторский перевод)». HNO. 21 (10): 293–6. PMID 4769330.
- ^ Gilda, J. E .; Гомес, А. В. (2013). «Окрашивание общего белка без красителей является лучшим контролем нагрузки по сравнению с β-актином для вестерн-блоттинга». Аналитическая биохимия. 440 (2): 186–8. Дои:10.1016 / j.ab.2013.05.027. ЧВК 3809032. PMID 23747530.
- ^ Moritz, C.P .; Marz, S. X .; Reiss, R; Шуленборг, Т; Фриауф, Э (2014). «Окрашивание эпикоккононом: мощный контроль загрузки для вестерн-блотов». Протеомика. 14 (2–3): 162–8. Дои:10.1002 / pmic.201300089. PMID 24339236.
- ^ Мэтьюз, Суреш Т.; Plaisance, Эрик П .; Ким, Таюн (2009). «Системы визуализации для вестернов: хемилюминесценция против инфракрасного обнаружения». Блоттинг и обнаружение белков. Методы молекулярной биологии. 536. Humana Press. С. 499–513. Дои:10.1007/978-1-59745-542-8_51. ISBN 978-1-934115-73-2. PMID 19378087.
внешняя ссылка
| Библиотечные ресурсы около Вестерн иммуноблоттинг |
- Ян, Пин-Чанг; Махмуд, Тахрин (2012). "Вестерн-блот: техника, теория и устранение неполадок". Североамериканский журнал медицинских наук. 4 (9): 429. Дои:10.4103/1947-2714.100998. ISSN 1947-2714. ЧВК 3456489. PMID 23050259.
- «Вестерн-блоттинг». YouTube. Bio-Rad Laboratories. 16 октября 2012 г.
- «Методы блоттинга / Принцип вестерн-блоттинга». YouTube. Биомедицинские и биологические науки. 23 марта 2017.
