Открытие и разработка ингибиторов интегразы - Discovery and development of integrase inhibitors
Эта статья должна быть обновлено. (Ноябрь 2013) |
Первый вирус иммунодефицита человека (ВИЧ ) был зарегистрирован в США в начале 1980-х годов. Было обнаружено множество лекарств для лечения болезни, но мутации в вирусе и сопротивление к лекарствам затруднить развитие. Интеграза вирусный фермент который интегрирует ретровирусную ДНК в клетку-хозяин геном. Ингибиторы интегразы - это новый класс лекарств, используемых для лечения ВИЧ. Первый ингибитор интегразы, ралтегравир, был одобрен в 2007 году, а другие препараты проходили клинические испытания в 2011 году.
История
Организм использует свои иммунная система чтобы защитить себя от бактерий, вирусов и других болезнетворных существ, а когда ему это не удается, возникают болезни иммунодефицита. Одно из таких заболеваний - синдром приобретенного иммунодефицита (СПИД ), который чаще всего возникает в результате заражения вирусом иммунодефицита человека (ВИЧ).[1]Были идентифицированы два тесно связанных типа ВИЧ: ВИЧ-1 и ВИЧ-2. В то время как ВИЧ-2 распространяется в Индии и Западной Африке, ВИЧ-1 более распространен. ядовитый и причина номер один СПИДа во всем мире. Хотя у некоторых пациентов наблюдаются разные результаты, в большинстве случаев у людей, инфицированных ВИЧ, развивается СПИД и в конечном итоге они умирают от оппортунистические инфекции или же рак.Интеграция с ретровирусным геномом имеет решающее значение для экспрессии генов и вирусная репликация. Вирусный геном обратно транскрибируется в ДНК инфицированной клетки вирусным обратная транскриптаза, ДНК затем интегрируется в клетку-хозяин хромосомы с помощью вирусной интегразы. РНК-транскрипты производятся из интегрированной вирусной ДНК и служат как мРНК для управления синтез вирусных белков, а затем и РНК-геномов новых вирусных частиц. Вирусные частицы покидают клетку подающий надежды из плазматической мембраны, каждый заключен в мембрану конверт.[2]
В этом процессе интеграза ВИЧ-1 играет важную роль и поэтому является очень многообещающей мишенью для разработки лекарств против СПИДа. Селективный дизайн лекарств возможен, поскольку интеграза ВИЧ-1 не имеет известного клеточного эквивалента.[3] Было обнаружено и разработано много ингибиторов интегразы, но лишь некоторые из молекул получили дальнейшее развитие. II этап или же фаза III из клинические испытания. Ралтегравир (торговая марка Isentress) получил ускоренное утверждение из США Управление по контролю за продуктами и лекарствами (FDA) в октябре 2007 г. и из региона EMEA (сейчас EMA ) в декабре 2007 г.[4][5] Он был продан как антиретровирусный препарат (АРВ) для взрослых, инфицированных ВИЧ-1, которые уже подвергались как минимум трем классам АРВ-препаратов и продемонстрировали множественную лекарственную устойчивость. В целом существует две основные группы ингибиторов интегразы; Ингибиторы переноса интегразы (INSTI) и ингибиторы связывания интегразы (INBI). INSTI сдерживают связывание преинтеграционного комплекса (ПОС ), а ДНК хозяина и INBI сдерживают связывание интегразы и вирусной ДНК. Ралтегравир - это ингибитор интегразы INSTI, который подавляет репликацию как ВИЧ-1, так и ВИЧ-2. Он более эффективен, чем другие ранее известные ингибиторы интегразы, а также вызывает меньше побочных эффектов. Ралтегравир, Эльвитегравир, Долутегравир и Биктегравир - единственные ингибиторы интегразы ВИЧ-1, используемые для лечения ВИЧ-инфекций. S / GSK1349572.[4][6][7][8]
Фермент интегразы ВИЧ-1
Интеграза ВИЧ-1 (ИН) является ключевым ферментом в механизме репликации ретровирусов.[9] Он отвечает за перенос кодируемой вирусом ДНК в хромосому хозяина, что является необходимым этапом репликации ретровирусов.[10] Поскольку ИН не имеет эквивалента в клетке-хозяине, ингибиторы интегразы обладают высокой терапевтический индекс поскольку они не мешают нормальным клеточным процессам.[11]
Структура
IN принадлежит, как механически, так и структурно, к суперсемейству полинуклеотидилтрансфераз 10 и состоит из 288 аминокислот, которые образуют белок 32 кДа.[9] Ретровирусы кодируют свои ферменты (протеазу, обратную транскриптазу и интегразу) с помощью POL ген с 3'-концом, кодирующим IN.[11]

IN состоит из 3 структурно независимых функциональных доменов (см. Рисунок 1):[9]
1. N-концевой домен (NTD) включает аминокислоты 1–50 и содержит два остатка гистидина (His12 и His16) и два остатка цистеина (Cys40 и Cys43), все из которых абсолютно консервативны и образуют мотив «цинковые пальцы» HHCC.[9][12] Единичные мутации любого из этих четырех остатков снижают ферментативную активность ИН.[11] Мотив цинковых пальцев HHCC хелаты один атом цинка на IN мономер. NTD требуется для более высокого порядка мультимер образование, которое, по-видимому, является его основной ролью.[12][13] Для мультимеризации требуется атом цинка, который стабилизирует складку.[12]
2. Каталитический коровой домен (CCD), который включает аминокислоты 51-212, содержит активный сайт IN, но не может катализировать интеграция в отсутствие NTD и CTD (C-концевой домен).[11] CCD содержит три абсолютно консервативных отрицательно заряженных аминокислоты; D64, D116 и E152.[9] Эти аминокислоты образуют мотив DDE, который координирует ионы двухвалентных металлов (Mg2+ или Mn2+). Эти ионы металлов необходимы для катализа интеграции.[12][13] ПЗС-матрица имеет смешанную β- и α-структуру с пятью β-листы и шесть α спирали которые связаны гибкими петлями.[12] Гибкие петли допускают конформационные изменения, необходимые для 3´ обработка реакций вирусной ДНК и переноса цепи (STF), которые являются двумя ключевыми этапами реакции интеграции.[9] CCD важен для этих стадий, и замена любого из остатков в мотиве DDE резко ингибирует активность IN.[12]
3. С-концевой домен (CTD), который включает аминокислоты 213–288, неспецифически связывает ДНК, и его взаимодействие с NTD и CCD необходимо для процессов процессинга IN 3´ и переноса цепи.[11][12] CTD - наименее консервативный из трех доменов.[12]IN действует как мультимер и димеризация требуется для шага 3´ обработки, с тетрамерный IN катализирует реакцию переноса цепи.
Функция
Интеграция ВИЧ-1 происходит посредством многоступенчатого процесса, который включает две каталитические реакции: 3'-эндонуклеолитический процессинг концов провирусной ДНК (так называемый 3'-процессинг) и интеграция 3'-процессированной вирусной ДНК в клеточную ДНК (называемый переносом цепи).[6] В 3´обработке IN связывается с короткой последовательностью, расположенной на обоих концах длинный терминальный повтор (LTR) вирусной ДНК и катализирует эндонуклеотидное расщепление. Это приводит к удалению динуклеотида с каждого из 3'-концов LTR. Затем расщепленную ДНК используют в качестве субстрата для интеграции или переноса цепи.[9] Strand transfer - это переэтерификация реакция с прямым нуклеофильный атака 3´гидроксигруппы двух недавно обработанных концов 3´-ДНК вируса на фосфодиэфирный остов ДНК-мишени хозяина.[14] Это приводит к ковалентной вставке вирусной ДНК в геном инфицированной клетки. Перенос цепи происходит одновременно на обоих концах молекулы вирусной ДНК со смещением ровно на пять пар оснований между двумя противоположными точками вставки.[9] Реакция интеграции завершается удалением неспаренных динуклеотидов из 5'- концы вирусной ДНК, восстановление одноцепочечных разрывов, созданных между вирусной и целевой молекулами ДНК, и лигирование 3'-концов с 5'-концами ДНК-хозяина.[9][14] Двухвалентные металлы, Mg2+ или Mn2+, необходимы для этапов 3'-процессинга и переноса цепи, а также для сборки IN на специфической вирусной донорской ДНК с образованием комплекса, способного выполнять любую функцию. Поскольку изобилие магния (Mg2+) по сравнению с марганцем (Mn 2+) в человеческих клетках в 1 000 000 раз, магний кажется более доступным двухвалентным кофактором для интеграции.[6]
Механизм действия
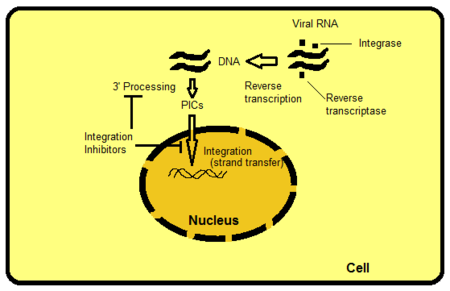
Существует несколько способов воздействия на интегразу, но ингибирование переноса цепи является наиболее интуитивно очевидным и легко реализуемым на сегодняшний день. Другие мишени включают, например, белковые домены за пределами активного сайта IN. Домены взаимодействуют с вирусной ДНК или ДНК хозяина и важны для связывания с ферментом. Можно нарушить функции фермента, разрушив или удалив эти связывания. PIC - это мультимерная белковая структура внутри клетки-хозяина, состоящая как из вирусных, так и из хозяйских белков. Интеграза является частью вирусного компонента PIC. Считается, что вирусные белки и белки-хозяева PIC модулируют внутреннюю активность фермента, перемещают PIC к ядру и прямую интеграцию вирусной ДНК в транскрипционно активную область генома-хозяина. Если бы можно было исключить определенные белки из PIC, это заблокировало бы способность вируса интегрироваться в геном хозяина. Процесс, при котором ретровирусная РНК транскрибируется в ДНК, а затем интегрируется в геном клетки-хозяина, показан на рисунке 2.[8]
Ингибиторы переноса цепи IN (INSTI)
Mg2+ и Mn2+ являются важнейшими кофакторами на этапе интеграции. Инактивация этих кофакторов (например, посредством хелатирования) вызывает функциональное нарушение ИН. Эта концепция дает исследователям возможность конструировать и разрабатывать высокоэффективные ингибиторы ИН (INI). Фактически, все низкомолекулярные INI ВИЧ-1, которые сейчас исследуются, содержат структурный мотив, который координирует два двухвалентных иона магния в активном центре фермента.[6]
Ралтегравир и элвитегравир обладают одним и тем же механизмом действия против интегразы: связываться с активным центром Mg.2+ ионы.[8] Конкурентные ингибиторы напрямую конкурируют с вирусной ДНК за связывание с интегразой, чтобы ингибировать процессинг 3’-конца.[15] При этом ингибиторы полностью блокируют связывание активного центра с ДНК-мишенью. Это торможение называется ингибирование переноса цепи.[8]
Ингибирование взаимодействия LEDGF / p75-интегразы
Фактор роста, полученный из эпителия хрусталика (LEDGF / p75 ) является белком-хозяином, который связывается с интегразой и имеет решающее значение для репликации вируса. Механизм действия точно не известен, но данные свидетельствуют о том, что LEDGF / p75 направляет интегразу для вставки вирусной ДНК в транскрипционно активные сайты генома хозяина. Ингибиторы этого белка уже разрабатываются и запатентованы. Они, вероятно, будут высоко специфичными и менее склонными к развитию устойчивости.[8]
Ингибиторы связывания ИН
Другим классом INI могут быть ингибиторы связывания IN (INBI), такие как V-165. V-165 представляет собой соединение, ингибирующее интеграцию, но без очевидного воздействия на синтез вирусной ДНК. Изучение механизма действия показало, что V-165 препятствует образованию вирусного комплекса ДНК-ИН. Из-за своего мешающего действия он классифицируется как ингибитор связывания ИН. Другие соединения, такие как стирилхинолины, имеют аналогичный механизм, конкурируя с субстратом LTR за связывание IN.[16]
Дизайн лекарств
Привязка
INSTI прочно и специфично связываются с IN, который связан с концами ДНК, хелатируя ионы двухвалентных металлов (Mg2+), которая координируется каталитической триадой, то есть мотивом DDE.[9] Мотив DDE расположен в CCD IN и является активным сайтом фермента, и, следовательно, INSTI являются так называемыми ингибиторами активного сайта. INSTI связываются со специфическим сайтом, близким к мотиву DDE IN, сайтом, который присутствует только в конформации, которая возникает после процессинга 3´ концов вирусной ДНК. Вирусная ДНК вполне может составлять часть сайта связывания ингибитора. Обвязка - это форма аллостерическое торможение поскольку это подразумевает блокировку специфического комплекса интегразы-вирусной ДНК.[12] Это приводит к селективному ингибированию реакции переноса цепи без значительного влияния на реакцию 3´-процессинга.[9] Таким образом, INSTI могут быть более специфичными и избирательно связываться с сайтом связывания целевой ДНК и, следовательно, быть менее токсичными, чем бифункциональные ингибиторы, которые способны связываться как с донорскими, так и с целевыми сайтами связывания.[12]
INBI также связываются с IN, но механизм действия неизвестен, поэтому привязка не может быть подробно описана.[16]
Взаимосвязь структурной деятельности (SAR)

Для связывания интегразы необходимы два структурных компонента: гидрофобный бензил фрагмент, который закапывается в высокогидрофобный карман рядом с активным центром; и хелатная триада, связывающаяся с двумя Mg2+ ионы в довольно гидрофильный области, закрепляющей ингибитор на поверхности белка (см. рисунок 3).[17] Фактически, все мощные ингибиторы интегразы содержат замещенный бензильный компонент, который имеет решающее значение для поддержания активности 3'-конца присоединения. Удаление бензильной группы предотвращает ингибирующую функцию.[15] Липофильный заместители поэтому полезны для ингибирования переноса цепи, в частности тиофенил, фуранил и (тиофен-2-ил) фенильные замещения. Гетероароматический амин и амид также вызывают усиление ингибирующего действия 3 'процессинга.[6]
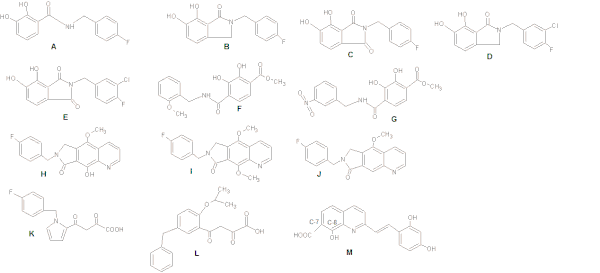
При исследовании ингибиторов ИН на основе катехинов было обнаружено, что поддержание плоской связи с бис-гидроксилированным арильным кольцом увеличивает эффективность. Ингибирующая активность может быть дополнительно оптимизирована путем включения метахлор-заместителя, усиливающего взаимодействие бензильной группы с соседним гидрофобным карманом (см. Рисунок 4: Структуры A-G).[8]
Бензилзамещенная гидроксильная группа (рис. 4 H) улучшает способность к хелатированию металлов (по сравнению со структурой J на рис. 4), в то время как метоксигруппа (I) гораздо менее эффективна из-за стерического конфликта дополнительной метильной группы с каталитическими металлами .[15]
При исследовании дикето производные, центральный пиррольное кольцо структуры К на рис. 4 был заменен серией ароматических систем, имеющих различные схемы замещения. Это обеспечивало оптимальную относительную ориентацию цепи сайтов бензила и дикетокислоты (DKA). Структура L на рис. 4 привел к 100-кратному увеличению активности.[18]
Бенард и другие (2004) синтезировали INI с хинолин субъединица и вспомогательное ароматическое кольцо, связанные функционализированными спейсерами, такими как амид, гидразид, мочевина и фрагмент гидроксипроп-1-ен-3-она. Они обнаружили, что дервивативы, содержащие амидную группу, являются наиболее перспективными.[18][19] Синтезируя серию стирилхинонов, исследователи обнаружили, что для ингибирования требуются карбоксильная группа в C-7, гидроксильная группа в C-8 в субъединице хинолина и вспомогательное фенильное кольцо (Рисунок 4: Структура M), хотя изменения кольца являются терпимо. Две гидроксильные группы на вспомогательном фенильном кольце также необходимы для ингибирующего действия.[18]
Фармакофор

Поскольку информация о критических структурах катализа интегразы ВИЧ недостаточна, трудно найти точную информацию. фармакофор для его торможения. Ван и другие (2010) надеялись, что, изучая SAR и фармакофор каркаса с двумя ингибиторами, уделяя особое внимание интегразе и обратной транскриптазе (RT), можно будет наблюдать активность против интегразы. Изучая SAR ингибиторов интегразы ВИЧ, можно было обнаружить, что для оптимального ингибирования интегразы фармакофор требует региоспецифической (N-1) DKA определенной длины. Функционал DKA или его гетероциклический биоизостер которые избирательно ингибируют перенос цепи, по-видимому, присутствуют во всех основных хемотипы ингибиторов интегразы.[17] Как подробно описано в обсуждении SAR выше, двумя необходимыми структурными компонентами INI являются бензилгидрофобный фрагмент и хелатирующая триада для связывания Mg2+ ионы. Чтобы триада связала Mg2+ ионы должны быть ионизированы (см. рис. 5) и, следовательно, биоизостер фармакофоров также должен быть ионизирован, а биоизостер фармакофоров бензила должен быть очень гидрофобным.[11][17]
Однако, несмотря на предыдущие успехи в клинической разработке (ралтегравир), детальная модель связывания отсутствует, поэтому оказалось трудным структурировать основу дизайна ингибиторов интегразы. Когда фармакофор салициловой кислоты и катехола были объединены, были созданы новые химические основы. Соседние гидроксильные и карбоксильные группы салициловой кислоты могут связываться с ионами металлов и служить их фармакофором. Полигидроксилированные ароматические ингибиторы в основном активны против реакций переноса цепи и 3’-процессинга, что предполагает механизм, нацеленный на обе стадии. Это очень важная часть соединения, так как она может использоваться для связывания с двухвалентным металлом в активном центре ИН и, как таковая, быть эффективной против вирусных штаммов, устойчивых к специфическим ингибиторам переноса цепи.[6][17]
Сопротивление
Было обнаружено, что более 60 вариантов мутаций INSTI вызывают in vivo и in vitro сопротивление. Из-за этих мутаций и развития резистентности ингибиторы менее эффективны против вируса.[9]Устойчивость к INI соответствует устойчивости к другим АРВ-препаратам. Первая резистентность к IN вызывается первичными мутациями, которые снижают чувствительность к INI, в сочетании с вторичными мутациями, которые дополнительно снижают чувствительность к вирусу и / или восстанавливают пониженную пригодность вируса. Во-вторых, существует генетический барьер для устойчивости к INI, определяемый количеством мутаций, необходимых для потери клинической активности INI. В-третьих, обширная, но неполная перекрестное сопротивление среди INI.[13]Петля, содержащая аминокислотные остатки 140–149, расположена в домене каталитического ядра и важна для функции IN, как упоминалось ранее. Эта петля является гибкой, и хотя ее роль не совсем известна, считается, что она важна, а ее функции - критическими для связывания ДНК. Эта устойчивость проявляется в мутациях в этой кодирующей области IN.[9]Устойчивость к ралтегравиру и элвитегравиру в первую очередь обусловлена одними и теми же двумя путями мутаций, но для каждого из препаратов также присутствуют другие первичные мутации.[10] Некоторые мутации повышают устойчивость к лекарствам в большей степени, чем другие. Например, один из наиболее распространенных путей мутации увеличивает устойчивость к ралтегравиру до 100 раз по сравнению со вторым по распространенности.[9]Устойчивость к ингибитору интегразы S / GSK1349572 все еще разрабатывается, и устойчивость не была полностью охарактеризована. Когда его оценивали вместе с первичными мутациями ралтегравира и элвитегравира, он не показал перекрестной устойчивости, что означает, что он может быть полезен против вирусов, устойчивых к лекарствам.[7]Ралтегравир имеет ограниченную абсорбцию в кишечнике, поэтому резистентность нельзя преодолеть назначением более высоких доз. Более новые препараты должны преодолеть этот фармакологический недостаток и получить достаточно высокие концентрации в плазме, чтобы воздействовать на устойчивые к ралтегравиру вирусы.[7]
Текущее состояние

Поиск новых путей улучшения лечения пациентов, инфицированных ВИЧ, продолжается. Учитывая накопленный с 1980-х годов опыт разработки АРВ-препаратов, появление INSTI в качестве нового мощного класса АРВ-препаратов знаменует новую эру в лечении ВИЧ. Разработка успешного лечения INSTI была завершена, когда ралтегравир был открыт компанией Merck Sharp & Dohme Limited.[12] Условное маркетинговое разрешение было выдано Европейской комиссией в декабре 2007 года, и действовало на протяжении всего Евросоюз.[20] В 2009 году это разрешение было преобразовано в полное разрешение на продажу и в том же году FDA изменило разрешение с ускоренного на традиционное и внесло препарат в список АРВ-препаратов первого ряда.[12][21] Второй препарат INSTI, элвитегравир, был идентифицирован Japan Tobacco, и клинические испытания начались в 2005 году. В 2011 году препарат все еще находился на третьей фазе клинических испытаний, где его сравнивают с ралтегравиром на испытуемых, прошедших лечение, а также на второй стадии разработки. у наивных субъектов в составе комбинированного лечения.[12] S / GSK1349572 - ингибитор интегразы, открытый ViiV / Shinongi, который вступал в третью фазу клинических испытаний в 2011 году. Этот новый препарат многообещающий, хорошо переносится и пока показывает лучшие результаты, чем ралтегравир и элвитегравир.[22]
Поскольку возникли проблемы с устойчивостью к ралтегравиру и элвитегравиру, ученые начали работу над новыми ингибиторами интегразы второго поколения, такими как МК-2048 который в 2009 году был разработан компанией Merck. Это прототип INSTI второго поколения, который остается эффективным против вирусов, содержащих мутации против ралтегравира и элвитегравира. Механизм действия и SAR MK-2048 такие же, как и у других INSTI, структура MK-2048 показана на рисунке 6 с выделенным основным фармакофором.[23][24]
Несмотря на то, что лекарственные средства, описанные выше, многообещают, разработке предстоит пройти долгий путь, и многое еще не известно об эффективности, безопасности и механизме действия этих лекарств.[7]
Смотрите также
Рекомендации
- ^ Джонсон, Ди Англауб Сильверторн; с Уильямом С. Обером, координатором иллюстраций; Клэр У. Гаррисон, иллюстратор; Эндрю С. Силверторн, клинический консультант; при участии Брюса Р. (2007). Физиология человека: комплексный подход (4-е изд.). Сан-Франциско: Пирсон / Бенджамин Каммингс. ISBN 978-0-8053-6849-9.
- ^ Мерфи, Кеннет; Трэверс, Пол; Уолпорт, Марк (2008). Иммунобиология Джейнвей (7-е изд.). Нью-Йорк: Наука Гарланд. ISBN 978-0-8153-4123-9.
- ^ Поммье, Y; Маршан, К; Neamati, N (сентябрь 2000 г.). «Ингибиторы ретровирусной интегразы 2000 г .: актуализация и перспективы». Противовирусные исследования. 47 (3): 139–48. Дои:10.1016 / S0166-3542 (00) 00112-1. PMID 10974366.
- ^ а б Домбровска, Магдалена Моника; Верчинская-Драпало, Алисия (1 января 2007 г.). «Ингибиторы интегразы как новый класс АРВ терапии». Обзор ВИЧ и СПИДа. 6 (4): 10–14. Дои:10.1016 / S1730-1270 (10) 60053-7.
- ^ «Одобрение FDA Isentress (ралтегравир)». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Получено 25 сен 2011.
- ^ а б c d е ж Fan, X; Zhang, FH; Аль-Сафи, Род-Айленд; Цзэн, LF; Шабаик, Ы; Дебнат, B; Санчес, TW; Odde, S; Neamati, N; Лонг, YQ (15.08.2011). «Разработка ингибиторов интегразы ВИЧ-1, нацеленных на каталитический домен, а также его взаимодействие с LEDGF / p75: подход с перескоком каркаса с использованием салицилатных и катехоловых групп». Биоорганическая и медицинская химия. 19 (16): 4935–52. Дои:10.1016 / j.bmc.2011.06.058. ЧВК 3163123. PMID 21778063.
- ^ а б c d Lenz, JC; Rockstroh, JK (апрель 2011 г.). «S / GSK1349572, новый ингибитор интегразы для лечения ВИЧ: перспективы и проблемы». Заключение эксперта по исследуемым препаратам. 20 (4): 537–48. Дои:10.1517/13543784.2011.562189. PMID 21381981.
- ^ а б c d е ж Пендри, А; Мэнвелл, штат Северная Каролина; Пиз, км; Уокер, Массачусетс (август 2011 г.). «Новые ингибиторы первого и второго поколения интегразы вируса иммунодефицита человека-1». Экспертное заключение о терапевтических патентах. 21 (8): 1173–89. Дои:10.1517/13543776.2011.586631. PMID 21599420.
- ^ а б c d е ж грамм час я j k л м п Mouscadet, JF; Делелис, О; Marcelin, AG; Чертанов, Л. (август – октябрь 2010 г.). «Устойчивость к ингибиторам интегразы ВИЧ-1: структурная перспектива». Обновления лекарственной устойчивости: обзоры и комментарии по антимикробной и противоопухолевой химиотерапии. 13 (4–5): 139–50. Дои:10.1016 / j.drup.2010.05.001. PMID 20570551.
- ^ а б Cocohoba, J; Донг, Би Джей (октябрь 2008 г.). «Ралтегравир: первый ингибитор интегразы ВИЧ». Клиническая терапия. 30 (10): 1747–65. Дои:10.1016 / j.clinthera.2008.10.012. PMID 19014832.
- ^ а б c d е ж Помье, Ив; Johnson, Allison A .; Маршан, Кристоф (24 февраля 2005 г.). «Ингибиторы интегразы для лечения ВИЧ / СПИДа». Обзоры природы Drug Discovery. 4 (3): 236–248. Дои:10.1038 / nrd1660. PMID 15729361.
- ^ а б c d е ж грамм час я j k л м Макколл, диджей; Чен, X (январь 2010 г.). «Ингибиторы переноса цепи интегразы ВИЧ-1: открывая новую эру антиретровирусной терапии». Противовирусные исследования. 85 (1): 101–18. Дои:10.1016 / j.antiviral.2009.11.004. PMID 19925830.
- ^ а б c Blanco, JL; Varghese, V; Rhee, SY; Gatell, JM; Шафер, RW (01.05.2011). «Устойчивость к ингибитору интегразы ВИЧ-1 и ее клинические последствия». Журнал инфекционных болезней. 203 (9): 1204–14. Дои:10.1093 / infdis / jir025. ЧВК 3069732. PMID 21459813.
- ^ а б Де Лука, Лаура; Де Грация, Сара; Ферро, Стефания; Гитто, Розария; Господи, фрауке; Дебизер, Зегер; Чимирри, Альба (февраль 2011 г.). «Ингибиторы переноса цепи интегразы ВИЧ-1: дизайн, синтез и молекулярное моделирование». Европейский журнал медицинской химии. 46 (2): 756–764. Дои:10.1016 / j.ejmech.2010.12.012. PMID 21227550.
- ^ а б c Чен, Х; Цзян, М; Ю, Ф; Hung, M; Джонс, GS; Зейналзадеган, А; Ци, Х; Джин, H; Ким, CU; Сваминатан, S; Чен, JM (2008-07-11). «Моделирование, анализ и валидация новой структуры интегразы ВИЧ дают представление о способах связывания мощных ингибиторов интегразы». Журнал молекулярной биологии. 380 (3): 504–19. Дои:10.1016 / j.jmb.2008.04.054. PMID 18565342.
- ^ а б Hombrouck, A .; Hantson, A .; van Remoortel, B .; Michiels, M .; Vercammen, J .; Rhodes, D .; Tetz, V .; Engelborghs, Y .; Христос, F .; Дебизер, З .; Витвроу, М. (июнь 2007 г.). «Селекция вируса иммунодефицита человека типа 1 против пиранодипиримидина V-165 указывает на мультимодальный механизм действия». Журнал антимикробной химиотерапии. 59 (6): 1084–95. Дои:10.1093 / jac / dkm101. PMID 17470918.
- ^ а б c d Ван, З; Тан, Дж; Salomon, CE; Dreis, CD; Винс, Р. (2010-06-15). «Фармакофор и взаимосвязь между структурой и активностью ингибирования интегразы в двойном каркасе ингибиторов обратной транскриптазы ВИЧ и интегразы». Биоорганическая и медицинская химия. 18 (12): 4202–11. Дои:10.1016 / j.bmc.2010.05.004. PMID 20576573.
- ^ а б c Дубей, S; Сатьянараяна, Ю. Д.; Lavania, H (сентябрь 2007 г.). «Разработка ингибиторов интегразы для лечения СПИДа: обзор». Европейский журнал медицинской химии. 42 (9): 1159–68. Дои:10.1016 / j.ejmech.2007.01.024. PMID 17367896.
- ^ Bénard, C; Zouhiri, F; Норманд-Бейль, М; Данет, М; Desmaële, D; Лех, Н; Mouscadet, JF; Мбемба, G; Thomas, CM; Bonnenfant, S; Ле Брет, М; д'Анджело, Дж. (17 мая 2004 г.). «Модифицированные линкером производные хинолина, нацеленные на интегразу ВИЧ-1: синтез и биологическая активность». Письма по биоорганической и медицинской химии. 14 (10): 2473–6. Дои:10.1016 / j.bmcl.2004.03.005. PMID 15109635.
- ^ "Изентресс" (PDF). Европейское агентство по лекарствам. Получено 17 сен 2011.
- ^ «Традиционное одобрение Isentress (ралтегравир)». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Получено 25 сен 2011.
- ^ Барнхарт, Мэтью; Джеймс Шелтон (апрель 2011 г.). «Улучшение АРТ, улучшающее схемы антиретровирусной терапии для увеличения глобального доступа к лечению ВИЧ». Журнал исследований СПИДа и ВИЧ. 3 (4): 71–78.
- ^ Бар-Маген, Т; Sloan, RD; Донахью, DA; Kuhl, BD; Забейда, А; Сюй, Н; Oliveira, M; Хазуда, диджей; Вайнберг, Массачусетс (сентябрь 2010 г.). «Выявление новых мутаций, ответственных за устойчивость к МК-2048, ингибитору интегразы ВИЧ-1 второго поколения». Журнал вирусологии. 84 (18): 9210–6. Дои:10.1128 / JVI.01164-10. ЧВК 2937597. PMID 20610719.
- ^ Goethals, O; Вос, А; Ван Гиндерен, М; Geluykens, P; Смитс, В; Schols, D; Хертогс, К; Клейтон, Р. (05.07.2010). «Первичные мутации, отобранные in vitro с помощью ралтегравира, приводят к значительным кратным изменениям чувствительности к ингибиторам интегразы первого поколения, но незначительные кратные изменения к ингибиторам с профилями устойчивости второго поколения». Вирусология. 402 (2): 338–46. Дои:10.1016 / j.virol.2010.03.034. PMID 20421122.
