MT-ATP8 - Википедия - MT-ATP8

| Белок АТФ-синтазы 8 (метазоа) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | ATP-synt_8 | ||||||||
| Pfam | PF00895 | ||||||||
| Pfam клан | CL0255 | ||||||||
| ИнтерПро | IPR001421 | ||||||||
| |||||||||
| Субъединица 8 F0 растительной АТФ-синтазы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | YMF19 | ||||||||
| Pfam | PF02326 | ||||||||
| Pfam клан | CL0255 | ||||||||
| ИнтерПро | IPR003319 | ||||||||
| |||||||||
| Грибковый белок АТФ-синтазы 8 (A6L) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Fun_ATP-synt_8 | ||||||||
| Pfam | PF05933 | ||||||||
| Pfam клан | CL0255 | ||||||||
| ИнтерПро | IPR009230 | ||||||||
| |||||||||
MT-ATP8 (или же ATP8) это митохондриальный ген с полным названием «митохондриально кодируемая субъединица мембраны АТФ-синтазы 8», которая кодирует субъединицу митохондриальная АТФ-синтаза, АТФ-синтаза Fо субъединица 8 (или же субъединица A6L). Эта субъединица принадлежит Fо комплекс большого трансмембранного F-типа АТФ-синтаза.[2] Этот фермент, также известный как комплекс V, отвечает за заключительный этап окислительного фосфорилирования в электронная транспортная цепь. В частности, один сегмент АТФ-синтазы позволяет положительно заряженным ионы, называется протоны, чтобы течь через специализированную мембрану внутри митохондрий. Другой сегмент фермента использует энергию, создаваемую этим потоком протонов, для преобразования молекулы, называемой аденозиндифосфат (ADP) в АТФ.[3] Субъединица 8 отличается последовательность между Metazoa, растения и Грибы.
Структура
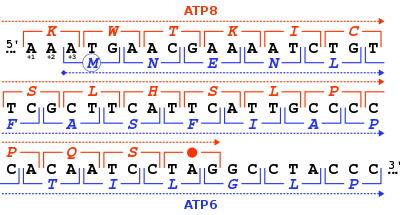
Белок АТФ-синтазы 8 человека и других млекопитающих кодируется в митохондриальный геном посредством MT-ATP8 ген. Когда был впервые опубликован полный митохондриальный геном человека, MT-ATP8 ген был описан как неопознанный рамка чтения URF A6L.[2] Необычная особенность MT-ATP8 ген является его 46-нуклеотидным перекрытием с MT-ATP6 ген. Что касается рамки считывания (+1) MT-ATP8, то MT-ATP6 ген начинается в рамке считывания +3.
Белок MT-ATP8 весит 8 кДа и состоит из 68 аминокислоты.[4][5] Белок является субъединицей F1Fо АТФаза, также известная как Комплекс V, который состоит из 14 ядерных и 2 митохондриально кодируемых субъединиц. АТФазы F-типа состоят из двух структурных доменов F1 содержащее внемембранное каталитическое ядро и Fо содержащий мембранный протонный канал, связанный между собой центральным стержнем и периферическим стержнем. Как субъединица A, MT-ATP8 содержится в некаталитическом трансмембранный Fо часть комплекса, включающая протонный канал. Каталитическая часть митохондриальной АТФ-синтазы состоит из 5 различных субъединиц (альфа, бета, гамма, дельта и эпсилон), собранных со стехиометрией 3 альфа, 3 бета и одного представителя остальных 3. Протонный канал состоит из трех основные субъединицы (а, б, в). Этот ген кодирует дельта-субъединицу каталитического ядра. Были идентифицированы альтернативно сплайсированные варианты транскриптов, кодирующие ту же изоформу.[6][3]
Функция
MT-ATP8 ген кодирует субъединицу митохондриальной АТФ-синтаза, расположенный в тилакоидная мембрана и внутренняя митохондриальная мембрана. Митохондриальная АТФ-синтаза катализирует Синтез АТФ с использованием электрохимический градиент из протоны через внутреннюю мембрану во время окислительного фосфорилирования.[6] Fо область вызывает вращение F1, который имеет водорастворимый компонент, который гидролизует АТФ, и вместе F1Fо создает путь для движения протонов через мембрану.[7]
Этот белок подузел является неотъемлемым компонентом стержня статора в дрожжи митохондриальный F-АТФазы.[8] Стержень статора закреплен в мембрана, и действует для предотвращения бесполезного вращения субъединиц АТФазы относительно ротора во время сопряженного синтеза / гидролиза АТФ. Эта субъединица может выполнять аналогичную функцию в Metazoa.
Номенклатура
В номенклатура фермента имеет долгую историю. F1 Фракция получила свое название от термина "Дробь 1" и Fо (записывается как нижняя буква «о», а не «ноль») получил свое название от обязательной дроби для олигомицин, тип природного антибиотика, который способен ингибировать Fо единица АТФ-синтазы.[9][10] Fо Область АТФ-синтазы - это протонная пора, встроенная в митохондриальную мембрану. Он состоит из трех основных субъединиц A, B и C и (у человека) шести дополнительных субъединиц, d, е, ж, грамм, MT-ATP6 (или F6) и MT-ATP8 (или A6L). 3D структура Кишечная палочка гомолог этой субъединицы был смоделирован на основе электронная микроскопия данные (цепочка M из PDB: 1c17). Он образует трансмембранный 4-α-пучок.
Клиническое значение
Мутации в MT-ATP8 и других генах, влияющих на окислительного фосфорилирования в митохондриях связаны с различными нейродегенеративный и сердечно-сосудистый нарушения, включая дефицит митохондриального комплекса V, Наследственная оптическая нейропатия Лебера (LHON), митохондриальная энцефаломиопатия с эпизодами инсульта (МЕЛАС ), Синдром Ли, и НАРП синдром. Большинство клеток тела содержат тысячи митохондрий, каждая из которых имеет одну или несколько копий митохондриальная ДНК. Серьезность некоторых митохондриальные нарушения связан с процентом митохондрий в каждой клетке, которая имеет определенное генетическое изменение. Люди с Синдром Ли из-за мутации гена MT-ATP6, как правило, очень высокий процент митохондрий с мутацией (от более чем 90 процентов до 95 процентов). Менее серьезные особенности НАРП возникают в результате более низкого процента митохондрий с мутацией, обычно от 70 до 90 процентов. Поскольку эти два состояния являются результатом одних и тех же генетических изменений и могут возникать у разных членов одной семьи, исследователи полагают, что они могут представлять собой спектр перекрывающихся признаков вместо двух различных синдромов.[3]
Дефицит митохондриального комплекса V проявляется гетерогенными клиническими проявлениями, включая: невропатия, атаксия, гипертрофическая кардиомиопатия. Гипертрофическая кардиомиопатия может проявляться от незначительной до крайней степени. гипертрофия, от минимального до обширного фиброз и миоцит беспорядок, отсутствие тяжелой обструкции выходного тракта левого желудочка и отчетливые контуры / морфологии перегородки с чрезвычайно различным клиническим течением.[11][12]
Недостаток митохондриального комплекса V - это недостаток (дефицит) или потеря функции в комплекс V из электронная транспортная цепь что может вызвать самые разные Признаки и симптомы затрагивая многие органы и системы организма, особенно нервная система и сердце. Расстройство может быть опасным для жизни в младенчестве или раннем детстве. У больных могут быть проблемы с кормлением, медленный рост, низкий мышечный тонус (гипотония ), крайняя утомляемость (летаргия ), и отставание в развитии. Они склонны к развитию повышенного уровня молочная кислота в крови (лактоацидоз ), что может вызвать тошноту, рвоту, слабость и учащенное дыхание. Высокий уровень аммиак в крови (гипераммониемия ) также может возникать у пораженных людей и в некоторых случаях приводить к нарушению функции мозга (энцефалопатия ) и повреждение других органов.[13] Атаксия, микроцефалия, задержка развития и умственная отсталость наблюдались у пациентов с мутацией сдвига рамки считывания в MT-ATP6. Это вызывает вставку C в положение 8612, что приводит к усеченному белку длиной всего 36 аминокислот и двум T> C однонуклеотидные полиморфизмы в положениях 8610 и 8614, что приводит к гомополимерному цитозин протяжение.[14]
Гипертрофическая кардиомиопатия, общая черта дефицита митохондриального комплекса V, характеризуется утолщением (гипертрофия ) из сердечная мышца что может привести к сердечная недостаточность.[13] Мутация m.8528T> C возникает в перекрывающейся области генов MT-ATP6 и MT-ATP8 и была описана у нескольких пациентов с детской кардиомиопатией. Эта мутация изменяет кодон инициации в MT-ATP6 на треонин а также изменение с триптофан к аргинин в позиции 55 MT-ATP8.[15][12] Люди с дефицитом митохондриального комплекса V также могут иметь характерный рисунок черт лица, включая высокий лоб, изогнутые брови, внешние углы глаз, направленные вниз (наклон вниз). глазные щели ), выступающая переносица, низко посаженные уши, тонкие губы и небольшой подбородок (микрогнатия ).[13]
Инфантильная гипертрофическая кардиомиопатия (CMHI) также вызывается мутациями, затрагивающими различные генетические локусы, включая MT-ATP6 и MT-ATP8. Инфантильная форма гипертрофическая кардиомиопатия, заболевание сердца, характеризующееся гипертрофия желудочков, который обычно асимметричен и часто включает межжелудочковая перегородка. Симптомы включают: одышка, обморок, крах, сердцебиение, и грудная боль. Их легко спровоцировать упражнения. Заболевание имеет межсемейную и внутрисемейную изменчивость от доброкачественных до злокачественных форм с высоким риском сердечная недостаточность и внезапная сердечная смерть.[11][12]
Рекомендации
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б Андерсон С., Банкир А.Т., Баррелл Б.Г., де Брюин М.Х., Колсон А.Р., Друин Дж., Эперон И.К., Нирлих Д.П., Роу Б.А., Сэнгер Ф., Шрайер П.Х., Смит А.Дж., Стаден Р., Янг И.Г. (апрель 1981 г.). «Последовательность и организация митохондриального генома человека». Природа. 290 (5806): 457–65. Bibcode:1981Натура.290..457A. Дои:10.1038 / 290457a0. PMID 7219534. S2CID 4355527.
- ^ а б c «МТ-АТФ8». Домашний справочник по генетике. NCBI.
- ^ Zong NC, Li H, Li H, Lam MP, Jimenez RC, Kim CS, Deng N, Kim AK, Choi JH, Zelaya I, Liem D, Meyer D, Odeberg J, Fang C, Lu HJ, Xu T, Weiss J , Дуан Х., Улен М., Йейтс Дж. Р., Апвейлер Р., Ге Дж., Хермякоб Х., Пинг П. (октябрь 2013 г.). «Интеграция биологии кардиального протеома и медицины посредством специализированной базы знаний». Циркуляционные исследования. 113 (9): 1043–53. Дои:10.1161 / CIRCRESAHA.113.301151. ЧВК 4076475. PMID 23965338.
- ^ «Белок АТФ-синтазы 8». Атлас кардиоорганических белков (COPaKB).
- ^ а б «MT-ATP8, митохондриально кодируемая АТФ-синтаза 8 [Homo sapiens (человек)]». Ген. NCBI.
- ^ Velours J, Paumard P, Soubannier V, Spannagel C, Vaillier J, Arselin G, Graves PV (май 2000 г.). «Организация дрожжевой АТФ-синтазы F (0): исследование, основанное на мутантах цистеина, модификации тиола и сшивающих реагентах». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1458 (2–3): 443–56. Дои:10.1016 / S0005-2728 (00) 00093-1. PMID 10838057.
- ^ Стивенс А.Н., Хан М.А., Роуку X, Нагли П., Девениш Р.Дж. (май 2003 г.). «Молекулярное окружение субъединицы 8 дрожжевой митохондриальной F1F0-АТФ-синтазы, исследованное с помощью цистеинового сканирующего мутагенеза и химической модификации». Журнал биологической химии. 278 (20): 17867–75. Дои:10.1074 / jbc.M300967200. PMID 12626501.
- ^ Кагава Ю., Ракер Е. (май 1966 г.). «Частичное разрешение ферментов, катализирующих окислительное фосфорилирование. 8. Свойства фактора, придающего чувствительность к олигомицину митохондриальной аденозинтрифосфатазе». Журнал биологической химии. 241 (10): 2461–6. PMID 4223640.
- ^ Маккарти RE (ноябрь 1992 г.). "ВЗГЛЯД БИОХИМИКА РАСТЕНИЙ НА Н + -АТФАЗЫ И СИНТАЗЫ АТФ". Журнал экспериментальной биологии. 172 (Pt 1): 431–441. PMID 9874753.
- ^ а б «MT-ATP8 - белок АТФ-синтазы 8 - Homo sapiens (Human)». www.uniprot.org. UniProt. Получено 3 августа 2018.
 Эта статья включает текст, доступный под CC BY 4.0 лицензия.
Эта статья включает текст, доступный под CC BY 4.0 лицензия. - ^ а б c Уэр С.М., Эль-Хасан Н., Калер С.Г., Чжан К., Ма Ю.В., Миллер Э., Вонг Б., Спайсер Р.Л., Крейген В.Дж., Козел Б.А., Гранж Д.К., Вонг Л.Дж. (май 2009 г.). «Детская кардиомиопатия, вызванная мутацией в перекрывающейся области митохондриальных генов АТФазы 6 и 8». Журнал медицинской генетики. 46 (5): 308–14. Дои:10.1136 / jmg.2008.063149. PMID 19188198. S2CID 25354118.
- ^ а б c «Дефицит митохондриального комплекса V». Домашний справочник по генетике. NCBI. Получено 3 августа 2018.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ Джексон CB, Хан Д., Шретер Б., Рихтер Ю., Баттерсби Б. Дж., Шмитт-Мечелке Т., Марттинен П., Нуоффер Дж. М., Шаллер А. (июнь 2017 г.). «Новая митохондриальная мутация сдвига рамки считывания АТР6, вызывающая изолированный дефицит комплекса V, атаксию и энцефаломиопатию». Европейский журнал медицинской генетики. 60 (6): 345–351. Дои:10.1016 / j.ejmg.2017.04.006. HDL:10138/237062. PMID 28412374.
- ^ Имаи А., Фудзита С., Кишита Ю., Кода М., Токудзава Ю., Хирата Т., Мизуно Ю., Харашима Х, Накая А., Саката Ю., Такеда А., Мори М., Мураяма К., Отаке А., Окадзаки Ю. (март 2016 г.). «Быстро прогрессирующая детская кардиомиопатия с дефицитом комплекса V митохондриальной дыхательной цепи из-за потери белка АТФазы 6 и 8». Международный журнал кардиологии. 207: 203–5. Дои:10.1016 / j.ijcard.2016.01.026. PMID 26803244.
дальнейшее чтение
- Торрони А., Ахилли А., Маколей В., Ричардс М., Бандельт Х. Дж. (Июнь 2006 г.). «Сбор плодов дерева мтДНК человека». Тенденции в генетике. 22 (6): 339–45. Дои:10.1016 / j.tig.2006.04.001. PMID 16678300.
- Bodenteich A, Mitchell LG, Polymeropoulos MH, Merril CR (май 1992 г.). «Динуклеотидный повтор в митохондриальной D-петле человека». Молекулярная генетика человека. 1 (2): 140. Дои:10.1093 / hmg / 1.2.140-а. PMID 1301157.
- Лу X, Уокер Т., Макманус Дж. П., Селиги В. Л. (июль 1992 г.). «Дифференциация клеток аденокарциномы толстой кишки человека HT-29 коррелирует с повышенной экспрессией митохондриальной РНК: эффекты трегалозы на рост и созревание клеток». Исследования рака. 52 (13): 3718–25. PMID 1377597.
- Марзуки С., Ноер А.С., Лертрит П., Тьягараджан Д., Капса Р., Уттанапхол П., Бирн Э. (декабрь 1991 г.). «Нормальные варианты митохондриальной ДНК человека и продукты трансляции: создание справочной базы данных». Генетика человека. 88 (2): 139–45. Дои:10.1007 / bf00206061. PMID 1757091. S2CID 28048453.
- Мораес С.Т., Андреетта Ф., Бонилла Э., Шанске С., ДиМауро С., Шон Э.А. (март 1991 г.). «Компетентная к репликации митохондриальная ДНК человека без промоторной области тяжелой цепи». Молекулярная и клеточная биология. 11 (3): 1631–7. Дои:10.1128 / MCB.11.3.1631. ЧВК 369459. PMID 1996112.
- Attardi G, Chomyn A, Doolittle RF, Mariottini P, Ragan CI (1987). «Семь неопознанных рамок считывания митохондриальной ДНК человека кодируют субъединицы НАДН-дегидрогеназы дыхательной цепи». Симпозиумы Колд-Спринг-Харбор по количественной биологии. 51, Чт 1 (1): 103–14. Дои:10.1101 / sqb.1986.051.01.013. PMID 3472707.
- Чомин А., Клитер М.В., Рэган К.И., Райли М., Дулиттл Р.Ф., Аттарди Дж. (Октябрь 1986 г.). «URF6, последняя неопознанная рамка считывания мтДНК человека, кодирует субъединицу НАДН-дегидрогеназы». Наука. 234 (4776): 614–8. Bibcode:1986Наука ... 234..614C. Дои:10.1126 / science.3764430. PMID 3764430.
- Чомин А., Мариоттини П., Клитер М.В., Раган К.И., Мацуно-Яги А., Хатефи Ю., Дулиттл Р.Ф., Аттарди Г. (1985). «Шесть неопознанных рамок считывания митохондриальной ДНК человека кодируют компоненты НАДН-дегидрогеназы дыхательной цепи». Природа. 314 (6012): 592–7. Bibcode:1985Натура.314..592С. Дои:10.1038 / 314592a0. PMID 3921850. S2CID 32964006.
- Андерсон С., Банкир А.Т., Баррелл Б.Г., де Брюин М.Х., Колсон А.Р., Друин Дж., Эперон И.К., Нирлих Д.П., Роу Б.А., Сэнгер Ф., Шрайер П.Х., Смит А.Дж., Стаден Р., Янг И.Г. (апрель 1981 г.). «Последовательность и организация митохондриального генома человека». Природа. 290 (5806): 457–65. Bibcode:1981Натура.290..457A. Дои:10.1038 / 290457a0. PMID 7219534. S2CID 4355527.
- Монтойя Дж., Охала Д., Аттарди Дж. (Апрель 1981 г.). «Отличительные особенности 5'-концевых последовательностей митохондриальных мРНК человека». Природа. 290 (5806): 465–70. Bibcode:1981Натура.290..465М. Дои:10.1038 / 290465a0. PMID 7219535. S2CID 4358928.
- Хораи С., Хаясака К., Кондо Р., Цугане К., Такахата Н. (январь 1995 г.). «Недавнее африканское происхождение современных людей выявлено с помощью полных последовательностей гоминоидных митохондриальных ДНК». Труды Национальной академии наук Соединенных Штатов Америки. 92 (2): 532–6. Bibcode:1995PNAS ... 92..532H. Дои:10.1073 / пнас.92.2.532. ЧВК 42775. PMID 7530363.
- Ридер MJ, Тейлор С.Л., Тобе В.О., Никерсон Д.А. (февраль 1998 г.). «Автоматизация идентификации вариаций ДНК с использованием качественного повторного секвенирования флуоресценции: анализ митохондриального генома человека». Исследования нуклеиновых кислот. 26 (4): 967–73. Дои:10.1093 / nar / 26.4.967. ЧВК 147367. PMID 9461455.
- Эндрюс Р.М., Кубака И., Чиннери П.Ф., Лайтаулерс Р.Н., Тернбулл Д.М., Хауэлл Н. (октябрь 1999 г.). «Повторный анализ и пересмотр кембриджской эталонной последовательности митохондриальной ДНК человека». Природа Генетика. 23 (2): 147. Дои:10.1038/13779. PMID 10508508. S2CID 32212178.
- Ingman M, Kaessmann H, Pääbo S, Gyllensten U (декабрь 2000 г.). «Вариации митохондриального генома и происхождение современного человека». Природа. 408 (6813): 708–13. Bibcode:2000Натура 408..708И. Дои:10.1038/35047064. PMID 11130070. S2CID 52850476.
- Finnilä S, Lehtonen MS, Majamaa K (июнь 2001 г.). «Филогенетическая сеть европейской мтДНК». Американский журнал генетики человека. 68 (6): 1475–84. Дои:10.1086/320591. ЧВК 1226134. PMID 11349229.
- Мака-Мейер Н., Гонсалес А.М., Ларруга Дж.М., Флорес С., Кабрера В.М. (2003). «Основные геномные митохондриальные линии определяют раннюю экспансию человека». BMC Genetics. 2: 13. Дои:10.1186/1471-2156-2-13. ЧВК 55343. PMID 11553319.
- Херрнштадт С., Элсон Дж. Л., Фахи Е., Престон Дж., Тернбулл Д. М., Андерсон С., Гош С. С., Олефски Дж. М., Бил М. Ф., Дэвис Р. Е., Хауэлл Н. (май 2002 г.). «Анализ методом редуцированной медианной сети полных последовательностей кодирующей области митохондриальной ДНК для основных африканских, азиатских и европейских гаплогрупп». Американский журнал генетики человека. 70 (5): 1152–71. Дои:10.1086/339933. ЧВК 447592. PMID 11938495.
- Silva WA, Bonatto SL, Holanda AJ, Ribeiro-Dos-Santos AK, Paixão BM, Goldman GH, Abe-Sandes K, Rodriguez-Delfin L, Barbosa M, Paçó-Larson ML, Petzl-Erler ML, Valente V, Santos SE , Заго М.А. (июль 2002 г.). «Разнообразие митохондриального генома коренных американцев поддерживает единственное раннее проникновение популяций основателей в Америку». Американский журнал генетики человека. 71 (1): 187–92. Дои:10.1086/341358. ЧВК 384978. PMID 12022039.
- Мишмар Д., Руис-Песини Е., Голик П., Маколей В., Кларк А.Г., Хоссейни С., Брэндон М., Исли К., Чен Е., Браун М.Д., Сукерник Р.И., Олкерс А., Уоллес округ Колумбия (январь 2003 г.). «Естественный отбор сформировал региональные вариации мтДНК у людей». Труды Национальной академии наук Соединенных Штатов Америки. 100 (1): 171–6. Bibcode:2003ПНАС..100..171М. Дои:10.1073 / pnas.0136972100. ЧВК 140917. PMID 12509511.
- Ingman M, Gyllensten U (июль 2003 г.). «Вариации митохондриального генома и история эволюции аборигенов Австралии и Новой Гвинеи». Геномные исследования. 13 (7): 1600–6. Дои:10.1101 / гр.686603. ЧВК 403733. PMID 12840039.
Эта статья включает текст из Национальная медицинская библиотека США, который находится в всеобщее достояние.
