Окисление Оппенауэра - Oppenauer oxidation
| Окисление Оппенауэра | |
|---|---|
| Названный в честь | Руперт Виктор Оппенауэр |
| Тип реакции | Органическая окислительно-восстановительная реакция |
| Идентификаторы | |
| Портал органической химии | Оппенауэровское окисление |
| RSC ID онтологии | RXNO: 0000047 |
Окисление Оппенауэра, названный в честь Руперт Виктор Оппенауэр,[1] щадящий метод выборочного окисляющий вторичный спирты к кетоны.

Реакция противоположная Редукция Меервейна – Понндорфа – Верлея.[2] Спирт окисляется изопропоксид алюминия в избытке ацетон. Это сдвигает равновесие в сторону продукта.
В окисление обладает высокой селективностью по отношению к вторичным спиртам и не окисляет другие чувствительные функциональные группы, такие как амины и сульфиды.[3] Хотя первичные спирты могут быть окислены в условиях Оппенауэра, первичные спирты редко окисляются этим методом из-за конкурирующих альдольная конденсация из альдегид товары. Окисление Оппенауэра до сих пор используется для окисления неустойчивых к кислотам субстратов. Метод в значительной степени вытеснен методами окисления, основанными на хроматы (например. хлорхромат пиридиния ) или же диметилсульфоксид (например. Окисление Сверна ) или же Окисление Десса-Мартина из-за использования относительно мягких и нетоксичных реагентов (например, реакция проводится в смесях ацетон / бензол). Окисление Оппенауэра обычно используется в различных промышленных процессах, таких как синтез стероиды, гормоны, алкалоиды, терпены, так далее.
Механизм
На первом этапе этого механизм, спирт (1) координируется с алюминий с образованием комплекса (3), который затем на втором этапе депротонируется алкоксид ион (4) для образования алкоксида средний (5). На третьем этапе окислитель ацетон (7) и субстрат спирт связаны с алюминием. Ацетон координируется с алюминием, который активирует его для гидрид перевод из алкоксида. Катализируемый алюминием гидридный сдвиг от α-углерода спирта к карбонил углерод ацетона протекает по шестичленному переходное состояние (8). Требуемый кетон (9) образуется после переноса гидрида.[4]
Преимущества
Преимущество окисления Оппенауэра заключается в использовании относительно недорогих и нетоксичных реагентов. Условия реакции мягкие и щадящие, так как подложки обычно нагревают в ацетоне /бензол смеси. Еще одно преимущество окисления Оппенауэра, которое делает его уникальным для других методов окисления, таких как хлорхромат пиридиния (PCC) и Десс – Мартин периодинан заключается в том, что вторичные спирты окисляются намного быстрее, чем первичные спирты, поэтому хемоселективность может быть достигнут. Кроме того, отсутствует переокисление альдегиды к карбоновые кислоты в отличие от других методов окисления, таких как Окисление Джонса.[4]
Модификации
Реакция Веттштейна-Оппенауэра
В реакции Веттштейна-Оппенауэра, открытой Веттштейном в 1945 г., Δ 5–3β-гидрокси стероиды окисляются до Δ 4,6-3-кетостероидов с бензохинон как водород акцептор. Эта реакция полезна тем, что дает одностадийное получение Δ 4,6-3-кетостероидов.[5]
Модификация Woodward
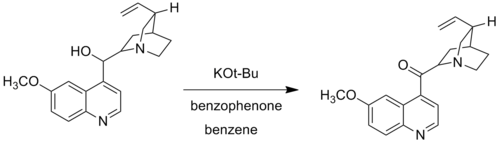
В модификации Woodward компания Woodward заменила трет-бутоксид калия для алкоксида алюминия. Модификация Вудворда окисления Оппенауэра, также называемая Окисление Оппенауэра – Вудворда, используется, когда определенные спиртовые группы не окисляются в стандартных условиях реакции Оппенауэра. Например, Вудворд использовал трет-бутоксид калия и бензофенон для окисления хинин до хининона, так как традиционная алюминиевая каталитическая система не может окислить хинин из-за комплекса, образованного при координации оснований Льюиса азот к алюминиевому центру.[6]
Прочие модификации
Несколько модифицированных алкоксидов алюминия катализаторы также сообщалось. Например, Маруока и его коллеги сообщили об высокоактивном алюминиевом катализаторе, который использовался при окислении карвеол к Carvone (член семейства химических веществ, называемых терпеноиды ) с отличной доходностью (94%).[7]
В другой модификации[8] катализатор триметилалюминий и альдегид 3-нитробензальдегид используется в качестве окислителя, например, при окислении изоборнеол к камфора.
Синтетические приложения
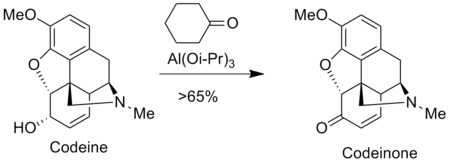
Окисление Оппенауэра используется для получения анальгетики в фармацевтическая индустрия Такие как морфий и кодеин. Например, кодеинон получают окислением Оппенауэра кодеин.[9]
Окисление Оппенауэра также используется для синтеза гормоны. Прогестерон получают окислением Оппенауэра прегненолон.[10]
Небольшая вариация окисления Оппенауэра также используется для синтеза стероидный препарат производные. Например, эффективная каталитическая версия окисления Оппенауэра, в которой используется рутений катализатор был разработан для окисления 5-ненасыщенного 3β-гидрокси стероиды к соответствующей производной 4-ен-3-она.[11]
Окисление Оппенауэра также используется в синтезе лактоны от 1,4 и 1,5 диолы.[12]
Побочные реакции
Обычной побочной реакцией окисления Оппенауэра является основание катализированный альдольная конденсация из альдегид продукт, который имеет α-атомы водорода с образованием ß-гидрокси альдегиды или α, ß-ненасыщенный альдегиды.[13]
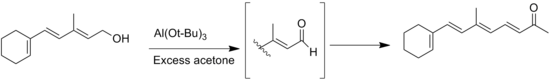
Другая сторона реакция это Тищенко реакция альдегид продукты без α-водорода, но этого можно избежать, используя безводный растворители.[4] Другая общая побочная реакция - это миграция двойной связи во время окисления аллиловый спирт субстраты.[14]
![Оппенауэровское окисление производного стероида. [15]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/36/Wiki-oppenaure-mxa2.tif/lossy-page1-350px-Wiki-oppenaure-mxa2.tif.jpg)
Смотрите также
- Окисление спирта
- Пиридиний хлорхромат
- Окисление Джонса
- Окисление Пфицнера – Моффатта
- Окисление Париха – Деринга.
- Окисление Олбрайта-Гольдмана
- Окисление Сверна
- Окисление Кори-Кима
- Десс – Мартин периодинан окисление
- Лей окисление (TPAP окисление)
- ТЕМП окисление
Рекомендации
- ^ Оппенауэр, Р. В. (1937). "Eine Methode der Dehydrierung von Sekundären Alkoholen zu Ketonen. I. Zur Herstellung von Sterinketonen und Sexualhormonen" [Дегидратация вторичных спиртов до кетонов. I. Получение стеролкетонов и половых гормонов. Рекл. Trav. Чим. Pays-Bas (на немецком). 56 (2): 137–144. Дои:10.1002 / recl.19370560206.
- ^ Уайлдс, А. (1944). «Восстановление с помощью алкоксидов алюминия (восстановление Меервейна-Понндорфа-Верли)». Орг. Реагировать. 2 (5): 178–223. Дои:10.1002 / 0471264180.or002.05.
- ^ Отвос, Л .; Gruber, L .; Мейзель-Агостон, Дж. (1965). «Меервейн-Понндорф-Верлей-Оппенауэр. Исследование механизма реакции с радиоуглеродом. Рацемизация вторичных спиртов». Acta Chim. Акад. Sci. Подвешенный. 43: 149–153.
- ^ а б c Кори, Э.Дж.; Николау, К. (2005). Стратегические применения названных реакций в органическом синтезе. Эльзевир. ISBN 978-7-03-019190-8.
- ^ Манделл, Л. (1955). «Механизм окисления Веттштейна-Оппенауэра». Варенье. Chem. Soc. 78 (13): 3199–3201. Дои:10.1021 / ja01594a061.
- ^ Woodward, R. B .; Wendler, N.L .; Брутши, Ф. Дж. (1945). «Хининон1». Варенье. Chem. Soc. 67 (9): 1425. Дои:10.1021 / ja01225a001.
- ^ Ooi, T; Оцука, H; Миура, Т; Итикава, H; Маруока, К. (2002). «Практическое оппенауэровское (OPP) окисление спиртов с модифицированным алюминиевым катализатором». Органические буквы. 4 (16): 2669–72. Дои:10.1021 / ol020094c. PMID 12153205.
- ^ Graves, C. R .; Zeng, B.S .; Нгуен, С. Т. (2006). «Эффективное и селективное окисление спирта, катализируемое алюминием, с помощью химии Оппенауэра». Журнал Американского химического общества. 128 (39): 12596–7. Дои:10.1021 / ja063842s. PMID 17002323.
- ^ Стефан Карон; Роберт В. Даггер; Салли Гут Руджери; Джон А. Рэган и Дэвид Х. Браун Рипин (2006). «Крупномасштабные окисления в фармацевтической промышленности». Chem. Ред. 106 (7): 2943–89. Дои:10.1021 / cr040679f. PMID 16836305.
- ^ Дьюик, П. (2001). Лекарственные натуральные продукты: биосинтетический подход (2-е изд.). Wiley & Sons. п. 243. ISBN 0471496405.
- ^ Алмейда, Мария Л.С .; Кочовский, Павл; Бэквалль, Ян-Э. (1996). «Катализируемое рутением окисление 3β-гидроксистероидов по типу Оппенауэра. Высокоэффективное вступление в стероидные гормоны с функцией 4-ен-3-она». J. Org. Chem. 61 (19): 6587–6590. Дои:10.1021 / jo960361q. PMID 11667525.
- ^ Эйгнерова, Л .; Касал, А. (1976). «Внутримолекулярный гидридный сдвиг в окислении Оппенауэра некоторых дигидроксистероидов». ChemPlusChem. 41 (4): 1056–1065. Дои:10.1135 / cccc19761056.
- ^ Milas, N.A .; Grossi, F. X .; Penner, S.E .; Кан, С. (1948). «Синтез 1- [циклогексен-1'-ил] -3-метил-1,3,5-октатриен-7-она (C15Кетон)1". Журнал Американского химического общества. 70 (3): 1292. Дои:10.1021 / ja01183a522.
- ^ Reich, R .; Кеана, Дж. Ф. У. (1972). «Окисления Оппенауэра с использованием 1-метил-4-пиперидона в качестве акцептора гидрида». Синтетические коммуникации. 2 (5): 323. Дои:10.1080/00397917208061988.
- ^ Райх, Ричард; Кеана, Джон Ф. У. (1972). «Окисления Оппенауэра с использованием 1-метил-4-пиперидона в качестве акцептора гидрида». Synth. Commun. 2 (5): 323–325. Дои:10.1080/00397917208061988.