Опухоли половых клеток яичников - Ovarian germ cell tumors
| Опухоли половых клеток яичников | |
|---|---|
| Специальность | Онкология |
| Симптомы | Вздутие живота, вздутие живота, асцит, диспареуния |
Опухоли половых клеток яичников (OGCT) - это гетерогенные опухоли, происходящие из примитивных половых клеток эмбрионального гонады, что составляет около 2,6% всех злокачественных новообразований яичников.[1] Существует четыре основных типа OGCT, а именно: дисгерминомы, опухоль желточного мешка, тератома, и хориокарцинома.[1]
Дигерминомы - это злокачественные зародышевые опухоли яичников, которые особенно заметны у пациентов с диагнозом гонадная дисгенезия.[1] ОГКТ относительно сложно обнаружить и диагностировать на ранней стадии из-за неспецифических гистологических характеристик.[1] Общие симптомы OGCT: вздутие живота, вздутие живота, асцит, и диспареуния.[1] ОГКТ вызывается в основном из-за образования злокачественных раковых клеток в примордиальных половых клетках яичника.[1] Точный патогенез OGCT до сих пор неизвестен, однако были идентифицированы различные генетические мутации и факторы окружающей среды.[1] OGCT обычно обнаруживаются во время беременности, когда во время гинекологического осмотра обнаруживается образование придатков, ультразвуковое сканирование показывает твердое образование в яичниках или анализ сыворотки крови показывает повышенное альфа-фетопротеин уровни.[1] У них вряд ли будет метастазированный и поэтому стандартное лечение опухолей хирургическая резекция в сочетании с химиотерапия.[2] Уровень встречаемости составляет менее 3% во всем мире.[3]
Классификация
ОГКТ можно разделить на дисгерминомы, тератомы, опухоли желточного мешка и хориокарциномы, перечисленные в порядке их распространенности.[1]
Дисгерминома

Дисгерминомы сопоставимы с семиномами яичек и составляют примерно 32–37% всех OGCT.[1] Они особенно заметны у людей с дисгеническими гонадами у 46 пациентов с чисто гонадной дисгенезией XY.[1] Основываясь на макроскопических исследованиях, дисгерминомы характеризуются наличием «твердой дольчатый, рыжевато-коричневый, внешний вид телесного цвета с гладкой поверхностью ».[1] Микроскопически клеточная структура отличается округло-яйцевидной формой, содержащей большое количество эозинофильный цитоплазма и ядра неправильной формы.[1] Равномерно расположенные клетки разделены волокнистыми нитями и лимфоцитарная инфильтрация обычно наблюдается.[5]
Тератомы

Тератомы являются наиболее распространенной опухолью половых клеток яичника. Тератомы можно разделить на два типа: зрелая тератома (доброкачественная) и незрелая тератома (злокачественная). Незрелые тератомы содержат незрелые или эмбриональный ткань, которая значительно отличает их от зрелых тератом, поскольку они несут дермоидные кисты.[7] Обычно это наблюдается у женщин в возрасте от 15 до 19 лет и редко у женщин после менопаузы.[8] Незрелые тератомы характеризуются диаметром 14-25 см, инкапсулированной массой, кистозными участками и случайным появлением геморрагический области.[9] Стадия незрелых тератом определяется в зависимости от количества незрелых тератом. нейроэпителий обнаружена ткань.[7]
Опухоль желточного мешка

Яичник опухоли желточного мешка, также известный как опухоли энтодермального синуса, составляют около 15,5% всех OGCT.[11] Они наблюдались у женщин, особенно в раннем возрасте, и редко после 40 лет.[12] Критическими патологическими особенностями являются гладкая внешняя поверхность и разрывы капсул из-за их быстрого роста. Исследование, состоящее из 71 индивидуального случая опухоли желточного мешка яичника, свидетельствует о разрастании опухоли. В одном из случаев тазовое обследование показало нормальную активность, пока через 4 недели не была обнаружена опухоль размером 9 см и 12 см.[12] В другом случае опухоль размером 23 см была обнаружена у беременной женщины, которая регулярно наблюдалась и имела нормальные результаты до тех пор, пока овариэктомия стало необходимо.[12] Гистологически эти опухоли характеризуются смешанными солидными и кистозный составные части.[1] Смешанные твердые компоненты характеризуются твердыми компонентами от мягкого серого до желтого, сопровождающимися значительными кровоизлияние и некроз. Кисты имеют диаметр около 2 см и заполняют ткань, что приводит к новообразование "сотовый вид".[1]
Хориокарцинома

Хориокарциномы исключительно редки, они составляют 2,1–3,4% от всех OGCT.[14] При грубой проверке синцитиотрофобласт клетки расположены в сплетении с одноядерными цитотрофобласт клетки, окружающие очаги кровоизлияния.[1] Хориокарциномы можно разделить на гестационные хориокарциномы и негестационные хориокарциномы, которые имеют иммуногистохимический различия.[15]
Признаки и симптомы
OGCT относительно сложно обнаружить и диагностировать на ранней стадии, главным образом потому, что симптомы обычно незаметны и неспецифичны. Их можно обнаружить, когда они превращаются в большие осязаемые массы. Симптомы включают вздутие живота, вздутие живота, асцит и диспареунию.[16] В редких случаях, когда опухоль разрывается, острый боль в животе можно испытать.[17] Критическим индикатором злокачественности обычно является появление Сестра Мэри Джозеф Узелок.[18] OGCT могут в дальнейшем вызвать перекрут яичника, кровотечение и даже изосексуальное преждевременное половое созревание у маленьких детей.[19]
Причины
Точная причина OGCT еще не установлена. Однако было выявлено несколько факторов, которые могут способствовать повышенному риску OGCT, включая: эндометриоз, синдром поликистозных яичников, и генетические факторы риска.[20] Люди, которые более склонны к развитию OGCT, обычно содержат аутосомно-доминантный, BRCA-1 / BRCA-2, мутации.[20] Осложнения с другими видами рака, такими как наследственный неполипозный колоректальный рак, также известный как Синдром Линча, увеличивает риск развития рак яичников.[20] Беременность, кормление грудью и пероральный прием контрацептивы как известно, снижают риск OGCT.[20] В этиология OGCT все еще изучается, однако генетические изменения могут способствовать развитию OGCT, таких как классический гены-супрессоры опухолей и онкогены. Наряду с генетическими модификациями, некоторые факторы окружающей среды, такие как эндокринные разрушители, наличие распорядка дня, влияющего на биохимию человека, и воздействие материнских гормонов также могут способствовать распространению OGCT.[20] Недавнее исследование на крысах показало трансгенерационное эпигенетическое наследование поддерживая влияние опасных веществ окружающей среды, включая пластмассы, пестициды и диоксины, о патогенезе ОГКТ.[20]
Патогенез
Тем не менее, было сделано несколько предположений о причинах. В течение овуляция, то фолликул разрывы, приводящие к клетка эпителия повреждать.[1] Чтобы вылечить ткань и заменить повреждение, клетки подвергаются деление клеток. Каждый раз, когда клетка делится, существует вероятность возникновения мутаций и увеличивается вероятность образования опухоли.[1] Опухоль возникает, когда половые клетки яичников начинают бесконтрольно делиться и становятся злокачественными, для которых характерны менее организованные ядра и нечеткие границы.[1] Другой потенциальной этиологией является нарушение функции ген-супрессор опухоли, TRC8 / RNF139 или даже кариотипический аномалии после тщательного молекулярного исследования.[21]
OGCT имеет свои корни в эмбриональном развитии, где первичные половые клетки (PGC) выделяются на ранних стадиях и обладают способностью изменять геном, а также транскриптом.[20] OGCT можно отнести к внутреннему механизму PGC и их трансформирующим характеристикам.[20]
Постановка
После диагностики OGCT будут проведены различные тесты, чтобы определить, распространился ли рак на другие области тела. Распространение ОГКТ определяется по разным стадиям: стадия I, стадия II, стадия III, а именно стадия IV.
Стадия I. Опухолевые клетки локализуются в яичниках или фаллопиевых трубах, не распространяясь на другие участки тела.[22]
Стадия II: рак поражает один или оба яичника или фаллопиевы трубы и распространился на таз.[22]
Стадия III: рак распространился за пределы таза в брюшную полость и забрюшинные лимфатические узлы (расположен в задней части брюшная полость ). Подстадии характеризуются относительным размером опухоли.[22]
Примечание: рак яичников II стадии также будет объявлен, если раковые клетки распространились на печень. Стадия IV: рак распространился за пределы брюшной полости и таз к более отдаленным органам, таким как легкие.[22]
Диагностика
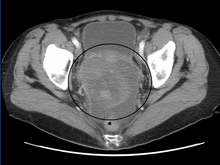
Предварительный диагноз начинается с тазовое обследование, тест на онкомаркеры сыворотки и визуализация. При введении пальцев в перчатках во влагалище врачи могут почувствовать большую пальпируемую массу или шишку внизу живота. Для дальнейшей идентификации гистологических подтипов OGMT собираются образцы крови пациентов для анализа сывороточного уровня биомаркеров, выделяемых опухолевыми клетками. Скачок уровня в плазме хорионический гонадотропин человека и альфа-фетопротеин указывает на OGMTs.[1] Лактатдегидрогеназа, щелочная фосфатаза и раковый антиген 125 потенциально может также увеличиться.[24] Чтобы визуализировать расположение и морфологию опухоли, трансвагинальное ультразвуковое исследование обычно используется.[1] Наиболее характерный вид - паренхиматозное гетероэхогенное образование с резкими границами и высокой васкуляризацией.[1] Компьютерная томография будет создавать наложенные изображения внутри брюшной области тела, чтобы визуализировать дольчатый рисунок опухоли.[1] Обычно при дисгерминоме твердая масса, разделенная на дольки с увеличивающимися перегородками, может быть очевидна для кровотечение или некроз.[1]
Предоперационные процедуры
В соответствии с FIGO будет проводиться комплексное хирургическое стадирование, чтобы изучить степень распространения опухоли через перитонеальный регионы или лимфодренаж.
28% пациентов со стадией II будут обнаружены с развитием вторичных злокачественных новообразований в лимфатических узлах на расстоянии от первичного очага рака, называемого лимфатическим узлом. метастаз.[1]
Существует три основных пути лимфодренажа:[1]
- дренаж в парааортальные лимфатические узлы через яичниковые вены
- дренаж из широкой связки к подвздошные лимфатические узлы
- дренаж из круглая связка к паховые лимфатические узлы
Пальпация или биопсия одностороннего таза и парааортальные лимфатические узлы будет проводиться в качестве предоперационного шага для определения прогноз опухоли и лимфатического распространения[1]
Биопсия брюшины и оментэктомия также будет использоваться для оценки степени разлива содержимого опухоли или имплантации в брюшную полость.[1] Опухолевые клетки могут отделяться от исходного участка в брюшную полость и имплантироваться на капсула печени поверхность или диафрагма.[24] Они могут закупориваться внутри лимфатического сосуда вокруг диафрагмы и препятствовать рассасыванию перитонеальной жидкости.[24] В конце концов, перикардиофренический лимфаденопатия и асцит может возникнуть в результате этого откровенного вторжения.[1][24]
Уход
Хирургия
Злокачественные ОГКТ преимущественно односторонние и химиочувствительные, что означает, что они локализуются только на одной стороне яичника.[24] Операции по сохранению фертильности в первую очередь стандартизированы для сохранения целостности контралатерального яичника и маточной трубы, также известных как односторонняя сальпингоофорэктомия.[1][24] Для пациентов со стадией II с наблюдаемыми метастазами циторедуктивная хирургия может выполняться для уменьшения объема опухоли, например гистерэктомия (удаление всей или части матки) и двусторонняя сальпингоофорэктомия.[1][24] Хирургический разрез брюшной полости после завершения адъювантной химиотерапии, называемый вторым осмотром лапаротомия, лучше всего подходит для пациентов с тератоматозными элементами после предыдущей циторедуктивной хирургии.[1][24]
Адъювантная химиотерапия

При рецидивах до 15-25% у больных ранней стадией,[1] адъювантная химиотерапия необходимо сочетать с хирургической резекцией опухоли, чтобы гарантировать полное спасение. Для системной химиотерапии (вводимой перорально или внутривенно) схема стандартизирована для каждой стадии FIGO и включает: блеомицин, этопозид, и цисплатин, также известный как BEP лечение.[2] Пациентам следует назначить 3-4 цикла БЭП для обеспечения полного выздоровления.[2] В зависимости от индивидуальных условий, некоторым пациентам, не отвечающим на терапию BEP, будет назначена терапия спасения, которая состоит из цисплатина, ифосфамид и паклитаксел.[2][26] Тем не менее, вполне вероятно, что выжившие после ОГКТ после терапии ВОП будут иметь преждевременная менопауза в возрасте 36 лет.[24] Кроме того, некоторые больницы выбрали химиотерапию на основе платины, поскольку комплексы платины, присутствующие в препарате, вмешиваются. Транскрипция ДНК за счет образования химических перекрестных связей внутри цепей ДНК, что предотвращает размножение раковых клеток.[27] Основные элементы - цисплатин, карбоплатин, и оксалиплатин.[28] Сообщалось о полном выздоровлении среди пациентов на ранних стадиях, и только четверть пациентов на поздних стадиях не были спасены потенциально из-за лекарственной устойчивости.[1][29]
У пациентов на поздних стадиях после циторедуктивной хирургии невидимые микроскопические раковые клетки или узелки могут все еще присутствовать в месте инфекции.[27] Поэтому врачи могут закапывать нагретый химиотерапевтический раствор (~ 42-43 ° C) в брюшную полость через трубку Картера на 1,5 часа.[30] Основываясь на принципе, что раковые клетки обычно умирают при 40 ° C, соматические клетки остается неизменным, так как они умирают при 44 ° C.[30] Этот новый метод доказал свою эффективность: частота рецидивов составляет всего 10%, а летальность не регистрируется.[31] Он известен как гипертермическая внутрибрюшинная химиотерапия (HIPEC), содержащая доцетаксел и цисплатин.[31] Поскольку лекарство распространяется локально во внутрибрюшинных областях, оно не оказывает системных побочных эффектов на другие активно воспроизводящиеся клетки и предпочтительнее системной химиотерапии.[30]
Как правило, неконтролируемое распределение лекарств при системной химиотерапии приводит к миелосупрессия, особенно с наблюдаемыми фебрильная нейтропения, нейротоксичность, ототоксичность, и нефротоксичность.[2] Лечебные средства против токсичности, вызванной химиотерапией, заключаются в инъекции колониестимулирующий фактор гранулоцитов или миелоидные факторы роста или пероральный прием профилактических антибиотиков.[2]
Эпидемиология
ОГКТ - это редкая опухоль в рамках рака яичников, на которую приходится менее 5% всех злокачественных новообразований яичников. Это происходит в основном у женщин в возрасте 15-19 лет и составляет 75% случаев у женщин в возрасте до 30 лет.[31] В 2011 году количество новых случаев заболевания во всем мире составляет 5,3 на миллион.[32] В большинстве стран частота встречаемости в среднем составляет менее 3% населения.[3] Однако в Азии зарегистрирован самый высокий процент случаев до 4,3% из-за более молодого возрастного профиля населения.[3] В других регионах зарегистрированные уровни заболеваемости составляют 2,5% в Океании, 2,0% в Северной Америке и 1,3% в Европе.[3]
Пятилетняя выживаемость достигла 90-92%, что намного выше, чем у эпителиальный рак яичников.[33] Основная причина - высокая эффективность химиотерапия на основе платины.[1]
Рекомендации
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай Shaaban AM, Rezvani M, Elsayes KM, Baskin H, Mourad A, Foster BR, Jarboe EA, Menias CO (2014). «Злокачественные зародышевые опухоли яичников: клеточная классификация, клинические и визуальные особенности». Радиография. 34 (3): 777–801. Дои:10.1148 / rg.343130067. PMID 24819795.
- ^ а б c d е ж "Опухоли зародышевых клеток яичников" (PDF). апрель 2013. Получено 2019-04-01.
- ^ а б c d Мац М., Член парламента Коулмана, Сант М., Доктор Чирлак, Виссер О., Гор М., Аллемани С. (февраль 2017 г.). «Гистология рака яичников: распространение во всем мире и значение для международных сравнений выживаемости (КОНКОРД-2)». Гинекологическая онкология. 144 (2): 405–413. Дои:10.1016 / j.ygyno.2016.10.019. ЧВК 6195192. PMID 27931752.
- ^ «Дисгерминома», Википедия, 2019-02-13, получено 2019-04-09
- ^ Опасность FK (2019). «Патология дисгермином яичников: обзор дисгермином яичников, дифференциация дисгермином яичников, лабораторные маркеры». Medscape.
- ^ «Незрелая тератома», Википедия, 2019-03-14, получено 2019-04-10
- ^ а б Медейрос Ф., Стрикленд KC (январь 2018 г.). «Глава 26: Зародышевые опухоли яичника». Диагностическая гинекологическая и акушерская патология (третье изд.). С. 949–1010. Дои:10.1016 / B978-0-323-44732-4.00026-1 (неактивно 10.09.2020). ISBN 978-0-323-44732-4.CS1 maint: DOI неактивен по состоянию на сентябрь 2020 г. (связь)
- ^ Templeman CL, Hertweck SP, Scheetz JP, Perlman SE, Fallat ME (декабрь 2000 г.). «Ведение зрелых кистозных тератом у детей и подростков: ретроспективный анализ». Репродукция человека. 15 (12): 2669–72. Дои:10.1093 / humrep / 15.12.2669. PMID 11098043.
- ^ Outwater EK, Сигельман ES, Hunt JL (2001). «Тератомы яичников: типы опухолей и визуальные характеристики». Радиография. 21 (2): 475–90. Дои:10.1148 / радиография.21.2.g01mr09475. PMID 11259710.
- ^ «Опухоль энтодермального синуса», Википедия, 2019-02-01, получено 2019-04-10
- ^ Талерман А (июль 1975 г.). «Заболеваемость элементами опухоли желточного мешка (опухоли энтодермального синуса) в опухолях половых клеток яичка у взрослых». Рак. 36 (1): 211–5. Дои:10.1002 / 1097-0142 (197507) 36: 1 <211 :: AID-CNCR2820360122> 3.0.CO; 2-W. PMID 1203848.
- ^ а б c Курман Р.Дж., Норрис Г.Дж. (декабрь 1976 г.). «Опухоль энтодермального синуса яичника: клинико-патологический анализ 71 случая». Рак. 38 (6): 2404–19. Дои:10.1002 / 1097-0142 (197612) 38: 6 <2404 :: help-cncr2820380629> 3.0.co; 2-3. PMID 63318.
- ^ «Хориокарцинома», Википедия, 2019-02-23, получено 2019-04-10
- ^ Смит Х.О., Бервик М., Фершраген С.Ф., Виггинс С., Лансинг Л., Мюллер С.Ю., Куоллз С.Р. (май 2006 г.). «Заболеваемость и выживаемость для женских злокачественных опухолей половых клеток». Акушерство и гинекология. 107 (5): 1075–85. Дои:10.1097 / 01.AOG.0000216004.22588.ce. PMID 16648414. S2CID 25914370.
- ^ Ulbright TM (февраль 2005 г.). «Опухоли половых клеток гонад: выборочный обзор, подчеркивающий проблемы дифференциальной диагностики, недавно оцененные и спорные вопросы». Современная патология. 18 Дополнение 2 (2): S61-79. Дои:10.1038 / modpathol.3800310. PMID 15761467.
- ^ "Зародышевые клетки яичников | Рак яичников | Исследования рака Великобритании". www.cancerresearchuk.org. Получено 2019-04-10.
- ^ Мониага, Северная Каролина, Рэндалл Л. М. (февраль 2011 г.). «Злокачественная смешанная герминогенная опухоль яичника с эмбриональным компонентом». Журнал детской и подростковой гинекологии. 24 (1): e1-3. Дои:10.1016 / j.jpag.2010.05.001. ЧВК 5111966. PMID 20869284.
- ^ Калонгос Г., Огино М., Кинута Т., Хори М., Мори Т. (2016). «Узелок сестры Мэри Джозеф как первое проявление метастатического рака яичников». Отчеты о случаях в акушерстве и гинекологии. 2016: 1087513. Дои:10.1155/2016/1087513. ЧВК 5007344. PMID 27635270.
- ^ Уильямс SD (июнь 1998 г.). «Опухоли зародышевых клеток яичников: обновленная информация». Семинары по онкологии. 25 (3): 407–13. PMID 9633853.
- ^ а б c d е ж грамм час Kraggerud SM, Hoei-Hansen CE, Alagaratnam S, Skotheim RI, Abeler VM, Rajpert-De Meyts E, Lothe RA (июнь 2013 г.). «Молекулярные характеристики злокачественных опухолей половых клеток яичников и сравнение с аналогами яичек: последствия для патогенеза». Эндокринные обзоры. 34 (3): 339–76. Дои:10.1210 / er.2012-1045. ЧВК 3787935. PMID 23575763.
- ^ «Дисгерминома яичников: история вопроса, патофизиология, эпидемиология». 2019-03-18. Цитировать журнал требует
| журнал =(помощь) - ^ а б c d «Симптомы, тесты, прогноз и стадии опухолей зародышевых клеток яичников». Национальный институт рака. 1980-01-01. Получено 2019-04-03.
- ^ "Рак яичников", Википедия, 2019-03-19, получено 2019-04-10
- ^ а б c d е ж грамм час я Биксель К.Л., Фаулер Дж. (2018). "Опухоли зародышевых клеток яичников". Гинекологический уход. Издательство Кембриджского университета. С. 350–359. Дои:10.1017/9781108178594.037. ISBN 9781108178594.
- ^ «Гипертермическая внутрибрюшинная химиотерапия», Википедия, 2019-03-19, получено 2019-04-10
- ^ «Опухоли зародышевых клеток яичников - Обзор лекарственных средств от рака, включенных в список основных лекарственных средств ВОЗ» (PDF). Союз по международному контролю рака. 2014.
- ^ а б «Химиотерапия». Альянс по исследованию рака яичников. Получено 2019-04-01.
- ^ «Информация о платиновой терапии (противораковом лечении)». myVMC. 2005. Получено 2019-04-01.
- ^ Ван И, Ян Дж., Ю М, Цао ДЙ, Шен К. (2018). «Злокачественная смешанная опухоль зародышевых клеток яичников, состоящая из незрелой тератомы, опухоли желточного мешка и эмбриональной карциномы, несущей мутацию EGFR: отчет о случае». ОнкоЦели и терапия. 11: 6853–6862. Дои:10.2147 / отт.s176854. ЧВК 6190639. PMID 30349318.
- ^ а б c "Лечение рака брюшины Бостон". Медицинский центр Тафтс. Получено 2019-04-01.
- ^ а б c Ю ХХ, Йонемура Й, Се МС, Лу Си, Ву Си, Шан Ю.С. (2019). «Опыт применения циторедуктивной хирургии и гипертермической внутрибрюшинной химиотерапии при тератоме яичника со злокачественной трансформацией и перитонеальной диссеминацией». Терапия и управление клиническими рисками. 15: 129–136. Дои:10.2147 / tcrm.s190641. ЧВК 6338109. PMID 30679911.
- ^ Каач П., Хефнер С., Каламинус Г., Блеттнер М., Тулла М. (январь 2015 г.). «Опухоли половых клеток в педиатрии с 1987 по 2011 годы: уровни заболеваемости, временные тенденции и выживаемость». Педиатрия. 135 (1): e136-43. Дои:10.1542 / педы.2014-1989. PMID 25489016. S2CID 1149576.
- ^ Ван И, Ян Дж., Ю М, Цао ДЙ, Шен К. (2018). «Злокачественная смешанная опухоль зародышевых клеток яичника, состоящая из незрелой тератомы, опухоли желточного мешка и эмбриональной карциномы, несущей мутацию EGFR: отчет о случае». ОнкоЦели и терапия. 11: 6853–6862. Дои:10.2147 / OTT.S176854. ЧВК 6190639. PMID 30349318.
внешняя ссылка
| Классификация |
|---|
