TMEM267 - Википедия - TMEM267
| TMEM267 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||
| Псевдонимы | TMEM267, C5orf28, трансмембранный белок 267 | ||||||||||||||||||||||||
| Внешние идентификаторы | MGI: 3648543 ГомолоГен: 49708 Генные карты: TMEM267 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ортологи | |||||||||||||||||||||||||
| Разновидность | Человек | Мышь | |||||||||||||||||||||||
| Entrez | |||||||||||||||||||||||||
| Ансамбль | |||||||||||||||||||||||||
| UniProt | |||||||||||||||||||||||||
| RefSeq (мРНК) | |||||||||||||||||||||||||
| RefSeq (белок) |
| ||||||||||||||||||||||||
| Расположение (UCSC) | Chr 5: 43.44 - 43.48 Мб | Chr 13: 119.49 - 119.61 Мб | |||||||||||||||||||||||
| PubMed поиск | [3] | [4] | |||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
TMEM267 представляет собой белок, который у человека кодируется геном TMEM267. Это возможно онкоген который кодирует трансмембранный белок. Функция TMEM267, скорее всего, включает транспортировку молекул из цитозоля, так как присутствие мотивов и доменов, участвующих в транспортировке, было консервативным в ортологах. TMEM267 имеет ортологи у многих видов и экспрессируется на самом высоком уровне в щитовидная железа.

Ген
Известные псевдонимы для TMEM267 включают C5orf28, B2RDA6 и Q9H6Z2.[5] TMEM267 находится на хромосома 5, цитобанда p12 на обратной цепи между парами оснований 43 444 252 и 43 485 178, что означает, что она имеет длину 40 927 пар оснований.[6] TMEM267 продуцирует 13 различных интронов gt-ag и 12 различных мРНК, с 9 вариантами альтернативного сплайсинга и 3 формами без сплайсинга. Имеет 2 альтернативы промоутеры и 7 проверенных полиаденилирование места.[7] Предусмотрено 6 промоторов различной длины.[8]

| Имя | Регистрационный номер | Количество экзонов | Размер (пп) |
|---|---|---|---|
| Вариант стенограммы 1 | NM_022483 | 3 | 2736 |
| Вариант стенограммы 2 | NM_001377394.1 | 4 | 2887 |
| Вариант стенограммы X2 | XM_011514075 | 4 | 3574 |
| Вариант стенограммы 3 | NM_001377395.1 | 5 | 3210 |
| Вариант стенограммы 4 | NM_001377396.1 | 3 | 2960 |
| Вариант стенограммы 5 | NM_001377397.1 | 4 | 3108 |
| Вариант стенограммы 6 | NM_001377398.1 | 5 | 3283 |
| Вариант стенограммы 7 | NM_001377399.1 | 3 | 3377 |
| Вариант стенограммы 8 | NM_001377400.1 | 4 | 3528 |
| Вариант стенограммы 9 | NM_001377401.1 | 4 | 2834 |
| Вариант 10 стенограммы | NM_001377402.1 | 3 | 2809 |
| Вариант стенограммы 11 | NM_001377403.1 | 5 | 2979 |
Протеин
Общая информация
Белок TMEM267 во всех изоформах имеет длину 215 аминокислот.[9] Все изоформы имеют прогнозируемую молекулярную массу 24,2 кДа и теоретическая изоэлектрическая точка из 8.91.[10][11] Был выше среднего процент гистидин и триптофан остатки. Процент аспарагин, глютаминовая кислота и тирозин были ниже среднего. После анализа антарктической желтобрюхой трески, Тропическая когтистая лягушка, Ивовая мухоловка, Обыкновенная ящерица, и Тихоокеанский белобокий дельфин ортологов, процентный состав триптофана выше среднего и процентный состав ниже среднего остатков аспарагина и глутаминовой кислоты сохранялся в амфибии, рыбы, млекопитающие, птицы, и рептилии.[12]
Изоформы
| Имя | Регистрационный номер | Размер (аа) |
|---|---|---|
| Вариант стенограммы 2 | NP_001364323.1 | 215 |
| Вариант стенограммы X2 | XM_011514075 | 215 |
| Вариант стенограммы 3 | NP_001364324 | 215 |
| Вариант стенограммы 4 | NP_001364325 | 215 |
| Вариант стенограммы 5 | NP_001364326 | 215 |
| Вариант стенограммы 6 | NP_001364327 | 215 |
| Вариант стенограммы 7 | NP_001364328 | 215 |
| Вариант стенограммы 8 | NP_001364329 | 215 |
| Вариант стенограммы 9 | NP_001364330 | 215 |
| Вариант 10 стенограммы | NP_001364331 | 215 |
| Вариант стенограммы 11 | NP_001364332 | 215 |
| Вариант стенограммы 12 | NP_071928 | 215 |
Трансмембранные области
Предсказания, касающиеся трансмембранных регионов TMEM267, неясны. Некоторые инструменты прогнозирования утверждают, что нет трансмембранный или же гидрофобный регионы.[13] Другие предсказывают от 2 до 5 трансмембранных доменов.[14] [15] По общему мнению, существует по крайней мере две трансмембранные области в аминокислотах в районе 113–135 и 176–198. Диаграммы спирального колеса трех трансмембранных областей, представленные NCBI Gene, указывают на присутствие полярных аминокислот, которые являются основными и кислыми в трансмембранных областях, что является необычным.[16]

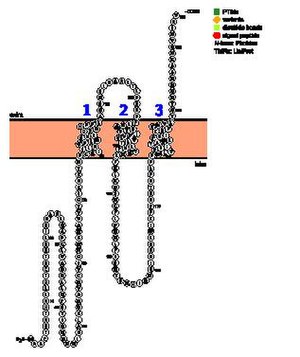
Домены
Для TMEM267 были предсказаны два домена. Во-первых, это LaxA-связывающая мутация, связанная с внутренней мембраной. гидролаза, что указывает на то, что TMEM267 может участвовать как группа мембраносвязанных металл-зависимых гидролаз, которые могут действовать как фосфолипазы. Другой предположительно является доменом Vacuolar sorting protein 9 (VPS9), что указывает на то, что TMEM267 может участвовать в транспортировке молекул в лизосомы и клеточная сигнализация.[17][18]
| Домен | Место расположения | Сохраняется в изоформах | Сохранилось в ортологах |
|---|---|---|---|
| Сайт связывания LaxA | 55-161 | да | да |
| Сайт связывания вакуолярного сортирующего белка 9 (VSP9) | 175-199 | да | нет |
Мотивы
Предсказанные мотивы представляют собой канонический аргинин-содержащий фосфопептидный мотив, который может участвовать в транспортировке 14-3-3 белков которые участвуют во многих клеточных процессах.[19] Сайт связывания белка фактора регуляции интерферона 3 (IRF-3) может быть вовлечен в сигнальный путь, который активизирует IRF-3 в присутствии вирусных и микробных инфекций.[20] Мотивы на основе триптофана, которые позволяют нацеливать привязку к домену гомологии, могут означать, что TMEM267 может играть роль в опосредовании транспортировки из Гольджи в ER. Субъединица катомера дельта (дельта-COP) представляет собой цитозольный белковый комплекс, который связывается с мотивами и ассоциируется с везикулами, участвующими в транспорте белка от ER и Гольджи.[21] Был предсказан мотив LC3-взаимодействующей области (LIR), который указывает на то, что TMEM267 может участвовать в аутофагия пути, который участвует в переносе цитоплазматического материала в аутофагосомы к лизосомам, а также удаление токсичных макромолекул и органелл для поддержания здоровья клетки.[22] Класс 2 ПДЗ -связывающий мотив предсказывает, что TMEM267 может быть вовлечен в белки PDZ, которые влияют на транспортировку, рециклинг и внутриклеточную сортировку.[23] Мотив Wxxx [FY] указывает на то, что TMEM267 может участвовать во взаимодействии Pex14 с белками Pex5.[24][25]
| Мотив | Место расположения | Сохраняется в изоформах | Сохранилось в ортологах | Сотовая связь |
|---|---|---|---|---|
| Канонический аргининсодержащий фосфопептидный мотив | 49-56 | да | да | цитозоль |
| Сайт связывания регуляторного фактора 3 интерферона (IRF-3) | 139-146 | да | да | цитозоль |
| Мотивы на основе триптофана, которые делают возможной привязку к домену гомологии | 144-151 | да | да | цитозоль |
| Мотив LIR | 64-68 | да | да | цитозоль |
| PDZ-связывающий мотив | 210-215 | да | да | цитозоль |
| Мотив Wxxx [FY] | 166-170 | да | да | цитозоль |
Локализация и изобилие

В целом TMEM267, скорее всего, находится в цитоплазме. Утверждалось, что белок TMEM267 локализован в нуклеоплазма ячеек.[26] Другой инструмент предсказал, что его можно найти в цитоплазма (69,6%) и митохондриальный (13%) с надежностью 94,1 по методу Рейнхардта для цитоплазматической / ядерной дискриминации.[27] TMEM267 не содержится в организме человека в количестве 0,05 ppm.[28]
Прогнозы вторичной структуры
Вторичная структура прогнозы были сделаны с использованием трансмембранных областей TMEM267, предоставленных NCBI Gene. Серверы прогнозов показывают, что аминокислоты 1-76 имеют спиральную природу. Предполагается, что внеклеточные и внутриклеточные области белка TMEM267 представляют собой комбинацию альфа спирали и бета-листы, но единого мнения нет.[29][30][31]

Посттрансляционные модификации
Нет никаких доказательств посттрансляционные модификации белка TMEM267, обнаруженного в тканях.[32] Согласно анализу последовательности белков, есть предсказание одного пальмитоилирование сайт, SUMO Interaction и два сумоилирование места.[33][34] Есть много предсказаний фосфорилирование сайтов в нетрансмембранных областях с различными протеинкиназы включая AGC, CKII и Case киназу II.[35][36] Предполагается, что один сайт будет ацетилированный на N-конце TMEM267.[37] TMEM267 имеет четыре предсказанных гликирование сайтов, а также семь O-бета-GlycNAc места.[38][39]
Выражение
Белок TMEM267 экспрессируется более чем в 100 тканях организма, что означает, что он имеет низкую тканевую специфичность, но в основном присутствует в тканях. щитовидная железа, гипофиз, и поджелудочная железа. Данные NCBI Geo показывают, что существуют более высокие уровни экспрессии в основном в щитовидная железа но другие ткани имеют различную экспрессию для каждого образца. Похоже, что в среднем самые высокие уровни экспрессии щитовидная железа, яичники, яички, гипофиз, и поджелудочная железа. TMEM267 не экспрессируется на очень высоком уровне по сравнению с бета Актин, что почти втрое больше РПКМ по сравнению с TMEM267.[40] TMEM267 экспрессируется в 1,6 раза больше, чем средний ген на хромосоме 5.[41]

Взаимодействия
Факторы транскрипции
В таблице ниже описывается тщательно подобранный набор факторов транскрипции, которые, как предполагается, связываются в предсказанной Genomatix промоторной области TMEM267.[42]
| Фактор транскрипции | Подробная информация |
|---|---|
| RU49 | Разрастание цинковых пальцев 1-Zipro |
| СОРИ | SOX-SOY-определение пола / яичек и связанные факторы коробки HMG |
| FKHD | Домен вилки факторы |
| BRAC | Брачьюры ген, фактор развития мезодермы |
| EVI1 | EVI1-милеидный трансформирующий белок |
| ВТБП | Позвоночное животное Связывающий белок ТАТА фактор |
| ПОРЫВ | SWI / SNF родственные нуцелофосфопротеины с ДНК-связывающим мотивом RING finger |
| NKXH | Факторы гомеодомена NKX |
| BRN5 | Brn-5 POU домены |
| PDX1 | ТФ гомеодомена поджелудочной железы и кишечника |
| CEBPA / B | CCAAT / связывающий белок-энхансер |
| CAAT | Факторы связывания CCAAT |
| SPZ1 | Специфичные для семенников TF bHLH-Zip |
| NFAT | Ядерный фактор активированных Т-клеток |
| DMRT | DM-домен содержащие TF |
| ZF01 | C2H2 цинковый палец TF1 |
| CREB | белки, связывающие цАМФ-чувствительный элемент |
| XBBF | Факторы привязки X-box |
| GCNR | Ядерный рецептор зародышевой клетки |
| PLZF | C2H2 белок цинковых пальцев PLZF |
Взаимодействующие белки
Было предсказано, что TMEM267 будет взаимодействовать с белками, указанными в таблице ниже.
| Название белка | Этикетка UniProt | Функция | Место расположения |
|---|---|---|---|
| TMEM52B | Q4KMG9 | Функция не изучена | Неотъемлемый компонент мембраны, внеклеточная область |
| TMEM14B | Q9NUH8 | Участвует в расширении и складывании коры в развивающемся неокортексе; может управлять пролиферацией нейральных предшественников через ядерную транслокацию | Неотъемлемый компонент мембраны |
| RTP2 (рецептор-транспортный белок 2) | Q5QGT7 | Способствует функциональной экспрессии на клеточной поверхности обонятельный рецептор | Плазматическая мембрана |
| SAR1A | Q9NR31 | Участвовал в транспортировке из ER в аппарат Гольджи; SAR1S-GTP-зависимая сборка SEC16A на мембране ER формирует организованный каркас, определяющий сайты выхода ER | ER, аппарат Гольджи |
| STX7 (Синтаксин-7) | Q15400 | Может участвовать в транспортировке белков от плазматической мембраны к раннему эндосома; опосредует передачу от ранних эндосом к поздним и лизосомы | Эндосома, плазматическая мембрана |
| CPLX4 (Комплексин-4) | Q7Z7G2 | Регулирует SNARE белок комплексно-опосредованное слияние синаптических пузырьков | Плазматическая мембрана |
| APP (белок-предшественник амилоида-бета P4) | P05067 | Функционирует как рецептор клеточной поверхности в нейронах; участвует в регуляции подвижности клеток и транскрипции | Внеклеточная область / секретируемая, плазматическая мембрана, эндосома, ядро, цитоплазматическая везикула |
| EGFR | P00533 | Рецептор триггера связывания лиганда гомо / гетеродимеризация и аутофосфорилирование по ключевым цитоплазматическим остаткам; этот фосфорилированный рецептор привлекает адаптерные белки которые активируют сигнальные каскады ниже по потоку | Ядерная мембрана, мембрана ER |
| LNPEP (лейцил-цистиниламинопептидаза) | Q9UIQ6 | Высвобождение N-концевой аминокислоты, расщепляющейся перед цистеин и лейцин; помогает поддерживать гомеостаз во время беременности | Плазматическая мембрана, внеклеточная область |
| ECM29 | Q5VYK3 | Адаптер / каркасный белок связывается со специфическими белками; может соединять протеасому с ER, эндосомой и центросомой | Ядро, центросома, ER, эндосома, цитоплазматический пузырек |
Гомология и эволюция
Ортологи и паралоги
TMEM267 имеет ортологи в Млекопитающие, Рептилии, Амфибия, Моллюска, Членистоногие, Бранкиостома, Trichoplax, Оомицеты, и Бактерии, среди прочих, но не имеет паралогов. Таблица избранных ортологов приведена ниже.[43]
| Род и вид | Распространенное имя | Таксономическая группа | Предполагаемая дата расхождения (MYA) | Регистрационный номер | Длина последовательности (аа) | Выравнивание последовательности | Сходство последовательности |
|---|---|---|---|---|---|---|---|
| Nannospalax galili | Северный израильский слепой подземный крот | Rodentia | 90 | XP_008831143.1 | 215 | 85.19% | 93% |
| Опистокомус хоазин | Рептилия Птица | Опистокомиформные | 312 | XP_009941974.1 | 215 | 83.26% | 92% |
| Протоботропс мукроскваматус | Ядовитая гадюка | Squamata | 312 | XP_015672610.1 | 219 | 82.16% | 89% |
| Xenopus Tropicalis | Тропическая когтистая лягушка | Анура | 351.8 | XP_031750178.1 | 215 | 74.88% | 86% |
| Notothenia coriiceps | Антарктическая желтобрюхая роккода | Околообразные | 435 | XP_010772860.1 | 244 | 67.21% | 82% |
| Branchiostoma belcheri | Бранкиостома | Амфиоксообразные | 684 | XP_019622820.1 | 215 | 32.09% | 63% |
| Стронгилоцентротус пурпуратус | Пурпурный морской еж | Иглокожие | 684 | XP_030828106.1 | 221 | 36.3% | 59% |
| Aethina tumida | Маленький жук-улей | Жесткокрылые | 797 | XP_019869992.1 | 201 | 35.82% | 49% |
| Crassostrea gigas | Тихоокеанская устрица | Остреоида | 797 | XP_011423125.1 | 209 | 34.93% | 52% |
Эволюция
Прогнозируется, что TMEM267 будет развиваться медленнее, чем Альфа-цепь фибриногена но быстрее чем Цитохром с.[44]

Функция
Клиническое значение
Этот белок был идентифицирован как член большой группы белков, которые составляют фильтр в клетках млекопитающих, который позволяет селективному прохождению белков внутрь и наружу. ресничка, регулирующий содержание.[45] TMEM267 был одним из десяти генов, выбранных с использованием двухвыборочного t-критерия и анализа данных обучения Уилкоксона Манна-Уитни на атопический дерматит (кожное заболевание, характеризующееся сильным зудом, покраснением, шелушением и потерей поверхности кожи) в качестве гена, который предоставил наибольшую информацию о разделении между контрольной и экспериментальной группами.[46] TMEM267 упоминается в статьях, касающихся подавления двух микроРНК, одна из которых участвует в регуляции широкого спектра клеточных функций, таких как пролиферация, апоптоз, миграция и дифференцировка, все из которых жизненно важны для нормального развития клетки сердца.[47][48]
Рак
Было показано, что белок TMEM267 мутировал в 0,1-0,9% колоректальный, желудок, легкое, эндометрий, почка, и рак молочной железы.[49] TMEM267 пострадал от повышенного уровня NUDT21 ген, и был идентифицирован как часть большой группы возможных онкогенов, которые при укорочении 3'-UTR могут вызывать неконтролируемый рост клеток.[50] Он является частью группы генов, которые, возможно, могут определять выживаемость пациентов с PNI +. рак языка.[51] Было показано, что TMEM267 является одним из 26 сверхэкспрессированных генов на хромосоме 5р, что означает, что он принадлежит к группе генов, которые, вероятно, обеспечивают раковые клетки преимуществами в росте и инвазии окружающих клеток.[52] Кроме того, исследователи из Университета Джона Хопкинса подали патент на 63 гена, в том числе TMEM267, экспрессия которого увеличивалась в присутствии HMGA1 белка по сравнению с контрольной группой, который, по их мнению, может быть использован в методе ингибирования раковых стволовых клеток с помощью ингибиторов HMGA1.[53]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000151881 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000074634 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Запись на GeneCards.org о TMEM267
- ^ Запись на GeneCards.org о TMEM267
- ^ Запись UniProtKB на Q0VDI3 (TM267_HUMAN)
- ^ Эльдорадо в Genomatix
- ^ NCBI (Национальный центр биотехнологической информации) Запись AceView на C5orf28[1]
- ^ Запись на GeneCards.org о TMEM267
- ^ ExPASy Compute предсказатель pI / MW [2] /
- ^ Запись SAPS на TMEM267
- ^ Запись SAPS на TMEM267
- ^ Запись ELM для TMEM267
- ^ Запись продома на TMEM267
- ^ Спиральная проекция NetWheels для TMEM267
- ^ Запись MotifFinder на TMEM267
- ^ Хислоп Дж. Н., Марли А., фон Застров М. Роль белков-сортировщиков вакуолярных белков млекопитающих в эндоцитарном переносе неубиквитинированного рецептора, связанного с G-белком, в лизосомы. J Biol Chem 2004; 279: 22522–22531.[3]
- ^ ELM Деталь канонического аргининсодержащего фосфопептидного мотива
- ^ Информация IRF3
- ^ белок дельта-COP
- ^ Вирт, М., Чжан, В., Рази, М. и др. Молекулярные детерминанты, регулирующие избирательное связывание адаптеров и рецепторов аутофагии с белками ATG8. Нац Коммуна 10, 2055 (2019). [4]
- ^ Ромеро, Г., фон Застров, М., и Фридман, П. А. (2011). Роль белков PDZ в регулировании трафика, передачи сигналов и функции GPCR: средства, мотив и возможности. Успехи фармакологии (Сан-Диего, Калифорния), 62, 279–314. [5]
- ^ Детали ELM для LIG_Pex14
- ^ Запись ELM для TMEM267
- ^ Запись в Атласе белков человека на TMEM267
- ^ Прогноз PSORT для TMEM267
- ^ Изобилие белка PaxDb
- ^ Прогноз Чау-Фасмана для TMEM267
- ^ Прогноз GOR4 для TMEM267
- ^ Предсказание Phyre 2 для TMEM267
- ^ Запись в Атласе белков человека на TMEM267
- ^ CSS-Palm для TMEM267
- ^ Прогноз SUMOsp для TMEM267
- ^ GPS для TMEM267
- ^ Прогноз NetPhos для TMEM267
- ^ Прогноз NetACET для TMEM267
- ^ Прогноз NetGlycate для TMEM267
- ^ Прогноз YinOYang для TMEM267
- ^ NCBI (Национальный центр биотехнологической информации) Запись AceView на C5orf28 [6]
- ^ NCBI (Национальный центр биотехнологической информации) Запись AceView на C5orf28 [7]
- ^ Эльдорадо в GenoMatix MatInspector для TMEM267
- ^ NCBI (Национальный центр биотехнологической информации) Запись AceView на C5orf28 [8]
- ^ Данные TimeTree о дате расхождения
- ^ Валентин, Меган Смит, «Полицистин-2 (PKD2), эксцентрик (XNTA) и мекелин (MKS3) в модельном организме с ресничками Paramecium tetraurelia» (2015). Диссертации и диссертации аспирантуры. 419. [9]
- ^ Тадесс, Давит. (2018). Сравнение выбранных параметрических и непараметрических статистических подходов для отбора генов-кандидатов в данных транскриптома. [10]
- ^ Хан, С., Ван, В., Дуань, Л., Хоу, З., Цзэн, Дж., Ли, Л.,… Цзян, Л. (2019). МикроРНК-профилирование пациентов со спорадическим дефектом межпредсердной перегородки. Биотехнология и биотехнологическое оборудование, 33 (1), 510–519. [11]
- ^ Сунь, Сяоянь и Сун, Чжэньхуа и Си, Явэй и Ван, Цзинь-Хуэй. (2018). Профили микроРНК и мРНК в вентральной тегментальной области, относящиеся к стресс-индуцированной депрессии и устойчивости. Прогресс нейропсихофармакологии и биологической психиатрии. 86.10.1016 [12]
- ^ Яо, З., Даровски, К., Сен-Дени, Н., Вонг, В., Оффенспергер, Ф., Вилледё, А.,… Стагляр, И. (2017). Глобальный анализ взаимодействия рецепторной тирозинкиназы и протеинфосфатазы. Молекулярная ячейка, 65 (2), 347–360. [13]
- ^ Xiong, M., Chen, L., Zhou, L., Ding, Y., Kazobinka, G., Chen, Z., & Hou, T. (2019). NUDT21 подавляет прогрессирование рака мочевого пузыря через ANXA2 и LIMK2 путем альтернативного полиаденилирования. Тераностика, 9 (24), 7156–7167. [14]
- ^ Reddy RB, Khora SS, Suresh A (2019) Молекулярные прогностические факторы в клинически и патологически различных когортах плоскоклеточного рака головы и шеи - подход к метаанализу. PLoS ONE 14 (7): e0218989. [15]
- ^ Скотто, Л., Нараян, Г., Нандула, С.В. и другие. Интегративный геномный анализ увеличения хромосомы 5p при раке шейки матки выявил сверхэкспрессированные гены-мишени, включая Дроша. Молекулярный рак 7, 58 (2008). [16]
- ^ Патенты Google




