Карнитин-O-ацетилтрансфераза - Carnitine O-acetyltransferase
Карнитин-O-ацетилтрансфераза также называемый карнитин ацетилтрансфераза (CRAT, или же КОТ)[5] (EC 2.3.1.7 ) является фермент кодируемый геном CRAT, который катализирует то химическая реакция
- ацетил-КоА + карнитин CoA + ацетилкарнитин
где ацетильная группа замещает атом водорода в центральной гидроксильной группе карнитина.[6]
Таким образом, два субстраты этого фермента ацетил-КоА и карнитин, а его два товары находятся CoA и O-ацетилкарнитин. Реакция очень обратима и не зависит от порядка связывания субстратов.[6]
Считается, что различные субклеточные локализации мРНК CRAT являются результатом альтернативное сращивание гена CRAT, предполагаемого дивергентными последовательностями в 5'-области пероксисомальной и митохондриальной кДНК CRAT, а также расположением интрон где последовательности расходятся. Альтернативный сплайсинг этого гена приводит к трем различным изоформам, одна из которых содержит N-концевой митохондриальный транзитный пептид, и было показано, что он находится в митохондриях.[7]
Номенклатура
Этот фермент принадлежит к семейству трансферазы, а именно те ацилтрансферазы переносящие группы, отличные от аминоацильных групп. В систематическое название этого класса ферментов является ацетил-КоА: карнитин-O-ацетилтрансфераза. Другие широко используемые названия включают ацетил-CoA-карнитин-O-ацетилтрансферазу, ацетилкарнитинтрансферазу, карнитин-ацетилкофермент A-трансферазу, карнитинацетилазу, карнитин-ацетилтрансферазу, карнитин-ацетил-CoA-трансферазу и CATC. Этот фермент участвует в метаболизм аланина и аспартата.
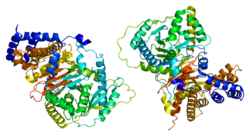
Структура
Обычно карнитин ацетилтрансферазы имеют молекулярную массу около 70 кДа и содержат около 600 остатков1. CRAT содержит два домена, N-домен и C-домен, и состоит из 20 α-спиралей и 16 β-цепей. N-домен состоит из восьмицепочечного β-листа, фланкированного с обеих сторон восемью α-спиралями. Шестицепочечный смешанный β-лист и одиннадцать α-спиралей составляют С-домен фермента.
При сравнении ядра двух доменов отражают существенно схожую укладку пептидного остова. Это происходит, несмотря на то, что только 4% аминокислот, составляющих эти пептидные скелеты, соответствуют друг другу.[5]
Активный сайт
His343 является каталитическим остатком в CRAT.[8] Он расположен на границе раздела между доменами C и N фермента по направлению к сердцу CRAT. His343 доступен через два канала 15-18 Å, которые подходят к остатку с противоположных концов фермента CRAT. Эти каналы используются субстратами CRAT, один канал для карнитина и один для CoA. Боковая цепь His343 расположена нерегулярно, с δ1 водород кольца азота, связанный с кислородом карбонила на основной цепи аминокислоты.[5][9][10]
Сайт связывания CoA
В связи с тем, что CRAT связывает CoA, а не ацетил-CoA, похоже, что CRAT обладает способностью гидролизовать ацетил-CoA перед взаимодействием с одиночным фрагментом CoA в сайте связывания.[5] КоА связан в линейной конформации с его пантотеновым плечом, связывающимся в активном сайте. Здесь терминальная тиоловая группа пантотеновой руки и ε2 Азот на каталитической боковой цепи His343 образует водородную связь. 3’-фосфат на КоА взаимодействует с остатками Lys419 и Lys423. Также в сайте связывания остатки Asp430 и Glu453 образуют прямую водородную связь друг с другом. Если какой-либо остаток обнаруживает мутацию, это может привести к снижению активности CRAT.[11][12]
Сайт связывания карнитина
Карнитин связывается с CRAT в частично свернутом состоянии, причем его гидроксильная группа и карбоксильная группа обращены в противоположных направлениях. Сам сайт состоит из β-листа C-домена и определенных остатков из N-домена. После связывания поверхность карнитина остается открытой для пространства за пределами фермента. Подобно КоА, карнитин образует водородную связь с азотом ε2 на His343. В случае карнитина связь образуется с его 3-гидроксильной группой. Этот катализ CRAT является стереоспецифическим для карнитина, поскольку стереоизомер 3-гидроксильной группы не может в достаточной степени взаимодействовать с сайтом связывания карнитина CRAT. При связывании с карнитином CRAT претерпевает незначительные конформационные изменения.[5][13][14]
Функция
Ферментный механизм
| карнитин-O-ацетилтрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 трансферазный механизм (His343) | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 2.3.1.7 | ||||||||
| Количество CAS | 9029-90-7 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Остаток His343 в активном центре CRAT действует как основание, способное депротонировать тиольную группу CoA или 3’-гидроксильную группу карнитина в зависимости от направления реакции. Структура CRAT оптимизирует эту реакцию, вызывая прямую водородную связь между His343 и обоими субстратами. Депротонированная группа теперь может атаковать ацетильную группу ацетил-КоА или ацетилкарнитина в своем карбонильном сайте. Реакция протекает напрямую, без образования промежуточного His343-ацетила.
Гидролиз
Катализ может происходить только с одной из двух подложек. Если ацетил-КоА или ацетилкарнитин связывается с CRAT, молекула воды может заполнять другой сайт связывания и действовать как акцептор ацетильной группы.
Катализ с использованием субстрата
Литература предполагает, что группа триметиламмония в карнитине может быть решающим фактором в катализе CRAT. Эта группа демонстрирует положительный заряд, который стабилизирует оксианион в промежуточном продукте реакции. Эта идея подтверждается тем фактом, что положительный заряд карнитина не нужен для связывания активного сайта, но жизненно важен для продолжения катализа. Это было доказано путем синтеза аналога карнитина, лишенного его триметиламмониевой группы. Это соединение могло конкурировать с карнитином за связывание с CRAT, но не могло вызвать реакцию.[15] Появление катализа с использованием субстратов открыло новые стратегии повышения специфичности синтетических субстратов.[16]
Биологическая функция
Имеются данные, свидетельствующие о том, что активность CRAT необходима для перехода клеточного цикла от фазы G1 к фазе S.[17]
Клиническое значение
Люди с наследственным дефицитом активности CRAT подвержены риску развития серьезных сердечных и неврологических проблем.[5]
Снижение активности CRAT наблюдается у людей, страдающих болезнью Альцгеймера.[5]
CRAT и его семейство ферментов имеют большой потенциал в качестве мишеней для разработки терапевтических методов лечения диабета 2 типа и других заболеваний.[18][19][20]
Взаимодействия
CRAT, как известно, взаимодействует с NEDD8, PEX5, SUMO1.[7]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000095321 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000026853 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б c d е ж грамм Jogl G, Tong L (январь 2003 г.). «Кристаллическая структура карнитинацетилтрансферазы и значение для каталитического механизма и транспорта жирных кислот». Клетка. 112 (1): 113–22. Дои:10.1016 / S0092-8674 (02) 01228-X. PMID 12526798. S2CID 18633987.
- ^ а б Бибер LL (1988). «Карнитин». Ежегодный обзор биохимии. 57: 261–83. Дои:10.1146 / annurev.bi.57.070188.001401. PMID 3052273.
- ^ а б «Энтрез Ген: карнитинацетилтрансфераза CRAT».
- ^ МакГарри Дж. Д., Браун Н. Ф. (февраль 1997 г.). «Митохондриальная карнитин-пальмитоилтрансфераза. От концепции к молекулярному анализу». Европейский журнал биохимии / FEBS. 244 (1): 1–14. Дои:10.1111 / j.1432-1033.1997.00001.x. PMID 9063439.
- ^ Джогл Г., Сяо Ю.С., Тонг Л. (ноябрь 2004 г.). «Структура и функции карнитин-ацилтрансфераз». Летопись Нью-Йоркской академии наук. 1033 (1): 17–29. Bibcode:2004НЯСА1033 ... 17J. Дои:10.1196 / анналы.1320.002. PMID 15591000. S2CID 24466239.
- ^ Ву Д., Говиндасами Л., Лиан В., Гу И, Кукар Т., Агбандже-МакКенна М., МакКенна Р. (апрель 2003 г.). «Структура карнитинацетилтрансферазы человека. Молекулярная основа переноса жирных ацилов». Журнал биологической химии. 278 (15): 13159–65. Дои:10.1074 / jbc.M212356200. PMID 12562770.
- ^ Рамзи Р.Р., Гандур Р.Д., ван дер Лейдж FR (март 2001 г.). «Молекулярная энзимология переноса и транспорта карнитина». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 1546 (1): 21–43. Дои:10.1016 / S0167-4838 (01) 00147-9. PMID 11257506.
- ^ Сяо Ю.С., Джогль Г., Тонг Л. (сентябрь 2006 г.). «Кристаллические структуры мышиной карнитинацетилтрансферазы в тройных комплексах с ее субстратами». Журнал биологической химии. 281 (38): 28480–7. Дои:10.1074 / jbc.M602622200. ЧВК 2940834. PMID 16870616.
- ^ Cronin CN (сентябрь 1997 г.). «Консервативный серин-треонин-сериновый мотив карнитин-ацилтрансфераз участвует в связывании карнитина и стабилизации переходного состояния: исследование сайт-направленного мутагенеза». Сообщения о биохимических и биофизических исследованиях. 238 (3): 784–9. Дои:10.1006 / bbrc.1997.7390. PMID 9325168.
- ^ Сяо Ю.С., Джогль Г., Тонг Л. (июль 2004 г.). «Структурные и биохимические исследования субстратной селективности карнитинацетилтрансферазы». Журнал биологической химии. 279 (30): 31584–9. Дои:10.1074 / jbc.M403484200. PMID 15155726.
- ^ Саид А., Макмиллин Дж. Б., Волкович П. Е., Бруйетт В. Дж. (Сентябрь 1993 г.). «Ферментативный катализ карнитинацилтрансферазы требует положительного заряда на кофакторе карнитина». Архивы биохимии и биофизики. 305 (2): 307–12. Дои:10.1006 / abbi.1993.1427. PMID 8373168.
- ^ Далл'Акуа В., Картер П. (январь 2000 г.). «Катализ с использованием субстрата: молекулярные основы и биологическое значение». Белковая наука. 9 (1): 1–9. Дои:10.1110 / пс.9.1.1. ЧВК 2144443. PMID 10739241.
- ^ Бруннер С., Крамар К., Денхардт Д. Т., Хофбауэр Р. (март 1997 г.). «Клонирование и характеристика мышиной карнитинацетилтрансферазы: доказательства необходимости во время прогрессирования клеточного цикла». Биохимический журнал. 322 (2): 403–10. Дои:10.1042 / bj3220403. ЧВК 1218205. PMID 9065756.
- ^ Андерсон RC (февраль 1998 г.). «Карнитин пальмитоилтрансфераза: жизнеспособная мишень для лечения NIDDM?». Текущий фармацевтический дизайн. 4 (1): 1–16. PMID 10197030.
- ^ Giannessi F, Chiodi P, Marzi M, Minetti P, Pessotto P, De Angelis F, Tassoni E, Conti R, Giorgi F, Mabilia M, Dell'Uomo N, Muck S, Tinti MO, Carminati P, Arduini A (июль 2001 г. ). «Обратимые ингибиторы карнитин пальмитоилтрансферазы с широким химическим разнообразием в качестве потенциальных противодиабетических средств». Журнал медицинской химии. 44 (15): 2383–6. Дои:10.1021 / jm010889 +. PMID 11448219.
- ^ Вагман А.С., Нусс Дж.М. (апрель 2001 г.). «Современные методы лечения и новые цели для лечения диабета». Текущий фармацевтический дизайн. 7 (6): 417–50. Дои:10.2174/1381612013397915. PMID 11281851.
дальнейшее чтение
- Чейз Дж. Ф., Пирсон Д. Д., Таббс П. К. (январь 1965 г.). «Приготовление кристаллин карнитинацетилтрансферазы». Biochimica et Biophysica Acta (BBA) - нуклеиновые кислоты и синтез белков. 96: 162–5. Дои:10.1016/0005-2787(65)90622-2. PMID 14285260.
- Фридман С., Френкель Г. (декабрь 1955 г.). «Обратимое ферментативное ацетилирование карнитина». Архивы биохимии и биофизики. 59 (2): 491–501. Дои:10.1016/0003-9861(55)90515-4. PMID 13275966.
- Миядзава С., Озаса Х., Фурута С., Осуми Т., Хашимото Т. (февраль 1983 г.). «Очистка и свойства карнитинацетилтрансферазы из печени крысы». Журнал биохимии. 93 (2): 439–51. Дои:10.1093 / oxfordjournals.jbchem.a134198. PMID 6404901.
]