Протеородопсин - Proteorhodopsin
Эта статья может быть слишком техническим для большинства читателей, чтобы понять. Пожалуйста помогите улучшить это к сделать понятным для неспециалистов, не снимая технических деталей. (Май 2016) (Узнайте, как и когда удалить этот шаблон сообщения) |
| Протеородопсин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Proteorhodopsin Cartoon Visualization by ELViture | |||||||||
| Идентификаторы | |||||||||
| Символ | Бак_родопсин | ||||||||
| Pfam | PF01036 | ||||||||
| ИнтерПро | TCDB | ||||||||
| PROSITE | PDOC00291 | ||||||||
| SCOP2 | 2-комн. / Объем / СУПФАМ | ||||||||
| TCDB | 3.E.1 | ||||||||
| OPM суперсемейство | 6 | ||||||||
| Белок OPM | 4hyj | ||||||||
| |||||||||
Протеородопсин (также известный как родопсин) - это семья более 50 человек светочувствительный ретинилиденовые белки, больший семья из трансмембранные белки это использование сетчатка как хромофор для свето-опосредованной функциональности, в этом случае протонный насос. Некоторые гомологи существуют в виде пентамеров или гексамеров.[требуется разъяснение ] пРодопсин содержится в морской планктонный бактерии, археи и эукариоты (protae ), но был первым обнаруженный в бактериях.[1][2][3][4]
Его название происходит от протеобактерии которые названы в честь Древнегреческий Πρωτεύς (Протей ), рано море Бог упомянутый Гомер в качестве "Старик моря ", Ῥόδος (rhódon) для"Роза "из-за розоватого цвета, и ψις (опсис ) для "взгляда". Некоторые члены семьи, Гомологичный родопсин -подобно пигменты, т.е. бактериородопсин (их более 800 видов) имеют Сенсорные функции подобно опсины, интеграл для визуальная фототрансдукция. Многие из этих сенсорных функций неизвестны - например, функция Нейропсин в сетчатке человека.[5] Известно, что члены имеют разные поглощение спектры, включая зеленый и синий видимый свет.[6][7][8][9][10][11]
Открытие
Протеородопсин (PR или pRhodopsin) был впервые обнаружен в 2000 г. бактериальная искусственная хромосома из ранее невозделываемых морских γ-протеобактерии, по-прежнему упоминается только их метагеномные данные риботипа, SAR86. Исследование было результатом совместных усилий четырех сторон: Одед Бежа, Марселино Т. Сузуки и Эдвард Ф. Делонг в Научно-исследовательский институт аквариума Монтерей-Бэй (Моссленд, Калифорния), Л. Аравинд и Евгений В Кунин в Национальном центре биотехнологической информации (Bethesda, MD), Эндрю Хадд, Лин П. Нгуен, Стеван Б. Йованович, Кристиан М. Гейтс и Робер А. Фельдман из Molecular Dynamics (Саннивейл, Калифорния) и, наконец, Джон и Елена Спудич на кафедре микробиологии и молекулярной генетики Научный центр здоровья Техасского университета в Хьюстоне. Было обнаружено, что больше видов γ-протеобактерий, как грамположительных, так и отрицательных, экспрессируют белок.[1]
Распределение
Образцы бактерий, экспрессирующих протеородопсин, были получены из Восточной Азии. Тихий океан, Центральная часть северной части Тихого океана и Южный океан, Антарктида.[12] Впоследствии гены вариантов протеородопсина были идентифицированы в образцах из Средиземноморье, Красное море, то Саргассово море, и Японское море, а Северное море.[4][6]
Варианты протеородопсина не распределяются случайным образом, а распределяются по глубинным градиентам на основе максимальной настройки поглощения конкретного холопротеин последовательность; это в основном из-за электромагнитное поглощение водой который создает длину волны градиенты относительно глубины. Oxyrrhis марина это Динофлагеллята протист с поглощающим зеленый цвет протеородопсином (результат группы L109), который существует в основном в мелководных бассейнах и на берегах, где еще доступен зеленый свет. Карлодиниум micrum, другой динолагелат, экспрессирует протеородопсин с синей настройкой (E109), который может быть связан с его глубоководным вертикальные миграции.[3] О. Марина изначально считалась гетеротроф, однако протеородопсин вполне может принимать участие в функционально значимом виде, поскольку он был наиболее широко экспрессируемым ядерным геном и, кроме того, неравномерно распределен в организме, что позволяет предположить некоторые органелла мембрана функция. Ранее единственными эукариотическими белками, трансформирующими солнечную энергию, были Фотосистема I и Фотосистема II. Было высказано предположение, что латеральный перенос генов - это метод, с помощью которого протеородопсин проник во многие типы. Бактерии, археи и эукарии колонизируют фотическая зона где они выходят на свет; Протеородопсин смог распространиться через эту зону, но не в другие части водной толщи.[3][4][9][13][14]
Таксономия
Протеородопсин принадлежит к семейству аналогичных ретинилиденовых белков, наиболее похожих на его археальные гомологи галородопсин и бактериородопсин. Сенсорный родопсин был открыт Франц Кристиан Болль в 1876 г.[11][15] Бактериородопсин был открыт в 1971 году и назван в 1973 году, и в настоящее время известно, что он существует только в области архей, но не в бактериях.[16] Галородопсин был впервые обнаружен и назван в 1977 году.[17] И бактериородопсин, и галородопсин существуют только в домене Archea, тогда как протеородопсин охватывает бактерии, археи и эукариоты. Протеородопсин разделяет семь трансмембранных α-спирали сетчатка, ковалентно связанная механизмом основания Шиффа с лизин остаток в седьмой спирали (спираль G). Бактериородопсин, как и протеородопсин, представляет собой протонный насос, управляемый светом. Сенсорный родопсин - это G-связанный белок, участвующий в зрении.[1][17]
Активный сайт
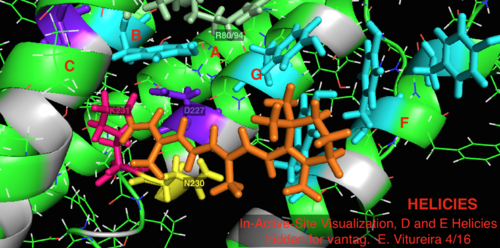
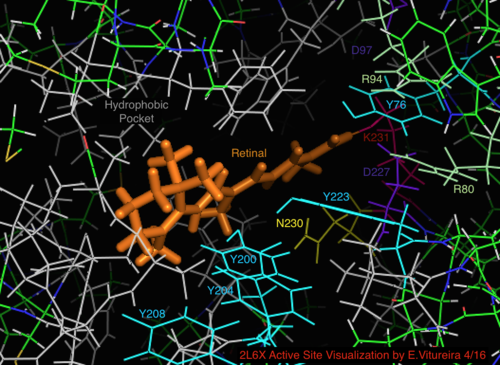
По сравнению с его более известным архейным гомологом бактериородопсином, большинство остатков активного центра, имеющих известное значение для механизма бактериородопсина, консервативны в протеородопсине. Однако сходство последовательностей в значительной степени не сохраняется ни для гало-, ни для бактериородопсина. Гомологи активный сайт остатки Arg 82, Asp 85 (первичный протон акцептор), Asp 212 и Lys 216 ( сетчатка База Шиффа сайт связывания) в бактериородопсине консервативны как Arg94, Asp97, Asp227 и Lys231 в протеородопсине. Однако в протеородопсине нет карбоновая кислота остатки, непосредственно гомологичные Glu 194 или Glu204 бактериородопсина (или Glu 108 и 204 в зависимости от варианта бак-родопсина), которые, как считается, участвуют в пути высвобождения протонов на внеклеточной поверхности. Однако Asp97 и Arg94 могут заменять эту функциональную группу без непосредственной близости остатков, как в бактериородопсине. Кафедра химии Сиракузского университета решительно продемонстрировала, что Asp97 не может быть группой, выделяющей протон, поскольку высвобождение происходило при форсированных условиях, при которых группа аспарагиновой кислоты оставалась протонированной.[18][19][20][21]
Лиганд
Семейство галопротеинов родопсина разделяет лиганд сетчатки, альдегид витамина А, один из многих типов витамина А. сопряженный поли-ненасыщенный хромофор (полиен ), получен из плотоядный диетой или каротиновым путем (β-каротин 15,15'-моноксигеназа ).
Функция
Протеородопсин действует во всех океанах Земли как насос H +, управляемый светом, по механизму, аналогичному действию бактериородопсина. Как и в случае бактериородопсина, сетчатка хромофор протеородопсина ковалентно связан с апопротеин через протонированный База Шиффа в Lys231. Конфигурация хромофора сетчатки в нефотолизированный протеородопсин преимущественно полностью транс[18], и изомеризуется до 13-цис при освещении светом. Было предложено несколько моделей полного фотоцикла протеородопсина на основе FTIR и УФ – видимый спектроскопия; они напоминают известные модели фотоциклов для бактериородопсина.[18][20][21][22] Полные фотосистемы на основе протеородопсина были обнаружены и экспрессированы в E. coli, что придает им дополнительную способность опосредованного светом градиента энергии для генерации АТФ без внешней потребности в сетчатке или предшественниках; с геном PR, пять других белков кодируют путь биосинтеза фотопигмента.[23]
Генная инженерия
Если ген протеородопсина вставлен в Кишечная палочка и ретиналь передается этим модифицированным бактерии, то они будут включать пигмент в их клеточная мембрана и будет качать H + при наличии света. Темно-фиолетовый цвет представляет собой четко трансформированные колонии из-за поглощения света. Протонные градиенты можно использовать для питания других мембранных белковых структур или для подкисления органелл везикулярного типа.[1] Далее было продемонстрировано, что протонный градиент, генерируемый протеородопсином, можно использовать для генерации АТФ.[23]
Галерея

Голоэнзим (зеленый) с помеченными спиралями A-G (фиолетовый), а также лиганд сетчатки (оранжевый)

Поверхностная визуализация протеородопсина, показывающая терминалы

Визуализация связанного с сетчаткой активного сайта структуры белка 2L6X пРодопсина, остатки закодированы цветом и помечены активностью, лиганд оранжевый.

2L6x In-Active-Site Мультяшная визуализация с цветовой кодировкой и маркировкой, спирали D и E, скрытые для удобства, сайт связывания лиганда сетчатки
Рекомендации
- ^ а б c d Бежа О, Аравинд Л., Кунин Е.В., Сузуки М.Т., Хадд А., Нгуен Л.П., Йованович С.Б., Гейтс С.М., Фельдман Р.А., Спудич Дж.Л., Спудич Е.Н., Делонг Е.Ф. (сентябрь 2000 г.). «Бактериальный родопсин: свидетельство нового типа фототрофии в море». Наука. 289 (5486): 1902–6. Bibcode:2000Sci ... 289.1902B. Дои:10.1126 / science.289.5486.1902. PMID 10988064.
- ^ Лин С., Чжан Х, Чжуан И, Тран Б., Джилл Дж (ноябрь 2010 г.). «Метатранскриптомический анализ на основе сплайсинга на основе лидера приводит к распознаванию скрытых геномных особенностей динофлагеллят». Труды Национальной академии наук Соединенных Штатов Америки. 107 (46): 20033–8. Bibcode:2010PNAS..10720033L. Дои:10.1073 / pnas.1007246107. ЧВК 2993343. PMID 21041634.
- ^ а б c Сламовиц СН, Окамото Н., Бурри Л., Джеймс Э.Р., Килинг П.Дж. (2011). «Бактериальный протонный насос протеородопсина у морских эукариот». Nature Communications. 2 (2): 183. Bibcode:2011NatCo ... 2E.183S. Дои:10.1038 / ncomms1188. PMID 21304512.
- ^ а б c Фригаард Н.Ю., Мартинес А., Минсер Т.Дж., Делонг Е.Ф. (февраль 2006 г.). «Перенос латерального гена протеородопсина между морскими планктонными бактериями и археями». Природа. 439 (7078): 847–50. Bibcode:2006Натура.439..847F. Дои:10.1038 / природа04435. PMID 16482157.
- ^ Бур ЭД, Юэ В.В., Рен Х, Цзян З, Ляо Х.В., Мэй Х, Вемараджу С., Нгуен М.Т., Рид Р.Р., Ланг Р.А., Яу К.В., Ван Гельдер Р.Н. (20 октября 2015 г.). ""Опосредованное нейропсином (OPN6) фотоэнтезирование местных циркадных осцилляторов в сетчатке и роговице млекопитающих"". Труды Национальной академии наук. 112 (42): 13093–13098. Bibcode:2015ПНАС..11213093Б. Дои:10.1073 / pnas.1516259112. ЧВК 4620855. PMID 26392540.
- ^ а б Бежа О, Спудич Э. Н., Спудич Дж. Л., Леклерк М., Делонг Э. Ф. (июнь 2001 г.). «Фототрофия протеородопсина в океане». Природа. 411 (6839): 786–9. Дои:10.1038/35081051. PMID 11459054.
- ^ Ман Д., Ван В., Сабехи Дж., Аравинд Л., Пост AF, Массана Р., Спудич Е. Н., Спудич Дж. Л., Бежа О (апрель 2003 г.). «Диверсификация и спектральная настройка морских протеородопсинов». Журнал EMBO. 22 (8): 1725–31. Дои:10.1093 / emboj / cdg183. ЧВК 154475. PMID 12682005.
- ^ Келемен Б.Р., Ду М., Дженсен Р.Б. (декабрь 2003 г.). «Протеородопсин в живом цвете: разнообразие спектральных свойств в живых бактериальных клетках». Biochimica et Biophysica Acta (BBA) - Биомембраны. 1618 (1): 25–32. Дои:10.1016 / j.bbamem.2003.10.002. PMID 14643930.
- ^ а б Сабехи Г., Киркуп BC, Розенберг М., Стамблер Н., Польз М.Ф., Бежа О (май 2007 г.). «Адаптация и настройка спектра в расходящихся морских протеородопсинах из восточного Средиземноморья и Саргассова морей». Журнал ISME. 1 (1): 48–55. Дои:10.1038 / ismej.2007.10. PMID 18043613.
- ^ Энциклопедия неруологических наук. Академическая пресса. 29 апреля 2014. с. 441. ISBN 978-0-12-385158-1.
- ^ а б Гиз, Артур К. (сентябрь 2013 г.). Фотофизиология: общие принципы; Воздействие света на растения. Эльзевир. п. 9. ISBN 978-1-4832-6227-7.
- ^ Вентер Дж. К., Ремингтон К., Гейдельберг Дж. Ф., Халперн А. Л., Руш Д., Эйзен Дж. А., Ву Д., Полсен И., Нельсон К. Э., Нельсон В., Фаутс Д. Е., Леви С., Кнап А. Х., Ломас М. В., Нилсон К., Уайт О, Петерсон Дж. , Хоффман Дж., Парсонс Р., Баден-Тилсон Х., Пфаннкоч С., Роджерс Ю. Х., Смит Х.О. (апрель 2004 г.). «Секвенирование экологического генома Саргассова моря». Наука. 304 (5667): 66–74. Bibcode:2004Наука ... 304 ... 66V. CiteSeerX 10.1.1.124.1840. Дои:10.1126 / science.1093857. PMID 15001713.
- ^ Giovannoni, SJ; Bibbs, L; Чо, JC; Stapels, MD; Desiderio, R; Vergin, KL; Rappé, MS; Лэйни, S; Вильгельм, LJ; Трипп, HJ; Mathur, EJ; Барофски, Д.Ф. (3 ноября 2005 г.). «Протеородопсин в повсеместной морской бактерии SAR11». Природа. 438 (7064): 82–5. Bibcode:2005Натура 438 ... 82Г. Дои:10.1038 / природа04032. PMID 16267553.
- ^ Кушваха, Южная Каролина; Кейтс, М. (23 августа 1973 г.). «Выделение и идентификация« бактериородопсина »и минорных C40-каротиноидов в Halobacterium cutirubrum». Biochimica et Biophysica Acta (BBA) - липиды и липидный метаболизм. 316 (2): 235–43. Дои:10.1016/0005-2760(73)90013-1. PMID 4741911.
- ^ Энциклопедия неврологических наук. Академическая пресса. Апрель 2014. с. 441. ISBN 978-0-12-385158-1.
- ^ Oesterhelt, D; Stoeckenius, W. (29 сентября 1971 г.). «Родопсиноподобный белок пурпурной мембраны Halobacterium halobium». Природа Новая Биология. 233 (39): 149–52. Дои:10.1038 / newbio233149a0. PMID 4940442.
- ^ а б Мацуно-Яги, А; Мукохата, Y (9 сентября 1977 г.). «Две возможные роли бактериородопсина; сравнительное исследование штаммов Halobacterium halobium, различающихся пигментацией». Сообщения о биохимических и биофизических исследованиях. 78 (1): 237–43. Дои:10.1016 / 0006-291x (77) 91245-1. PMID 20882.
- ^ а б c Диумаев А.К., Браун Л.С., Ши Дж., Спудич Е.Н., Спудич Дж. Л., Лани Дж. К. (апрель 2002 г.). «Переносы протонов в фотохимическом реакционном цикле протеородопсина». Биохимия. 41 (17): 5348–58. Дои:10.1021 / bi025563x. PMID 11969395.
- ^ Парта Р., Кребс Р., Катерино Т.Л., Брейман М.С. (июнь 2005 г.). «Ослабленное связывание консервативного аргинина с хромофором протеородопсина и его противоионом подразумевает структурные отличия от бактериородопсина». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1708 (1): 6–12. Дои:10.1016 / j.bbabio.2004.12.009. PMID 15949979.
- ^ а б Диумаев А.К., Ван Дж. М., Балинт З., Варо Г., Ланьи Дж. К. (июнь 2003 г.). «Транспорт протонов с помощью протеородопсина требует, чтобы противоион Asp-97 сетчатки глаза был анионным». Биохимия. 42 (21): 6582–7. Дои:10.1021 / bi034253r. PMID 12767242.
- ^ а б Кребс Р.А., Алексиев Ю., Партха Р., ДеВита А.М., Брайман М.С. (апрель 2002 г.). «Обнаружение быстрого высвобождения активируемого светом H + и образования промежуточных продуктов М из протеородопсина». BMC Physiology. 2: 5. Дои:10.1186/1472-6793-2-5. ЧВК 103662. PMID 11943070.
- ^ Сяо Ю., Партха Р., Кребс Р., Брайман М. (январь 2005 г.). «Фурье-спектроскопия с временным разрешением фотоинтерфейсов, участвующих в быстром переходном высвобождении H + протеородопсином». Журнал физической химии B. 109 (1): 634–41. Дои:10.1021 / jp046314g. PMID 16851056.
- ^ а б Мартинес А., Брэдли А.С., Вальдбауэр-младший, Summons RE, Делонг Е.Ф. (2007). «Экспрессия гена фотосистемы протеородопсина делает возможным фотофосфорилирование в гетерологичном хозяине». PNAS. 104 (13): 5590–5595. Bibcode:2007ПНАС..104.5590М. Дои:10.1073 / pnas.0611470104. ЧВК 1838496. PMID 17372221.




