Эвтектическая система - Eutectic system
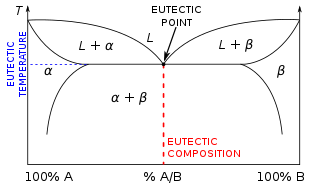
А эвтектическая система (/juˈтɛkтɪk/ тыTEK-тик )[1] от греческого «εύ» (eu = колодец) и «τήξις» (tēxis = плавление) - однородная смесь веществ, которые тает или затвердевает на одном температура это ниже, чем температура плавления любого из составляющих.[2]
Температура эвтектики - это минимально возможная температура плавления из всех соотношения смешивания для вовлеченных компонентов.
При нагревании любого другого соотношения смеси и достижении температуры эвтектики один компонент решетка сначала расплавится, в то время как температура смеси должна еще больше повыситься, чтобы (все) другие компоненты решетки расплавились. И наоборот, когда неэвтектическая смесь остывает, каждый компонент смеси затвердевает (образует свою решетку) при определенной температуре, пока весь материал не станет твердый.
Координаты, определяющие эвтектическая точка на фазовая диаграмма являются эвтектическое процентное соотношение (на атомно-молекулярное соотношение ось (Ось X) диаграммы) и эвтектическая температура (на Y ось диаграммы).[3]
Не все бинарные сплавы имеют точки эвтектики, потому что валентные электроны составляющих видов не всегда совместимы,[требуется разъяснение ] при любом соотношении компонентов смеси, чтобы сформировать новый тип совместной кристаллической решетки. Например, в системе серебро-золото температура плавления (ликвидус ) и температуры замораживания (солидус ) "встречаются в конечных точках чистых элементов оси атомных соотношений, при этом слегка разделяясь в области смеси на этой оси".[4]
Период, термин эвтектика был изобретен в 1884 году британским физиком и химиком Фредерик Гатри (1833–1886).[5]
Эвтектический фазовый переход

Эвтектическое затвердевание определяется следующим образом:[6]
Такой тип реакции инвариантная реакция, потому что это в тепловое равновесие; Другой способ определить это - изменение Свободная энергия Гиббса равно нулю. Фактически это означает жидкость и два твердые растворы все сосуществуют одновременно и находятся в химическое равновесие. Также есть термическая остановка на время смены фазы, в течение которого температура системы не меняется.[6]
Полученное твердое макроструктура от эвтектической реакции зависит от нескольких факторов. Наиболее важным фактором является то, как два твердых раствора зарождаются и растут. Самая распространенная структура - это ламеллярная структура, но другие возможные структуры включают стержневидные, шаровидные и игольчатый.[7]
Неэвтектические композиции
Составы эвтектических систем, не входящие в состав эвтектических, можно классифицировать как доэвтектический или заэвтектический. Доэвтектические составы - это составы с меньшим процентным составом видов β и большим составом видов α, чем эвтектический состав (E), в то время как заэвтектические растворы характеризуются как растворы с более высоким составом видов β и более низким составом видов α, чем эвтектические. сочинение. При понижении температуры неэвтектического состава жидкая смесь будет осаждать один компонент смеси раньше другого. В заэвтектическом растворе будет проэвтектоидная фаза вида β, тогда как доэвтектический раствор будет иметь проэвтектическую α-фазу.[6]
Типы
Сплавы
Эвтектика сплавы имеют два или более материала и имеют эвтектический состав. Когда неэвтектический сплав затвердевает, его компоненты затвердевают при разных температурах, демонстрируя диапазон плавления пластика. И наоборот, когда хорошо перемешанный эвтектический сплав плавится, это происходит при одной резкой температуре. Различные фазовые превращения, которые происходят во время затвердевания конкретного состава сплава, можно понять, проведя вертикальную линию от жидкой фазы к твердой фазе на фазовой диаграмме этого сплава.
Некоторые виды использования включают:
- Реле перегрузки из эвтектического сплава NEMA для электрическая защита 3-х фазных двигателей для насосов, вентиляторов, конвейеров и прочего заводского технологического оборудования.[8]
- Эвтектические сплавы для пайка, состоящий из банка (Sn), вести (Pb) а иногда Серебряный (Ag) или золото (Au) - особенно Sn63Pb37 формула сплава для электроники
- Литейные сплавы, такие как алюминий-кремний и чугун (при составе 4,3% углерода в железе, образующем аустенит -цементит эвтектика)
- Кремниевые чипы связаны с позолоченными подложками через эвтектику кремний-золото за счет применения ультразвуковой энергия к чипу. Увидеть эвтектическая связь.
- Пайка, где диффузия может удалить легирующие элементы из соединения, так что эвтектическое плавление возможно только на ранней стадии процесса пайки.
- Температурный отклик, например, Металл Вуда и Металл поля для пожарные спринклеры
- Нетоксичный Меркурий замены, такие как Галинстан
- Экспериментальный стеклообразные металлы, с чрезвычайно высокой прочностью и коррозия сопротивление
- Эвтектические сплавы натрий и калий (NaK ), которые являются жидкими при комнатной температуре и используются как охлаждающая жидкость в экспериментальных ядерные реакторы на быстрых нейтронах.
Другие

- Натрия хлорид и воды образуют эвтектическую смесь с точкой эвтектики -21,2 ° C[9] и 23,3% соли по массе.[10] Эвтектическая природа соли и воды используется, когда соль разбрасывается по дорогам, чтобы помочь уборка снега, или смешанный со льдом для получения низких температур (например, в традиционных мороженое изготовление).
- Этанол – вода имеет необычно смещенную эвтектическую точку, т.е. она близка к чистому этанолу, что устанавливает максимальное доказательство, достижимое частичное замораживание.
- «Солнечная соль», 60% NaNO3 и 40% KNO3, образует эвтектическую смесь расплавленных солей, которая используется для накопитель тепловой энергии в концентрированная солнечная энергия растения.[11] Чтобы снизить температуру плавления эвтектики солнечных расплавов солей, нитрат кальция используется в следующей пропорции: 42% Ca (NO3)2, 43% KNO3, и 15% NaNO3.
- Лидокаин и прилокаин - оба являются твердыми веществами при комнатной температуре - образуют эвтектику, представляющую собой масло с температурой плавления 16 ° C (61 ° F), которое используется в эвтектическая смесь местного анестетика (EMLA) препараты.
- Ментол и камфора Оба твердых вещества при комнатной температуре образуют эвтектику, которая является жидкостью при комнатной температуре в следующих пропорциях: 8: 2, 7: 3, 6: 4 и 5: 5. Оба вещества являются общими ингредиентами фармацевтических препаратов для немедленного приема.[12]
- Минералы может образовывать эвтектические смеси в огненный скалы, дающие начало характерным текстуры срастания выставлены, например, гранофир.[13]
- Некоторые чернила представляют собой эвтектические смеси, что позволяет струйные принтеры работать при более низких температурах.[14]
Другие критические моменты

Эвтектоид
Когда раствор выше точки превращения является твердым, а не жидким, может происходить аналогичное эвтектоидное превращение. Например, в системе железо-углерод аустенит фаза может претерпевать эвтектоидное преобразование с образованием феррит и цементит, часто в ламеллярных структурах, таких как перлит и бейнит. Эта эвтектоидная точка возникает при 723 ° C (1333 ° F) и примерно 0,8% углерода.[15]
Перитектоид
А перитектоид трансформация - это вид изотермический обратимая реакция это два твердых фазы реагируя друг с другом при охлаждении двоичной, тройной, ..., -ари сплав для создания совершенно другой и единой твердой фазы.[16] Реакция играет ключевую роль в порядке и разложение из квазикристаллический фазы в нескольких типах сплавов.[17] Аналогичный структурный переход предсказывается и для вращающиеся столбчатые кристаллы.
Перитектический

Перитектические превращения также похожи на эвтектические реакции. Здесь жидкая и твердая фаза в фиксированных пропорциях реагируют при фиксированной температуре с образованием единой твердой фазы. Поскольку твердый продукт образуется на границе раздела между двумя реагентами, он может образовывать диффузионный барьер и обычно заставляет такие реакции протекать намного медленнее, чем эвтектические или эвтектоидные превращения. Из-за этого, когда перитектический состав затвердевает, он не показывает ламеллярная структура что обнаруживается при эвтектическом затвердевании.
Такое преобразование существует в системе железо-углерод, как видно в верхнем левом углу рисунка. Он напоминает перевернутую эвтектику, в которой δ-фаза объединяется с жидкостью для получения чистого аустенит при 1495 ° C (2723 ° F) и 0,17% углерода.
При температуре перитектического разложения соединение вместо плавления разлагается на другое твердое соединение и жидкость. Доля каждого определяется правило рычага. в Аль-Ау На фазовой диаграмме, например, можно увидеть, что только две фазы плавятся конгруэнтно, AuAl2 и Au2Al , а остальные перитектически разлагаются.
Эвтектический расчет
Состав и температуру эвтектики можно рассчитать по энтальпии и энтропии плавления каждого компонента.[18]
Свободная энергия Гиббса г зависит от собственного дифференциала:
Таким образом г/Т производная при постоянном давлении рассчитывается по следующему уравнению:
Химический потенциал рассчитывается, если принять, что активность равна концентрации:
В состоянии равновесия , таким образом получается как
С помощью[требуется разъяснение ] и интеграция дает
Константа интегрирования K может быть определен для чистого компонента с температурой плавления и энтальпия плавления :
Получаем соотношение, определяющее молярную долю как функцию температуры для каждого компонента:
Смесь п компоненты описываются системой
что может быть решено
Смотрите также
- Азеотроп, или смесь постоянного кипения
- Депрессия точки замерзания
использованная литература
- ^ «эвтектика». Словарь Merriam-Webster.
- ^ Гатри, Ф. (1884). «Об эвтексии». Физическое общество: 462–482.
- ^ Смит и Хашеми, 2006 г., стр. 326–327
- ^ «Сборник фазовых диаграмм». www.crct.polymtl.ca.
- ^ Гатри, Фредерик (1884) «Об эвтексии», Философский журнал, 5-я серия, 17 : 462–482. С п. 462: «Главный аргумент настоящего сообщения основан на существовании составных тел, главной характеристикой которых является низкая температура плавления. Это свойство тел можно назвать Eutexia †, то есть тела, обладающие эвтектическими телами или эвтектиками (εύ τήκειν)."
- ^ а б c Смит и Хашеми, 2006 г., п. 327.
- ^ Смит и Хашеми, 2006 г. С. 332–333.
- ^ «Эксплуатация перегрузок». Получено 2015-08-05.
- ^ Малдрю, Кен; Локсли Э. МакГанн (1997). «Фазовые диаграммы». Криобиология - краткий курс. Университет Калгари. Архивировано из оригинал на 2006-06-15. Получено 2006-04-29.
- ^ Сенезе, Фред (1999). «Разве соленая вода расширяется так же, как пресная вода при замерзании?». Решения: часто задаваемые вопросы. Химический факультет Фростбургского государственного университета. Получено 2006-04-29.
- ^ «Свойства расплавленных солей». Технические характеристики солнечной электростанции Архимеда.
- ^ Phaechamud, Thawatchai; Тунтаравонгса, Сарун; Чароэнсуксай, Пурин (октябрь 2016 г.). «Поведение при испарении и характеристика эвтектического растворителя и эвтектического раствора ибупрофена». AAPS PharmSciTech. 17 (5): 1213–1220. Дои:10.1208 / с12249-015-0459-х. ISSN 1530-9932. PMID 26669887.
- ^ Фихтер, Линн С. (2000). «Магматические фазовые диаграммы». Магматические породы. Университет Джеймса Мэдисона. Получено 2006-04-29.
- ^ Дэвис, Николас А .; Беатрис М. Николас (1992). «Эвтектические составы для струйных термоплавких красок». Бюро патентов и товарных знаков США, Патентная база данных полных текстов и изображений. Ведомство США по патентам и товарным знакам. Получено 2006-04-29.
- ^ «Пример фазовой диаграммы железо-карбид железа». Архивировано из оригинал (PDF) на 16 февраля 2008 г.
- ^ Сборник химической терминологии ИЮПАК, электронная версия. «Перитектоидная реакция» Проверено 22 мая 2007 года.
- ^ Численная модель трансформации перитектоидов. Преобразование перитектоидов Проверено 22 мая 2007 года. В архиве 28 сентября 2007 г. Wayback Machine
- ^ Международный журнал современной физики C, Vol. 15, № 5. (2004), стр. 675–687.
Список используемой литературы
- Смит, Уильям Ф .; Хашеми, Джавад (2006), Основы материаловедения и инженерии (4-е изд.), Макгроу-Хилл, ISBN 978-0-07-295358-9.
дальнейшее чтение
- Аскеланд, Дональд Р .; Прадип П. Фул (2005). Наука и инженерия материалов. Томсон-Инжиниринг. ISBN 978-0-534-55396-8.
- Истерлинг, Эдвард (1992). Фазовые превращения в металлах и сплавах.. CRC. ISBN 978-0-7487-5741-1.
- Мортимер, Роберт Г. (2000). Физическая химия. Академическая пресса. ISBN 978-0-12-508345-4.
- Reed-Hill, R.E .; Реза Аббасчян (1992). Принципы физической металлургии. Томсон-Инжиниринг. ISBN 978-0-534-92173-6.
- Садовей, Дональд (2004). «Фазовые равновесия и фазовые диаграммы» (PDF). 3.091 Введение в химию твердого тела, осень 2004 г.. MIT Open Courseware. Архивировано из оригинал (PDF) на 2005-10-20. Получено 2006-04-12.

![text {Жидкость} xrightarrow [ text {охлаждение}] { text {температура эвтектики}} alpha , , text {твердый раствор} + beta , , text {твердый раствор}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ddd335b6ed20e9308b5e9588ea94d3759fe9fbff)















![{ displaystyle { begin {array} {c} left [{ begin {array} {* {20} c} { Delta x_ {1}} { Delta x_ {2}} { Дельта x_ {3}} vdots { Delta x_ {n-1}} { Delta T} end {array}} right] = left [{ begin {array} {* {20} c} {1 / x_ {1}} & 0 & 0 & 0 & 0 & {- { frac {H_ {1} ^ { circ}} {RT ^ {2}}}} 0 & {1 / x_ {2 }} & 0 & 0 & 0 & {- { frac {H_ {2} ^ { circ}} {RT ^ {2}}}} 0 & 0 & {1 / x_ {3}} & 0 & 0 & {- { frac {H_ {3} ^ { circ}} {RT ^ {2}}}} vdots & ddots & ddots & ddots & ddots & { vdots} 0 & 0 & 0 & 0 & {1 / x_ {n-1}} & {- { frac {H_ {n-1} ^ { circ}} {RT ^ {2}}}} { frac {-1} {1- sum limits _ {i = 1} ^ {n-1} {x_ {i}}}} & { frac {-1} {1- sum limits _ {i = 1} ^ {n-1} {x_ {i}}}} & { frac {-1} {1- sum limits _ {i = 1} ^ {n-1} {x_ {i}}}} & { frac {-1} {1- sum limits _ { i = 1} ^ {n-1} {x_ {i}}}} & { frac {-1} {1- sum limits _ {i = 1} ^ {n-1} {x_ {i} }}} & {- { frac {H_ {n} ^ { circ}} {RT ^ {2}}}} end {array}} right] ^ {- 1}. left [{ begin {array} {* {20} c} { ln x_ {1} + { frac {H_ {1} ^ { circ}} {RT}} - { frac {H_ {1} ^ { circ}} {RT_ {1} ^ { circ}}}} { ln x_ {2} + { frac {H_ {2} ^ { circ}} {RT}} - { frac {H_ {2} ^ { circ}} {RT_ {2} ^ { circ}}}} { ln x_ {3} + { frac {H_ {3} ^ { circ}} {RT}} - { frac {H_ {3} ^ { circ}} {RT_ {3} ^ { circ}}}} vdots { ln x_ {n-1} + { frac {H_ {n-1} ^ { circ}} {RT}} - { frac {H_ {n-1} ^ { circ}} {RT_ {n-1} ^ { circ} }}} { ln left ({1- sum limits _ {i = 1} ^ {n-1} {x_ {i}}} right) + { frac {H_ {n} ^ { circ}} {RT}} - { frac {H_ {n} ^ { circ}} {RT_ {n} ^ { circ}}}} end {array}} right] end {массив}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b406139e6e1704cc3d0d07f5cce485c55b01d475)