Родия (II) ацетат - Rhodium(II) acetate
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Родия (II) ацетат | |
| Другие имена Тетраацетат диродия, Тетракис (ацетат) диродий (II), Димер диацетата родия, Тетракис (μ-ацетато) диродий | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.036.425 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| C8ЧАС12О8Rh2 | |
| Молярная масса | 441,99 г / моль |
| Внешность | Изумрудно-зеленый порошок |
| Плотность | 1,126 г / см3 |
| Температура плавления | > 100 ° С |
| Точка кипения | разлагается |
| растворимый | |
| Растворимость в других растворителях | полярные органические растворители |
| Структура | |
| моноклинический | |
| восьмигранный | |
| 0 D | |
| Опасности | |
| Паспорт безопасности | Паспорт безопасности материалов Coleparmer |
| R-фразы (устарело) | 36/38 |
| S-фразы (устарело) | 15, 26, 28А, 37/39 |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | низкая воспламеняемость |
| Родственные соединения | |
Родственные соединения | Ацетат меди (II) Хром (II) ацетат |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Родия (II) ацетат это химическое соединение с формула Rh2(AcO)4, где AcO− это ацетат ион (CH
3CO−
2). Этот темно-зеленый порошок плохо растворяется в полярных растворителях, в том числе в воде. Он используется как катализатор циклопропанирование из алкены.
Подготовка
Ацетат родия (II) обычно получают нагреванием гидратированный хлорид родия (III) в уксусная кислота (CH3COOH):[1] Димер ацетата родия (II) подвергается обмен лиганда, замена ацетатной группы на другую карбоксилаты и родственные группы.[2]
- Rh2(OAc)4 + 4 НО2CR → Rh2(O2CR)4 + 4 ТСЖ
Структура и свойства
В структуре ацетата родия (II) присутствует пара родий атомы, каждый с октаэдрическая молекулярная геометрия, определяемый четырьмя ацетатными атомами кислорода, водой и связью Rh – Rh длиной 2.39Å. Вода аддукт можно обменять, и множество других Базы Льюиса привязать к осевым позициям.[3] Ацетат меди (II) и ацетат хрома (II) принять аналогичные структуры.
Химические свойства
Применение тетраацетата диродия в органическом синтезе было впервые предложено Тейсси и его сотрудниками.[4] Обширный спектр реакций, включая внедрение в связи и циклопропанирование из алкены[5] и ароматный системы.[6] Избирательно связывает рибонуклеозиды (vs. дезоксинуклеозиды ) путем селективного связывания с рибонуклеозидами в их 2 'и 3' -ОЙ группы.[7] Димер ацетата родия (II) по сравнению с ацетат меди (II), является более реактивным и полезным для дифференциации рибонуклеозидов и дезоксинуклеозидов, поскольку он растворим в водный раствор похож на воду, тогда как ацетат меди (II) растворяется только в неводном растворе.
Избранные каталитические реакции
Тетраацетат диродия также используется в качестве катализатор для вставки по связям C – H и X – H (X = N, S, O).
- Циклопропанирование

сквозь разложение диазокарбонильных соединений, внутри- и межмолекулярных циклопропанирование реакции происходят.
- Ароматическое циклоприсоединение
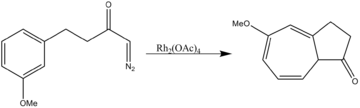
Ацетат родия катализирует оба двухкомпонентных циклоприсоединение а также трехкомпонентные 1,3-диполярные циклоприсоединения.
- C – H вставка

Rh (II) -катализируемый региоселективный внутримолекулярный и региоспецифический межмолекулярный C – H вставка в алифатический и ароматный Связи C – H - полезный метод синтеза разнообразных органических соединений.
- Окисление спиртов

Аллильный и бензиловый спирты были окислены до соответствующих карбонильных соединений с использованием терт-бутилгидропероксид в стехиометрический суммы и Rh2(OAc)4 как катализатор в дихлорметан при температуре окружающей среды.
- Вставка X – H (X = N, S, O)
Рекомендации
- ^ Ремпель, Г. А .; Легздиньш, П .; Smith, H .; Уилкинсон, Г. (1972). Тетракис (ацетат) диродий (II) и аналогичные карбоксилатные соединения. Неорг. Synth. Неорганические синтезы. 13. С. 90–91. Дои:10.1002 / 9780470132449.ch16. ISBN 9780470132449.
- ^ Дойл, М. П. (2000). «Асимметричные реакции присоединения и внедрения каталитически образующихся карбенов металлов». В Одзима, Ивао (ред.). Каталитический асимметричный синтез (2-е изд.). Нью-Йорк: Вили. ISBN 978-0-471-29805-2.
- ^ Cotton, F. A .; Deboer, B.G .; Laprade, M.D .; Pipal, J. R .; Учко, Д. А. (1971). «Кристаллическая и молекулярная структура дигидрата тетраацетата дихрома и дигидрата тетраацетата диродия». Acta Crystallogr B. 27 (8): 1664. Дои:10.1107 / S0567740871004527.
- ^ Paulissen, R .; Reimlinger, H .; Hayez, E .; Hubert, A.J .; Тейссье, П. (1973). «Катализируемые переходным металлом реакции диазосоединений. II: Вставка в гидроксильную связь». Tetrahedron Lett. 14 (24): 2233. Дои:10.1016 / S0040-4039 (01) 87603-6.
- ^ Hubert, A.J .; Ферон, А .; Warin, R .; Тейсси, П. (1976). «Синтез иминоазиридинов из карбодиимидов и диазоэфиров: новый пример реакций карбенов, катализируемых солями переходных металлов». Tetrahedron Lett. 17 (16): 1317. Дои:10.1016 / S0040-4039 (00) 78050-6.
- ^ Anciaux, A.J .; Demonceau, A .; Hubert, A.J .; Ноэлс, А. Ф .; Petiniot, N .; Тейссье, П. (1980). «Каталитический контроль реакций диполей и карбенов; простой и эффективный синтез циклогептатриенов из ароматических соединений путем расширения реакции Бюхнера». J. Chem. Soc., Chem. Commun. (16): 765–766. Дои:10.1039 / C39800000765.
- ^ Бергер, Н. А .; Tarien, E .; Эйххорн, Г. Л. (1972). «Стереоселективная дифференциация между рибонуклеозидами и дезоксинуклеозидами посредством реакции с димером ацетата меди (II)». Природа Новая Биология. 239 (95): 237–40. Дои:10.1038 / newbio239237a0. PMID 4538853.
Ацетилгалогениды и соли ацетат ион | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | Он | ||||||||||||||||||
| LiOAc | Быть (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | AcOOH | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 АЛСОЛ Al (OAc)2ОЙ Al2ТАК4(OAc)4 | Si | п | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Как (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Nb | Пн (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | CD (OAc)2 | В | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Та | W | Re | Операционные системы | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Би (OAc)3 | По | В | Rn | |||
| Пт | Ра | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |||
| ↓ | |||||||||||||||||||
| Ла (OAc)3 | Ce (OAc)Икс | Pr | Nd | Вечера | Sm (OAc)3 | Eu (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Хо (OAc)3 | Э | Тм | Yb (OAc)3 | Лу (OAc)3 | |||||
| Ac | Чт | Па | UO2(OAc)2 | Np | Пу | Am | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||||






