Ацетат ртути (II) - Mercury(II) acetate
 | |
| [[Файл: Меркурий (II) - ацетат ртути-from-xtal-1973-3D-balls-A.png | 220px]] | |
 | |
| Имена | |
|---|---|
| Другие имена ацетат ртути меркуриацетат | |
| Идентификаторы | |
3D модель (JSmol ) |
|
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.014.993 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 1629 |
| |
| |
| Характеристики | |
| C4ЧАС6О4Hg | |
| Молярная масса | 318,678 г / моль |
| Внешность | бело-желтые кристаллы |
| Запах | незначительный уксус запах |
| Плотность | 3,28 г / см3, твердый |
| Температура плавления | 179 ° С (354 ° F, 452 К) (разлагается) |
| 25 г / 100 мл (10 ° С) 100 г / 100 мл (100 ° C) | |
| Растворимость | растворим в алкоголь, диэтиловый эфир |
| −100·10−6 см3/ моль | |
| Опасности | |
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Опасность |
| H300, H310, H330, H373, H400, H410 | |
| P260, P262, P264, P270, P271, P273, P280, P284, P301 + 310, P302 + 350, P304 + 340, P310, P314, P320, P321, P322, P330, P361, P363, P391, P403 + 233, P405, P501 | |
| NFPA 704 (огненный алмаз) | |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 40,9 мг / кг (крыса, перорально) 23,9 мг / кг (мышь, перорально)[1] |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
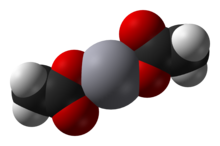
Ацетат ртути (II) это химическое соединение с формула Hg (О2C CЧАС3 )2. Обычно сокращенно Hg (OAc)2, это соединение используется в качестве реагента для получения ртуть соединения из ненасыщенных органических предшественников.
Структура
Ацетат ртути (II) представляет собой твердое кристаллическое вещество, состоящее из изолированной Hg (OAc).2 молекулы с расстояниями Hg-O 2,07 Å. Также присутствуют три длинные, слабые межмолекулярные связи Hg ··· O примерно 2,75 Å, что приводит к слегка искаженной квадратно-пирамидальной геометрии координации при Hg.[2]
Реакции
Arenes пройти «меркурацию» после обработки Hg (OAc)2. Одна ацетатная группа (OAc), остающаяся на ртути, может быть замещена хлоридом:[3]
- C6ЧАС5OH + Hg (OAc)2 → С6ЧАС4(ОН) -2-HgOAc + HOAc
- C6ЧАС4(ОН) -2-HgOAc + NaCl → С6ЧАС4(ОН) -2-HgCl + NaOAc
Hg2+ центр привязан к алкены, вызывая добавление гидроксид и алкоксид. Например, лечение метиловогоакрилат с ацетатом ртути в метанол дает сложный эфир α-ртути:[4]
- Hg (OAc)2 + CH2= CHCO2CH3 + CH3ОЙ → CH3ОСН2CH (HgOAc) CO2CH3 + HOAc
Использование высокого сродства ртути (II) к серным лигандам, Hg (OAc)2 может использоваться как реагент к снимать защиту тиоловые группы в органический синтез. Аналогично Hg (OAc)2 был использован для преобразования тиокарбонат сложные эфиры в дитиокарбонаты:
- (RS)2С = S + H2O + Hg (OAc)2 → (RS)2С = О + HgS + 2 ТСЖ
Ацетат ртути (II) используется для оксимеркурация реакции.
Рекомендации
- ^ «(Органо) алкильные соединения ртути (как Hg)». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ Аллманн, Р. (1973). "Die Struktur des Quecksilber (II) -acetats". Zeitschrift für Kristallographie - Кристаллические материалы. 138 (1–6): 366–373. Дои:10.1524 / zkri.1973.138.jg.366.
- ^ Whitmore, F.C .; Хэнсон, Э. Р. (1925). «о-хлормеркурифенол». Органический синтез. 4: 13. Дои:10.15227 / orgsyn.004.0013.
- ^ «ДЛ-СЕРИН». Органический синтез. 20: 81. 1940. Дои:10.15227 / orgsyn.020.0081.
Ацетилгалогениды и соли ацетат ион | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | Он | ||||||||||||||||||
| LiOAc | Быть (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | AcOOH | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 АЛСОЛ Al (OAc)2ОЙ Al2ТАК4(OAc)4 | Si | п | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Как (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Nb | Пн (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | CD (OAc)2 | В | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Та | W | Re | Операционные системы | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Би (OAc)3 | По | В | Rn | |||
| Пт | Ра | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |||
| ↓ | |||||||||||||||||||
| Ла (OAc)3 | Ce (OAc)Икс | Pr | Nd | Вечера | Sm (OAc)3 | Eu (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Хо (OAc)3 | Э | Тм | Yb (OAc)3 | Лу (OAc)3 | |||||
| Ac | Чт | Па | UO2(OAc)2 | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||||

