Исследование гриппа - Википедия - Influenza research
Эта статья должна быть обновлено. (Ноябрь 2009 г.) |
| Грипп (грипп) |
|---|
 |
Исследование гриппа включает расследование молекулярная вирусология, патогенез, хозяин иммунные ответы, геномика, и эпидемиология касательно грипп. Основная цель исследования - разработать меры противодействия гриппу, такие как: вакцина, методы лечения и диагностические инструменты.
Как минимум 12 компаний и 17 правительств разрабатывают[когда? ] предпандемия вакцины против гриппа в 28 различных клинических испытаниях, которые в случае успеха могут превратить смертельную пандемическую инфекцию в несмертельную пандемическую инфекцию. Вакцина, которая могла бы предотвратить любое заболевание, вызванное еще не существующим штаммом пандемического гриппа, займет не менее трех месяцев с момента появления вируса до начала полномасштабного производства вакцины; ожидается, что производство вакцины увеличится до одного миллиарда доз через год после первой идентификации вируса.[1]
Улучшенные меры противодействия гриппу требуют фундаментальных исследований того, как вирусы проникают в клетки, реплицируются, мутируют, превращаются в новые штаммы и вызывают иммунный ответ. Исследуются способы устранения ограничений в существующих методах вакцинации.[когда? ]
В Проект секвенирования генома гриппа была инициирована в 2004 году с целью создания библиотеки последовательностей гриппа, чтобы понять, что делает один штамм более смертоносным, чем другой, и на какие генетические детерминанты влияют больше всего. иммуногенность, и как вирус развивается с течением времени.
Области текущих исследований гриппа
Птичий грипп
До 2004 года все предыдущие штаммы вируса высокопатогенного птичьего гриппа (ВПГП) циркулировали только среди домашних птиц, и в результате уничтожения всех их в этом районе штаммы были вымерли.[нужна цитата ] Предыдущие штаммы HPAI существовали только у домашних птиц. LPAI дикой птицы мутирует в домашней стае в штамм HPAI, все домашние птицы в этом районе будут убиты, а штамм HPAI больше не будет иметь хозяев и, следовательно, больше не будет существовать. Этот текущий[когда? ] Штамм HPAI H5N1 оказался другим. В октябре 2004 года исследователи обнаружили, что H5N1 намного опаснее, чем считалось ранее, потому что водоплавающие птицы, особенно утки, непосредственно распространяли высокопатогенный штамм H5N1. С этого момента эксперты по птичьему гриппу все чаще стали называть сдерживание стратегии, которая может отсрочить, но не предотвратить появление птиц в будущем. пандемия гриппа. Тем не менее, все еще есть надежда, что со временем он превратится в какой-нибудь низкопатогенный штамм и больше не будет существовать в своем нынешнем высокопатогенном наборе штаммов. Но время шло, надежда становилась все менее и менее вероятной.[когда? ] В результате ежегодно потребуются миллиарды долларов на расходы, которые не потребовались бы, если бы они прекратились. Особенно сильно пострадало птицеводство. Как наилучшим образом расходовать средства на борьбу с пандемией и средства на защиту птицеводства - это вопрос, на который требуются миллиарды долларов на исследования гриппа и новые предприятия по производству вакцин против гриппа.[нужна цитата ]
Поскольку птичий грипп не проходит, как предполагалось,[когда? ] требуется больше данных, чтобы понять, как лучше справиться. Правительства финансируют различные исследования: от клеточных культур вирусов гриппа до эффективности вакцинации против H5N1, адъювантов и миграций диких птиц, распределения подтипов птичьего гриппа и вакцинации от птичьего гриппа и т. Д. H5N1 сдерживать, ограничивая скорость и степень мутации, и выиграть время для ввода в эксплуатацию новых методов производства вакцины против гриппа и фабрик, чтобы в следующий раз пандемия гриппа Случается, что число погибших можно свести к минимуму.[нужна цитата ]
Универсальные вакцины против гриппа
Видеть Перспективы универсальных вакцин против гриппа
Текущие контракты на крупные исследования гриппа
В Правительство США 4 мая 2006 г. заключил пятилетние контракты на «более 1 миллиарда долларов с пятью производителями лекарств, разрабатывающими технологию для ускоренного массового производства вакцин в случае пандемии» из принятого в 2005 году закона о готовности к пандемии на сумму 3,8 миллиарда долларов ». заявляет, что его цель - предоставить вакцину каждому американцу в течение шести месяцев после пандемии. В настоящее время вакцины от гриппа производятся в специализированных курица яйца, но этот метод не позволяет быстро проводить массовые вакцинации ". Контракты получили следующие компании:
- GlaxoSmithKline 274,8 млн. Долл. США
- MedImmune Inc 169,5 млн. Долл. США
- Новартис Вакцины и средства диагностики 220,5 млн. Долл. США
- ООО «Вакцинная компания ДинПорт» 41 миллион долларов
- Solvay Pharmaceuticals 298,6 млн. Долл. США[2]
В Правительство США куплено у Санофи Пастер и Корпорация Chiron несколько миллионов доз вакцина предназначен для использования в случае пандемия гриппа из-за H5N1 и проводит на них клинические испытания[когда? ].[3] 1 апреля 2006 г. ABC News сообщило, что «Начиная с конца 1997 г. в ходе испытаний на людях было протестировано 30 различных вакцин, все из которых были привязаны к вирусу H5N1».[4]
"Для решения H9N2 угроза, НИАИД заключил договор с Корпорация Chiron для производства экспериментальных серий инактивированной вакцины, которые будут оцениваться клинически НИАИД в начале следующего года[когда? ]. За H5N1, Авентис-Пастер и Chiron производят экспериментальные партии препаратов инактивированной вакцины против H5N1.[когда? ]; Кроме того, DHHS заключил договор с Авентис[когда? ] произвести до 2 миллионов доз, которые будут складированы для использования в чрезвычайных ситуациях, в случае необходимости, для вакцинации медицинских работников, исследователей и, при необходимости, населения в пострадавших районах. В настоящее время также ведется разработка и оценка комбинированного противовирусного режима против этих потенциальных штаммов пандемического гриппа ".[5]
Вакцина
А вакцина вероятно, будет недоступен на начальных стадиях заражения населения.[6] После выявления потенциального вируса обычно требуется не менее нескольких месяцев, прежде чем вакцина станет широко доступной, поскольку ее необходимо разработать, протестировать и разрешить. Возможности производства вакцин широко варьируются от страны к стране; Фактически, только 15 стран указаны как «производители вакцины против гриппа» согласно Всемирная организация здоровья.[7] Подсчитано, что при наилучшем сценарии каждый год может производиться 750 миллионов доз, в то время как вполне вероятно, что каждому человеку потребуется две дозы вакцины, чтобы стать иммуно-компетентным. Распространение в странах и внутри стран, вероятно, будет проблематичным.[8] Однако у некоторых стран есть хорошо разработанные планы по производству больших количеств вакцины. Например, Канадский органы здравоохранения заявляют, что они развивают потенциал для производства 32 миллионов доз в течение четырех месяцев - вакцины, достаточной для вакцинации каждого человека в стране.[9]
Есть две серьезные технические проблемы, связанные с разработкой вакцины против H5N1. Первая проблема заключается в следующем: вакцины против сезонного гриппа требуют однократной инъекции 15 мкг гемагглютинина для обеспечения защиты; H5, по-видимому, вызывает только слабый иммунный ответ, и крупное многоцентровое исследование показало, что две инъекции 90 мкг H5 с интервалом 28 дней обеспечивали защиту только у 54% людей (Treanor 2006 ). Даже если считать, что 54% является приемлемым уровнем защиты, в настоящее время мир способен производить только 900 миллионов доз при концентрации 15 мкг (при условии, что все производство было немедленно переведено на производство вакцины H5); если необходимы две инъекции по 90 мкг, то эта емкость падает до 70 миллионов (Польша 2006 ). Испытания с использованием адъюванты Такие как квасцы или же MF59 срочно нужно попробовать снизить дозу вакцины[когда? ]. Вторая проблема заключается в следующем: циркулируют два клады вируса[когда? ]клад 1 - это вирус, первоначально выделенный во Вьетнаме, клад 2 - вирус, выделенный в Индонезии. Текущий[когда? ] Исследования вакцины сосредоточены на вирусах клады 1, но вирус клады 2 отличается по антигенам, и вакцина клады 1, вероятно, не защитит от пандемии, вызванной вирусом клады 2.
Одна тактика, которая может быть использована для ускорения валидации вакцины, состоит в контролируемом контроле выявления иммунных ответов на провокацию вакцины. Об одном подходе к применению этой тактики было сообщено в 2013 году, когда гемагглютинин белковая микроматрица был использован для изучения ответа на вакцину против гриппа.[10]
Живая аттенуированная вакцина против гриппа
В июне 2007 г. Национальные институты здоровья (NIH) начал набор участников Исследование фазы 1 H5N1 интраназального вакцина против гриппа кандидат на основе Флюмист, MedImmune с технология живых аттенуированных вакцин.[11][12]
Обратная генетика
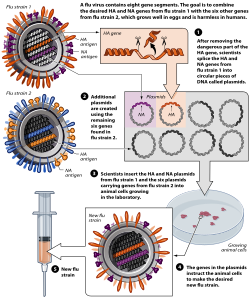
Техника называется обратная генетика позволяет ученым управлять геномы вирусов гриппа и передать гены между вирусные штаммы. Метод позволяет быстро генерировать семенные вирусы для вакцин-кандидатов, которые точно соответствуют ожидаемым эпидемический штамм. Удаляя или модифицируя определенные гены вирулентности, обратная генетика также может быть использована для преобразования высокопатогенных вирусов гриппа в вакцины-кандидаты, которые более безопасны для производителей вакцин.
Культура клеток
Другой прием - использование клеточные культуры выращивать вакцинные штаммы; такие как генная инженерия бакуловирус для экспрессии гена, который кодирует белок оболочки гриппа, такой как гемагглютинин или же нейраминидаза. "Недавнее клиническое испытание фазы II при поддержке NIAID вакцины, произведенной Белковые науки Корпорация с помощью этой стратегии показала, что она хорошо переносится и иммуногенна; компания[когда? ] проведение дальнейшей клинической оценки этого продукта. Другие новые способы производства противогриппозных вакцин включают подходы на основе ДНК и разработку широко защищающих вакцин на основе белков вируса гриппа, которые являются общими для нескольких штаммов ».[5]
AVI Bio Pharma Inc. имеет доказательства подавления множественных подтипов вирус гриппа А в культура клеток с Морфолино олигомеры по результатам своих лабораторий и четырех независимых исследовательских лабораторий[когда? ]. «Ключевой вывод здесь заключается в том, что наши терапевтические препараты NEUGENE® продолжают демонстрировать эффективность против всех штаммов гриппа A, включая H5N1."[13][14] Морфолино, конъюгированный с пептиды, проникающие в клетки показали свою эффективность в защите мышей от гриппа А.[15][16]
"Некоторые компании уделяют особое внимание новым автомобилям для роста. антигены, которые представляют собой частицы вируса или бактерии, необходимые для стимуляции иммунная система для борьбы с инфекцией. VaxInnate, базирующаяся в Нью-Джерси биотехнология компания, сообщила об успешном использовании Кишечная палочка бактерии, которые могут вызывать иногда смертельную инфекцию, но также могут использоваться для роста вакцина ингредиенты при удалении вредной части бактерии. Dowpharma, единица Dow Chemical, использовал различные бактерии, обнаруженные в почве и воде, P. fluorescens, которая может производить больший объем антигенов быстрее, чем E. coli ».[17] Кроме того, вакцина под названием FluBlOk, которая производится на основе клеток насекомых, получила одобрение FDA в январе 2013 года. Эта вакцина, которая ориентирована на гемагглютинин, сократит производственный процесс на один-два месяца, а также позволит избежать других ловушек куриных яиц.[18]
"The Комитет по лекарственным средствам для человека (CHMP), который рассматривает заявки из 27 стран ЕС, обнаружил[когда? ] что Новартис Optaflu вакцина, введенная более 3400 человек во время клинических исследований, соответствовала критериям иммуногенности CHMP [...] Novartis заявила, что Optaflu представляет собой субъединичную вакцину, что означает, что она содержит отдельные вирусные белки, а не целые вирусные частицы. [...] Novartis заявила, что планирует подать заявку на лицензирование в США своей клеточной вакцины против гриппа в 2008 году. Компания провела клинические испытания вакцины в фазах 1 и 2 в Соединенных Штатах и в июле 2006 года объявила, что построит 600 миллионов долларов посадить в Холли Спрингс, Северная Каролина, чтобы сделать вакцины против гриппа на клеточных культурах. В мае 2006 г. Министерство здравоохранения и социальных служб США заключил с Novartis контракт на 220 миллионов долларов на разработку клеточных вакцин против гриппа, и Новартис сказал, что деньги пойдут на стоимость нового объекта. В зависимости от того, когда вакцина одобрена Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), завод может начать производство уже в 2011 году и быть готовым к полному производству уже в 2012 году, с годовой производительностью 50 миллионов доз трехвалентной вакцины, заявила компания. По словам Novartis, в случае пандемии гриппа объект рассчитан на прием до 150 миллионов моновалентных доз (однократного штамма) ежегодно в течение 6 месяцев с момента объявления пандемии. Прочее Novartis клеточная вакцина производственный объект находится в Марбург, Германия."[19]
Планирование вакцинации против пандемического гриппа
Согласно Министерство здравоохранения и социальных служб США (HHS) План по пандемическому гриппу Приложение F: Текущие мероприятия HHS последний раз пересматривались 8 ноября 2005 г .:[20]
- В настоящее время вакцина против гриппа для ежегодной программы сезонного гриппа поставляется четырьмя производителями. Однако только один производитель выпускает годовой вакцина полностью в США. Таким образом, если произойдет пандемия и существующие мощности по производству противогриппозной вакцины в США будут полностью переключены на производство пандемической вакцины, поставки будут сильно ограничены. Более того, поскольку ежегодный процесс производства противогриппозной вакцины происходит в течение большей части года, время и возможности для производства вакцины против потенциальных пандемических вирусов для хранения запасов при продолжении ежегодного производства противогриппозной вакцины ограничены. Поскольку поставки будут ограничены, для HHS крайне важно иметь возможность направлять распределение вакцины в соответствии с заранее определенными группами (см. Приложение D. ); HHS обеспечит наращивание потенциала и привлечет государства к обсуждению закупок и распространения вакцины против пандемического гриппа.
- Производственные мощности вакцины: защитный иммунный ответ, вызываемый нынешними вакцинами против гриппа, в значительной степени основан на вирусной гемагглютинин (HA) и нейраминидаза (NA) антигены в вакцине. Как следствие, основой производства противогриппозной вакцины является выращивание огромных количеств вируса, чтобы иметь достаточное количество этих белковых антигенов для стимуляции иммунных ответов. Вакцины против гриппа, используемые в Соединенных Штатах и во всем мире, производятся путем выращивания вируса на оплодотворенных курах. яйца, коммерческий процесс, который существует уже несколько десятилетий. Для достижения текущих целей по производству вакцины миллионы 11-дневных оплодотворенных яиц должны быть доступны каждый день производства.
- В ближайшем будущем дальнейшее расширение этих систем обеспечит дополнительные возможности для производства в США как сезонных, так и пандемических вакцин, однако резкое увеличение мощности, которое потребуется для борьбы с пандемией, не может быть обеспечено только за счет производства вакцин на основе яиц. , поскольку нецелесообразно разрабатывать систему, которая зависит от сотен миллионов специализированных яиц 11-дневного возраста в режиме ожидания. Кроме того, поскольку пандемия может возникнуть в результате птичий грипп напряжение, которое смертельно опасно для куры, невозможно гарантировать, что яйца будут доступны для производства вакцины при необходимости.
- В отличие, культура клеток производство технологии могут применяться к вакцинам против гриппа, как и к большинству вирусных вакцин (например, полиомиелит вакцина корь -свинка -краснуха вакцина ветряная оспа вакцина). В этой системе вирусы выращиваются в закрытых системах, таких как биореакторы содержащие большое количество клеток в питательной среде, а не в яйцах. Пиковая мощность, обеспечиваемая клеточной технологией, нечувствительна к сезонам и может быть скорректирована в зависимости от потребности в вакцинах, поскольку производительность может быть увеличена или уменьшена за счет количества биореакторов или объема, используемого в биореакторе. Помимо поддержки фундаментальных исследований по разработке вакцины против гриппа на основе клеток, HHS в настоящее время поддерживает ряд производителей вакцин в продвинутой разработке вакцин против гриппа на основе клеток с целью разработки лицензированных в США вакцин против гриппа на основе клеток, производимых в Соединенных Штатах. Состояния.
- Дозозберегающие технологии. Вакцины, лицензированные в настоящее время в США, стимулируют невосприимчивый ответ в зависимости от количества HA (гемагглютинин ) антиген входит в дозу. В настоящее время изучаются методы стимуляции сильного иммунного ответа с использованием меньшего количества антигена НА. H5N1 и H9N2 испытания вакцины. К ним относятся изменение способа доставки с внутримышечного на внутрикожный и добавление иммуностимулирующего адъюванта к вакцинной композиции. Кроме того, HHS запрашивает предложения по контрактам от производители вакцин, адъюванты, и медицинское оборудование для разработки и лицензирования противогриппозных вакцин, которые обеспечат альтернативные стратегии экономии дозы.
Исследование вакцины против H5N1
 |

Есть несколько H5N1 вакцина для нескольких разновидностей птичьего H5N1. H5N1 постоянно мутирует, делая их, пока что для человека, малопригодными. Хотя может существовать некоторая перекрестная защита от родственных штаммов гриппа, наилучшей защитой будет вакцина, специально созданная для любого будущего штамма вируса пандемического гриппа. Дэниел Р. Люси, содиректор программы аспирантуры по биологическим опасностям и возникающим заболеваниям Джорджтаунского университета.[когда? ], "Здесь нет H5N1 пандемия так что пандемии быть не может вакцина. Тем не менее, «предпандемические вакцины» были созданы; они дорабатываются и тестируются; они действительно имеют определенные перспективы как для продолжения исследований, так и для обеспечения готовности к следующей пандемии. Компаниям, производящим вакцины, рекомендуется наращивать мощности, чтобы в случае пандемии вакцина необходима, будет доступно оборудование для быстрого производства больших количеств вакцины, специфичной для нового пандемического штамма.[нужна цитата ]
Проблемы с H5N1 Производство вакцины включает:
- отсутствие общих производственных мощностей
- отсутствие дополнительных производственных мощностей (нецелесообразно разрабатывать систему, которая зависит от сотен миллионов 11-дневных специализированных яиц в режиме ожидания)
- пандемия H5N1 может быть смертельной для кур
Культура клеток (клеточная) технология производства может быть применена к вакцинам против гриппа, как и к большинству вирусных вакцин, и тем самым решить проблемы, связанные с созданием вакцин против гриппа с использованием куриных яиц, как это делается в настоящее время.[когда? ] сделано. Исследователи из Питтсбургского университета добились успеха с генно-инженерной вакциной, на создание которой потребовался всего месяц, и полностью защитили цыплят от высокопатогенных микроорганизмов. H5N1 вирус.[21]
Согласно Министерство здравоохранения и социальных служб США:
- Помимо поддержки фундаментальных исследований по разработке вакцины против гриппа на основе клеток, HHS в настоящее время поддерживает ряд вакцина производители передовых разработок клеточных вакцин против гриппа с целью разработки лицензированных в США клеточных вакцин против гриппа, производимых в Соединенных Штатах. Дозозберегающие технологии. Вакцины, лицензированные в настоящее время в США, стимулируют иммунный ответ в зависимости от количества HA (гемагглютинин ) антиген входит в дозу. В настоящее время изучаются методы стимуляции сильного иммунного ответа с использованием меньшего количества антигена НА. H5N1 и испытания вакцины против H9N2. К ним относятся изменение способа доставки с внутримышечного на внутрикожный и добавление иммуностимулирующих препаратов. адъювант к рецептуре вакцины. Кроме того, HHS запрашивает предложения по контрактам от производителей вакцина, адъюванты и медицинские устройства для разработки и лицензирования противогриппозных вакцин, которые обеспечат альтернативные стратегии экономии дозы.[22]
Корпорация Chiron сейчас[когда? ] повторная сертификация и по контракту с Национальные институты здоровья произвести 8000-10 000 исследовательских доз Вакцина от птичьего гриппа (H5N1). Авентис Пастер находится по аналогичному контракту.[1] В Соединенные Штаты правительство надеется получить достаточно вакцина в 2006 г. пролечено 4 млн человек. Однако неясно, будет ли эта вакцина эффективна против гипотетического мутировавшего штамма, который может легко передаваться через человеческие популяции, и срок хранения накопленных доз еще не определен.[23]
В Медицинский журнал Новой Англии 30 марта 2006 г. сообщил об одном из десятков проводимых в настоящее время исследований вакцины. Treanor et al. исследование проводилось на вакцине, полученной из человеческого изолята (A / Vietnam / 1203/2004 H5N1 ) вирулентного вируса гриппа A (H5N1) клады 1 с использованием системы спасения плазмиды, при этом только гены гемагглютинина и нейраминидазы экспрессируются и вводятся без адъюванта. Остальные гены были получены из авирулентного штамма вируса гриппа A / PR / 8/34, адаптированного к яйцам. Ген гемагглютинина был дополнительно модифицирован для замены шести основных аминокислот, связанных с высокой патогенностью у птиц в участке расщепления между гемагглютинином 1 и гемагглютинин 2. Иммуногенность оценивали по микронейтрализация и анализы ингибирования гемагглютинации с использованием вакцинного вируса, хотя подгруппа образцов была протестирована с использованием вируса гриппа дикого типа A / Vietnam / 1203/2004 (H5N1) ». Результаты этого исследования в сочетании с другими планируется завершить к весне 2007 г.[когда? ] есть надежда, что будет получена высокоиммуногенная вакцина, обладающая перекрестной защитой от гетерологичных штаммов гриппа.[24]
Утверждение и накопление запасов вакцины против H5N1
17 апреля 2007 г. было получено первое одобрение в США для лечения H5N1. вакцина против гриппа для людей было дано. Эта вакцина сделана Санофи-Авентис на заводе в Swiftwater, Пенсильвания не подлежит коммерческой продаже; вместо этого США накапливают их в качестве временной меры, пока исследуются более совершенные вакцины. Две инъекции с интервалом в 28 дней показали, что они обеспечивают защиту 45% людей, получивших вакцину в ходе исследования. «Министерство здравоохранения и социальных служб США заявило, что уже закупило 13 миллионов доз вакцины Санофи, чего достаточно для вакцинации 6,5 миллионов человек. Вакцина была одобрена для людей в возрасте от 18 до 64 лет. Исследования в других возрастных группах продолжаются.[когда? ]. По данным FDA, наиболее частыми побочными эффектами были боль в месте инъекции, головная боль, общее недомогание и мышечная боль ».[25]
Это одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов от 17 апреля 2007 г. означает, что вакцина больше не считается экспериментальной и, следовательно, может применяться во время пандемии, не требуя от каждого реципиента подписывать форму, дающую информированное согласие. [...] Две инъекции вместе взятые. содержат 180 микрограммов антигена, фрагмента вируса H5N1, предназначенного для стимулирования иммунитета. Напротив, обычная прививка от гриппа содержит 45 микрограммов антигена: 15 микрограммов для каждого из трех штаммов, от которых он защищает ».[26]
Вакцина, одобренная 17 апреля 2007 г., «основана на вирусе H5N1, изолированном от пациента из Вьетнама в 2004 году. Сегодняшнее одобрение FDA следует за рекомендацией консультативной группы FDA от 27 февраля, которая установила, что вакцина безопасна и эффективна. Однако , у некоторых членов комиссии были оговорки в отношении иммуногенности вакцины, которая, по данным, представленным комиссии, была несколько ниже, чем ранее сообщалось в статье 2006 года в New England Journal of Medicine. В клиническом испытании два 90 мкг ( FDA отметило, что дозы вакцины, введенные 103 здоровым взрослым с интервалом 28 дней, вызвали защитный иммунный ответ у 45% реципиентов (исследователи использовали титр нейтрализующих антител 1:40, то есть четырехкратное или более увеличение титр антител, чтобы определить адекватный иммунный ответ.) [...] Национальный запас в настоящее время содержит 13 миллионов доз вакцины H5N1, чего достаточно для вакцинации 6,5 миллионов человек [...] HHS заявил, что продвигается вперед с разработкой внедрение вакцины H5N1 "клады 2" на основе вирусов, которые циркулировали среди птиц в Китае и Индонезии в 2003-04 гг. и распространились на Ближний Восток, Европу и Африку в 2005 и 2006 гг. "[27]
Противовирусные препараты
Многие страны, а также Всемирная организация здравоохранения работают над созданием запасов противовирусные препараты в рамках подготовки к возможной пандемии. Осельтамивир (торговое название Тамифлю) является наиболее популярным лекарством, поскольку он доступен в форме таблеток. Занамивир (торговое название Relenza) также рассматривается для использования, но его необходимо вдыхать. Другие противовирусные препараты менее эффективны против пандемического гриппа.
И Тамифлю, и Реленза в дефиците.[когда? ], а производственные возможности ограничены в среднесрочной перспективе[когда? ]. Некоторые врачи утверждают, что при одновременном применении Тамифлю с пробенецид мог удвоить поставки.[28]
У вирусов также есть потенциал развития лекарственной устойчивости. У некоторых инфицированных H5N1 людей, получавших осельтамивир, развились устойчивые штаммы этого вируса.[нужна цитата ]
Перамивир фармацевтический препарат, применяемый для лечения вирусных инфекций. Нравиться занамивир и осельтамивир, перамивир - это ингибитор нейраминидазы, действуя как переходное состояние аналог ингибитора гриппа нейраминидаза тем самым предотвращая появление новых вирусов из инфицированных клеток. Экспериментальные данные показывают, что перамивир может обладать полезной активностью против многих представляющих интерес вирусов, включая H5N1 (птичий грипп), гепатит Б, полиомиелит, корь и оспа. Секретарь HHS Майк Ливитт объявил 4 января 2007 г., что Департамент заключил четырехлетний контракт на 102,6 млн долларов с BioCryst Pharmaceuticals для усовершенствования своего противовирусного препарата против гриппа, перамивира.[29]
Было обнаружено, что несколько типов грибов обладают противовирусными свойствами in vitro против вируса гриппа, включая вирус гриппа типа А.[30]
Исследование испанского гриппа
Одна из гипотез состоит в том, что штамм вируса возник в Форт Райли, Канзас, двумя генетический механизмы - генетический дрейф и антигенный сдвиг - в вирусах домашней птицы и свиней, разводимых в форте для местного потребления. Но данные недавней реконструкции вируса предполагают, что он прыгнул прямо из от птиц к людям, не путешествуя через свиней.[31] 5 октября 2005 года исследователи объявили, что генетическая последовательность штамма гриппа 1918 года, подтипа птичьего штамма H1N1, была реконструирована с использованием исторических образцов тканей.[32][33][34] 18 января 2007 г. Кобаса и другие. сообщили, что зараженные обезьяны (Macaca fascicularis ) проявил классические симптомы пандемии 1918 г. и умер от цитокиновый шторм.[35]
Распределенных вычислений
Можно использовать компьютерное время для распределенных исследовательских проектов, проводящих исследования гриппа.
Складной @ Home, а распределенных вычислений программа от Стэндфордский Университет, исследует, как вирусы проходят через клеточную мембрану (в то время как большинство методов лечения сосредоточены на предотвращении вирусная репликация ) и какую роль играют белки. В настоящее время они сосредоточивают свои исследования на гриппе.
Rosetta @ Home работает над ингибитором испанского гриппа, чтобы заблокировать инфекцию гриппа.
Смотрите также
- Глобальный альянс по вакцинам и иммунизации
- IFPMA Международная федерация ассоциаций фармацевтических производителей
- Сообщение о случаях заболевания
- Первородный антигенный грех
- Центр оценки и исследований биологических препаратов
- ICEID
- Проект секвенирования генома гриппа
- Цитокиновый шторм
- Международное партнерство по птичьему и пандемическому гриппу
- Национальные центры по гриппу
- Закон о готовности к пандемии и ответных мерах
Рекомендации
- ^ Пандемия гриппа: борьба с еще не существующим врагом В архиве 12 октября 2007 г. Wayback Machine Кэтрин Брахич, Сеть науки и развития, 4 мая 2006 г.
- ^ Yahoo News Статья AP Получено финансирование вакцины против птичьего гриппа опубликовано 4 мая 2006 г.
- ^ Статья в New York Times "" Сомнения в отношении запасов вакцины от птичьего гриппа " В архиве 15 января 2016 г. Wayback Machine
- ^ ABC News В архиве 12 августа 2016 г. Wayback Machine
- ^ а б Ответ биомедицинских исследований NIH на грипп В архиве 4 ноября 2016 г. Wayback Machine
- ^ CDC В архиве 14 октября 2015 г. Wayback Machine
- ^ ВОЗ В архиве 22 августа 2006 г. Wayback Machine
- ^ phacilitate.co.uk В архиве 17 июля 2006 г. Wayback Machine
- ^ Новости Канадского телевидения В архиве 27 марта 2007 г. Wayback Machine
- ^ Desbian, Anthony L .; Ван Хувен, Нил; Рид, Стивен Дж .; Кейси, Аллен С.; Laurance, John D .; Болдуин, Сьюзен Л .; Duthie, Malcolm S .; Рид, Стивен Дж .; Картер, Дэррик (2013). «Разработка микроматрицы белка гемагглютинина высокой плотности для определения диапазона антител к гриппу» (папа). Биотехнологии. 54 (6): 345–348. Дои:10.2144/000114041. PMID 23750544.
- ^ MedImmune пресс-релиз MedImmune и Национальные институты здравоохранения начинают клинические испытания живой ослабленной интраназальной вакцины против вируса птичьего гриппа H5N1 опубликовано 15 июня 2006 г.
- ^ MedImmune и Национальные институты здравоохранения начинают клинические испытания живой ослабленной интраназальной вакцины против вируса птичьего гриппа H5N1 Дата статьи: 16 июня 2006 г. «MedImmune и Национальные институты здравоохранения начинают клинические испытания живой ослабленной интраназальной вакцины против вируса птичьего гриппа H5N1». В архиве из оригинала 2011-05-16. Получено 2007-11-05.
- ^ «AVI BioPharma сообщает об успешном подавлении множества подтипов гриппа A с помощью антисмыслового терапевтического средства NEUGENE» (Пресс-релиз). Портленд, штат Орегон: Sarepta Therapeutics. 30 марта 2006 г.. Получено 5 сентября 2020.
- ^ Ge, Q; Пастей, М; Кобаса, Д; Путхаватана, П; Lupfer, C; Бествик, РК; Иверсен, Польша; Чен, Дж; Штейн, Д.А. (2006). «Ингибирование множественных подтипов вируса гриппа А в клеточных культурах с морфолиноолигомерами». Антимикробный. Агенты Chemother. 50 (11): 3724–33. Дои:10.1128 / AAC.00644-06. ЧВК 1635187. PMID 16966399.
- ^ Габриэль, G; Nordmann A; Штейн Д.А.; Iversen PL; Кленк HD (2008). «Морфолиноолигомеры, нацеленные на гены PB1 и NP, увеличивают выживаемость мышей, инфицированных высокопатогенным вирусом гриппа A H7N7». Дж. Ген Вирол. 89 (Pt 4): 939–48. Дои:10.1099 / vir.0.83449-0. PMID 18343835.
- ^ Lupfer, C; Штейн Д.А.; Mourich DV; Теппер ЮВ; Iversen PL; Пастей М (2008). «Ингибирование инфекций вируса гриппа A H3N8 у мышей морфолиноолигомерами». Arch. Вирол. 153 (5): 929–37. Дои:10.1007 / s00705-008-0067-0. PMID 18369525.
- ^ ABC News В архиве 2 мая 2009 г. Wayback Machine статья Ученые планируют ускорить производство вакцин опубликовано 12 апреля 2006 г.
- ^ Вакцина от гриппа, выращенная в клетках насекомых, в обход яиц перспективна В архиве 15 января 2016 г. Wayback Machine
- ^ CIDRAP В архиве 6 мая 2013 г. Wayback Machine статья Группа поддерживает одобрение ЕС клеточной вакцины против гриппа опубликовано 27 апреля 2007 г.
- ^ «План HHS по пандемическому гриппу. Приложение F: Текущая деятельность HHS». Министерство здравоохранения и социальных служб США. 8 ноября 2005 г. Архивировано с оригинал 14 февраля 2007 г.
- ^ Гао В., Солофф А.С., Лу Х и др. (Февраль 2006 г.). «Защита мышей и домашних птиц от летального вируса птичьего гриппа H5N1 с помощью иммунизации на основе аденовируса». Дж. Вирол. 80 (4): 1959–64. Дои:10.1128 / JVI.80.4.1959-1964.2006. ЧВК 1367171. PMID 16439551. Получено 5 сентября 2020.
- ^ Департамент здравоохранения и социальных служб В архиве 14 февраля 2007 г. Wayback Machine
- ^ энергетический ядерный реактор В архиве 3 марта 2016 г. Wayback Machine
- ^ Польша GA (март 2006 г.). «Вакцины против птичьего гриппа - гонка со временем». N. Engl. J. Med. 354 (13): 1411–3. Дои:10.1056 / NEJMe068047. PMID 16571885.
- ^ «США одобрили первую вакцину от птичьего гриппа для людей». Новый ученый. 17 апреля 2007 г.. Получено 5 сентября 2020.
- ^ Нью-Йорк Таймс В архиве 20 мая 2013 г. Wayback Machine статья Первая вакцина против птичьего гриппа одобрена в качестве временной меры опубликовано 18 апреля 2007 г.
- ^ CIDRAP В архиве 3 мая 2013 г. Wayback Machine статья FDA одобрило первую вакцину против H5N1 опубликовано 17 апреля 2007 г.
- ^ Батлер Д. (ноябрь 2005 г.). «Тактика военного времени удваивает силу дефицитного лекарства от птичьего гриппа». Природа. 438 (7064): 6. Bibcode:2005Натура 438 .... 6Б. Дои:10.1038 / 438006a. PMID 16267514.
- ^ «HHS продолжает разработку нового противовирусного препарата против гриппа» (Пресс-релиз). Министерство здравоохранения и социальных служб США. Архивировано из оригинал на 2007-01-07. Получено 2007-01-06.
- ^ Lindequist U, Niedermeyer TH, Jülich WD (сентябрь 2005 г.). «Фармакологический потенциал грибов». Альтернативная медицина на основе доказательств. 2 (3): 285–99. Дои:10.1093 / ecam / neh107. ЧВК 1193547. PMID 16136207. Архивировано из оригинал 27 апреля 2009 г.
- ^ Иногда вирус содержит как гены, адаптированные к птицам, так и гены, адаптированные к человеку. Оба H2N2 и H3N2 пандемические штаммы содержали вирус птичьего гриппа РНК сегменты. «Хотя пандемические вирусы гриппа человека 1957 г. (H2N2) и 1968 г. (H3N2) явно возникли в результате перераспределения вирусов человека и птиц, вирус гриппа вызывает«Испанский грипп 'в 1918 году, по всей видимости, полностью заимствован из птичьего источника (Belshe 2005) »(из Глава вторая: Птичий грипп, Тимм К. Хардер и Ортруд Вернер В архиве 10 мая 2016 г. Wayback Machine, отличная бесплатная онлайн-книга под названием Отчет о гриппе 2006 г. который представляет собой медицинский учебник, в котором дается всесторонний обзор эпидемий и пандемий гриппа.)
- ^ «Вирус гриппа 1918 года воскрешен». Природа. 437 (7060): 794–5. Октябрь 2005 г. Bibcode:2005Натура.437..794.. Дои:10.1038 / 437794a. PMID 16208326.
- ^ Таубенбергер Дж. К., Рид А. Х., Луренс Р. М., Ван Р., Джин Дж., Фаннинг Т. Г. (2005). «Характеристика генов полимеразы вируса гриппа 1918 года». Природа. 437 (7060): 889–893. Bibcode:2005Натура 437..889Т. Дои:10.1038 / природа04230. PMID 16208372.
- ^ Tumpey, Terrence M .; Питер Палезе; Агилар, Патрисия В .; Цзэн, Хуэй; Солорзано, Алисия; Суэйн, Дэвид Э .; Кокс, Нэнси Дж .; Кац, Жаклин М .; Таубенбергер, Джеффри К .; Палезе, Питер; Гарсия-Састре, Адольфо (2005). «Характеристика реконструированного пандемического вируса испанского гриппа 1918 года». Наука. 310 (5745): 77–80. Bibcode:2005Наука ... 310 ... 77Т. CiteSeerX 10.1.1.418.9059. Дои:10.1126 / science.1119392. PMID 16210530.
- ^ Кобаса Д. и др. (Январь 2007 г.). «Аберрантный врожденный иммунный ответ при летальном заражении макак вирусом гриппа 1918 года». Природа. 445 (7125): 319–23. Bibcode:2007Натура.445..319K. Дои:10.1038 / природа05495. PMID 17230189.
внешняя ссылка
- База данных исследований гриппа - База данных геномных последовательностей гриппа и сопутствующей информации.
- Портал Здоровье-ЕС Ответ ЕС на грипп
