Неорганическое соединение - Organolead compound
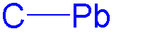
Органические соединения свинца находятся химические соединения содержащий химическая связь между углерод и вести. Химия органических соединений свинца это соответствующая наука. Первое органическое соединение свинца было гексаэтилсвинец (Pb2(C2ЧАС5)6), впервые синтезированный в 1858 году.[1] Имея одну группу с углеродом, свинец четырехвалентный.
Спускаясь по группа углерода C–Икс (Икс = C, Si, Ge, Sn, Pb) ослабевает и длина облигации больше. Связь C – Pb в тетраметилсвинце равна 222 вечера долго с энергия диссоциации из 49 ккал /моль (204 кДж / моль). Для сравнения длина связи C – Sn в тетраметилолове 214 пм при энергии диссоциации 71 ккал / моль (297 кДж / моль). Преобладание Pb (IV) в химии органических свинцов примечательно, поскольку неорганические соединения свинца, как правило, имеют центры Pb (II). Причина в том, что с неорганическими соединениями свинца, такими как азот, кислород и галогениды иметь гораздо более высокий электроотрицательность чем сам свинец, и частичный положительный заряд на свинце приводит к более сильному сокращению 6s орбитальный чем орбиталь 6p, что делает орбиталь 6s инертной; это называется эффект инертной пары.[2]
Безусловно, наиболее важным органическим свинцом является тетраэтилсвинец, ранее использовавшийся как антидетонационный агент в бензин предназначен для двигатель внутреннего сгорания. Наиболее важные свинцовые реагенты для введения свинца: тетраацетат свинца и хлорид свинца.
Использование органических соединений частично ограничено из-за их токсичности.
Синтез
Неорганические соединения могут быть получены из Реактивы Гриньяра и хлорид свинца. Например, метилмагний хлорид реагирует с хлоридом свинца до тетраметилсвинца, прозрачной жидкости с точка кипения 110 ° C и плотность 1,995 г / см³. Реакция источника свинца (II) с циклопентадиенид натрия дает инициативу металлоцен, пламбоцен.
Определенный ареновые соединения непосредственно реагируют с тетраацетатом свинца с образованием арилсвинца в электрофильное ароматическое замещение. Например анизол с тетраацетатом свинца образует п-метоксифенилтриацетат свинца в хлороформ и дихлоруксусная кислота:[3]
Другими соединениями свинца являются галогениды свинца типа RпАТС(4-н), сульфинаты органических свинцов (RпPb (OSOR)(4-п)) и гидроксиды свинца (RпСвинец (ОН)(4-п)). Типичные реакции:[4]
- р
4Pb + HCl → R3PbCl + RH - р
4Pb + ТАК2 → R3PbO (SO) R - р3PbCl + 1 / 2Ag2O (водн.) → R3PbOH + AgCl
- р2PbCl2 + 2 ОН− → р
2Свинец (ОН)
2 + 2 кл−
р
2Свинец (ОН)
2 соединения амфотерный. В pH ниже 8 они образуют R2Pb2+ ионы и с pH выше 10, R2Свинец (ОН)3− ионы.
Пламбоксаны являются производными гидроксидов:
- 2 р3PbOH + Na → (R3Pb)2О + NaOH + 1/2 Н2
дающие доступ к полимерным алкоксидам:
- (Р3Pb)2O + R'OH → 1 / n (R3Пборь ')п - п H2О
Реакции
Связь C – Pb слабая и по этой причине гомолитическое расщепление свинецорганических соединений в свободные радикалы легко. По своей антидетонационной способности его назначение - радикальный инициатор. Общие типы реакций арильных и виниловых органических соединений: трансметалляция например с бороновые кислоты и катализируемое кислотой гетероциклическое расщепление. Органолиды находят применение в реакции сочетания между ареновые соединения. Они более реактивны, чем аналогичные оловоорганические соединения и поэтому может использоваться для синтеза стерически переполненный биарилы.
В кислородная вода, к полярным алкенам добавляют алкоксиды свинца:
- ЧАС2С = СН-CN + (Et3PbOMe)п → MeO-CH2-HC (PbEt3) -CN → MeO-CH2-CH2-CN
Алкоксид регенерируется в последующем метанолиз и, следовательно, действует как катализатор.
Триацетаты ариллеада
Свинцовый заместитель в п-метоксифенилтриацетат свинца замещен углеродом нуклеофилы, такой как фенол мезитол, исключительно в ароматическая орто-позиция:[5]
Для реакции необходимо наличие большого избытка координирующего амин такие как пиридин который предположительно связывается с свинцом в ходе реакции. Реакция нечувствительна к радикальные падальщики и поэтому свободный радикал механизм можно исключить. В механизм реакции вероятно будет включать нуклеофильное смещение из ацетат группу фенольной группой к промежуточному диорганолеиду, который может быть выделен в некоторых родственных реакциях. Второй шаг сродни Перестановка Клейзена за исключением того, что реакция зависит от электрофильности (отсюда и предпочтения орто) фенола.
В нуклеофил также может быть карбанион β-дикарбонильного соединения:[3]
Карбанион образуется путем отрыва протона от кислого α-протона посредством пиридин (теперь выполняющий двойную роль), похожий на Конденсация Кневенагеля. Это промежуточное звено вытесняет ацетат лиганд к соединению диорганолида, и снова эти промежуточные соединения могут быть выделены с подходящими реагентами в качестве нестабильных промежуточных продуктов. Второй шаг восстановительное устранение с образованием новой связи C – C и свинец (II) ацетат.
Реактивные промежуточные продукты
Соединения органического свинца образуют множество реактивные промежуточные продукты например, свинец свободные радикалы:
- меня3PbCl + Na (77 К) → Me3Pb.
и плюмбилены, ведущий карбен аналоги:
- меня3Pb-Pb-Me3 → [Я2Pb]
- [Меня2Pb] + (Me3Pb)2 → Я3Pb-Pb (Me)2-PbMe3
- меня3Pb-Pb (Me)2-PbMe3 → Pb (0) + 2 Me4Pb
Эти промежуточные звенья распадаются на непропорциональность.
Плюмбилидины типа RPb (формально Pb (I)) являются лигандами других металлов в LпСоединения MPbR (сравните с углеродом металлические карбины ).
использованная литература
- ^ Металлы основной группы в органическом синтезе Ямамото, Хисаси / Осима, Коитиро (ред.) 2004 г. ISBN 3-527-30508-4
- ^ Синтез металлоорганических соединений: практическое руководство. Санширо Комия Эд. 1997 г.
- ^ а б Роберт П. Козырод и Джон Т. Пинхи (1990). "The C-арилирование β-дикарбонильных соединений ». Органический синтез.; Коллективный объем, 7, п. 229
- ^ Elschenbroich, C .; Зальцер, А. «Металлоорганические соединения: краткое введение» (2-е изд.) (1992) Wiley-VCH: Weinheim. ISBN 3-527-28165-7
- ^ Пинхи, Дж. Т. (1996). «Триацетаты органического свинца (IV) в органическом синтезе». Pure Appl. Chem. 68 (4): 819–824. Дои:10.1351 / pac199668040819.
дальнейшее чтение
- Abadin, H.G .; Поль, Х.Р. (2010). Соединения алкилсвинца и их экологическая токсикология. Ионы металлов в науках о жизни. 7, Металлоорганические соединения в окружающей среде и токсикологии. Кембридж: Издательство RSC. С. 153–164. Дои:10.1039/9781849730822-00153. ISBN 978-1-84755-177-1.



