Фенолы - Википедия - Phenols
В органическая химия, фенолыиногда называют фенольные смолы, являются классом химические соединения состоящий из одного или нескольких гидроксил группы (—ОЧАС ) связанный прямо в ароматический углеводород группа. Самый простой - это фенол, C
6ЧАС
5ОЙ. Фенольные соединения классифицируются как простые фенолы или полифенолы в зависимости от количества фенольных звеньев в молекуле.
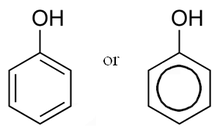
Фенолы синтезируются промышленным способом и производятся растениями и микроорганизмами.[1]
Характеристики
Кислотность
Фенолы больше кислый чем обычные спирты. Кислотность гидроксильной группы в фенолах обычно промежуточная между кислотностью алифатический спирты и карбоновые кислоты (их ПКа обычно составляет от 10 до 12). Депротонирование фенола приводит к соответствующему отрицательному фенолят-ион или же феноксид-ион, а соответствующие соли называются феноляты или же феноксиды (арилоксиды согласно Золотая книга ИЮПАК ).
Конденсация с альдегидами и кетонами
Фенолы чувствительны к Электрофильные ароматические замещения. Конденсация с формальдегид дает смолистые материалы, классно Бакелит.
Другим электрофильным ароматическим замещением в промышленных масштабах является производство бисфенол А, который производится конденсация с ацетон.[2]
C-Алкилирование алкенами
Фенол легко алкилируется в орто-положениях с использованием алкенов в присутствии кислоты Льюиса, такой как феноксид алюминия:
- CH2= CR2 + C6ЧАС5ОН → R2CHCH2-2-С6ЧАС4ОЙ
Более 100000 тонн трет-бутил фенолы производятся ежегодно (год: 2000) таким образом, используя изобутилен (CH2= CMe2) в качестве алкилирующего агента. Особенно важно 2,6-дитрет-бутилфенол, универсальный антиоксидант.[2]
Другие реакции
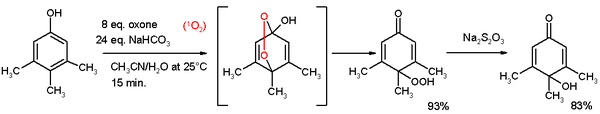
Фенолы подвергаются этерификация. Сложные эфиры фенола активные эфиры, склонные к гидролизу. Фенолы реактивный виды к окисление. Окислительное расщепление, например расщепление 1,2-дигидроксибензола до монометилового эфира 2,4-гексадиендиовой кислоты с кислородом, хлорид меди в пиридине[3] Окислительная деароматизация до хиноны также известный как Реакция Тойбера.[4] и оксон.[5] В реакции, изображенной ниже, 3,4,5-триметилфенол реагирует с синглетный кислород генерируется из оксон /карбонат натрия в ацетонитрил / вода до пара-пероксихинола. Этот гидропероксид превращается в лвинол с тиосульфат натрия.
Фенолы окисляются до гидрохиноны в Окисление персульфата Эльбса.
Реакция нафтолов и гидразинов и бисульфита натрия в Синтез карбазола Bucherer
Синтез
Многие фенолы, представляющие коммерческий интерес, получают путем разработки фенол или же крезолы. Обычно их получают алкилированием бензол /толуол с пропилен формировать кумол тогда О
2 добавлен с ЧАС
2ТАК
4 с образованием фенола (Скакательный отросток ). В дополнение к реакциям, описанным выше, многие другие более специализированные реакции производят фенолы:
- перегруппировка эфиров Перестановка фри
- перестановка N-фенилгидроксиламины в Перегруппировка Бамбергера
- деалкилирование фенольных эфиры
- сокращение хиноны
- замена ароматического амина на гидроксильную группу водой и бисульфидом натрия в Реакция Бюхерера
- термическое разложение арила диазоний соли, соли превращаются в фенол[6]
- окислением арилсиланов - ароматической разновидностью Окисление Флеминга-Тамао [7]
Классификация

Есть разные классификация схемы.[8]:2 Обычно используемая схема основана на количестве атомов углерода и была разработана Джеффри Харборн и Симмондс в 1964 году и опубликовали в 1980 году:[8]:2[9]
| Фенол | исходное соединение, используемое в качестве дезинфицирующее средство и для химический синтез |
| Бисфенол А | и другие бисфенолы, полученные из кетонов и фенола / крезола |
| BHT | (бутилированный гидрокситолуол) - жирорастворимый антиоксидант и пищевая добавка |
| 4-нонилфенол | продукт распада моющие средства и ноноксинол-9 |
| Ортофенил фенол | а фунгицид используется для восковой депиляции цитрусовые |
| Пикриновая кислота | (тринитрофенол) - взрывчатый материал |
| Фенолфталеин | индикатор pH |
| Ксиленол | используется в антисептических и дезинфицирующих средствах |
Лекарства и биоактивные натуральные продукты
| тирозин | одна из 20 стандартных аминокислот |
| L-ДОПА | дофамин пролекарство, используемое для лечения болезнь Паркинсона |
| пропофол | короткого действия внутривенный анестетик агент |
| витамин К гидрохинон | свертывающий агент, преобразующий |
| левотироксин (L-тироксин) | Самый продаваемый препарат для лечения дефицита гормонов щитовидной железы. |
| амоксициллин | Самый продаваемый антибиотик |
| эстрадиол | главный женский половой гормон |
Рекомендации
- ^ Hättenschwiler, Стефан; Витаусек, Питер М. (2000). «Роль полифенолов в круговороте питательных веществ наземных экосистем». Тенденции в экологии и эволюции. 15 (6): 238–243. Дои:10.1016 / S0169-5347 (00) 01861-9. PMID 10802549.
- ^ а б Fiege H; Voges H-W; Хамамото Т; Умемура S; Iwata T; Miki H; Fujita Y; Buysch H-J; Гарбе Д (2000). «Производные фенола». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a19_313.
- ^ 2,4-гексадиендиовая кислота, монометиловый эфир, (Z, Z) - Органический синтез, Сб. Vol. 8, p.490 (1993); Vol. 66, с.180 (1988). Статья
- ^ «2,5-Циклогексадиен-1,4-дион, 2,3,5-триметил». Органический синтез. 52: 83. 1972.
- ^ Карреньо, М. Кармен; Гонсалес-Лопес, Маркос; Урбано, Антонио (2006). «Окислительная деароматизация пара-алкилфенолов в пара-пероксихинолы и пара-хинолы, опосредованная оксоном как источником синглетного кислорода». Angewandte Chemie International Edition. 45 (17): 2737–2741. Дои:10.1002 / anie.200504605. PMID 16548026.
- ^ Х. Э. Унгнаде, Э. Ф. Орволл (1943). «3-Бром-4-гидрокситолуол». Органический синтез. 23: 11. Дои:10.15227 / orgsyn.023.0011.
- ^ Bracegirdle, Соня; Андерсон, Эдвард А. (2010). «Окисление арилсилана - новые пути получения гидроксилированных ароматических углеводородов». Chem. Comm. 46 (20): 3454–6. Дои:10.1039 / b924135c. PMID 20582346.
- ^ а б Уилфред Вермеррис и Ральф Николсон. Биохимия фенольных соединений Springer, 2008 г.
- ^ Харборн, Дж. Б. (1980). «Растительные фенолы». В Bell, E. A .; Чарлвуд, Б. В. (ред.). Энциклопедия физиологии растений, том 8 Вторичные растительные продукты. Берлин Гейдельберг Нью-Йорк: Springer-Verlag. С. 329–395.