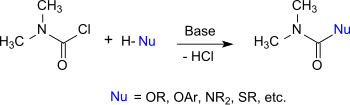Диметилкарбамоилхлорид - Википедия - Dimethylcarbamoyl chloride
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.001.099 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C3ЧАС6ClNO | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Диметилкарбамоил хлорид (DMCC) представляет собой реагент для переноса диметилкарбамоильной группы на спиртовую или фенольную гидроксильные группы образующие диметилкарбаматы, обычно имеющие фармакологические или пестицидный виды деятельности. Из-за высокого токсичность и это канцерогенный свойства, показанные в экспериментах на животных и предположительно также на людях,[1] диметилкарбамоилхлорид можно использовать только при соблюдении строгих мер безопасности.
Производство и возникновение
Производство диметилкарбамоилхлорида из фосген и диметиламин был зарегистрирован еще в 1879 году (описан как «Dimethylharnstoffchlorid» - хлорид диметилмочевины).[2]
DMCC может быть получен с высокими выходами (90%) при 275 ° C путем взаимодействия фосгена с газообразным диметиламином в проточный реактор.[3] Для подавления образования мочевины используется избыток фосгена (в соотношении 3: 1).
Реакцию также можно проводить в лабораторных масштабах с дифосгеном или трифосгеном и водным раствором диметиламина в двухфазной системе бензол –ксилол и воду в реакторе с мешалкой с едкий натр как поглотитель кислоты. Однако значительно более низкие выходы (56%) достигаются из-за чувствительности DMCC к гидролизу.[4]
Также образуется диметилкарбамоилхлорид (вместе с метилхлорид ) при реакции фосгена с триметиламин.[5]
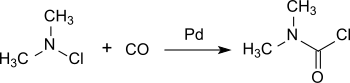
Более поздний процесс основан на использовании хлордиметиламина, который практически количественно превращается в диметилкарбамоилхлорид на палладиевый катализатор под давлением монооксид углерода в комнатная температура.[6]
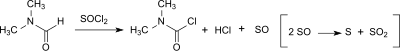
DMCC также может быть образован в небольших количествах (до 20 ppm) из диметилформамид (DMF) в Реакция Вильсмайера – Хаака[7] или когда ДМФ используется в качестве катализатора в реакции карбоновые кислоты с тионилхлорид к соответствующему ацилхлорид.[8]
Склонность к образованию DMCC зависит от реагента хлорирования (тионилхлорид > оксалилхлорид > оксихлорид фосфора ) и выше при наличии основание. Однако дикарбамоилхлорид гидролизует очень быстро до диметиламина, соляная кислота и углекислый газ (с период полураспада примерно 6 минут при 0 ° C), так что после водной обработки в продукте Вильсмайера обнаруживается менее 3 ppm дикарбамоилхлорида.[9]
Характеристики
Диметилкарбамоилхлорид - прозрачный, бесцветный, разъедающий и легковоспламеняющийся жидкость с резким запахом, проникающая сквозь слезы, быстро разлагающаяся в воде.[10] Из-за его неприятного, токсичного, мутагенный и канцерогенный характеристики,[11][12] его следует использовать с осторожностью.
DMCC ведет себя как ацилхлорид чей атом хлора можно обменять на другой нуклеофилы. Следовательно, он реагирует с спирты, фенолы и оксимы к соответствующему N,N-диметилкарбаматы, с тиолы к тиолоуретаны, с амины и гидроксиламины заменить мочевина, и с имидазолы и триазолы к карбамоилазолы.[10]
DMCC менее реакционноспособен и менее селективен к субстратам с множеством нуклеофильных центров, чем обычные ацилхлориды.
Ненасыщенный конъюгированный альдегиды Такие как кротоновый альдегид (транс-бут-2-еналь) реагируют с DMCC с образованием диенилкарбаматов, которые могут быть использованы в качестве диены в Реакции Дильса – Альдера.[13]
Щелочной металл карбоксилаты реагируют с DMCC с образованием соответствующих диметиламидов. DMCC реагирует с безводным карбонат натрия[14] или с избытком диметиламина с образованием тетраметилмочевина.[15]
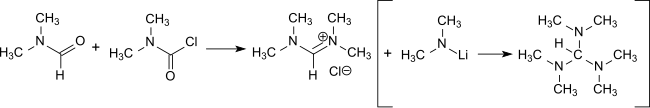
Реакция DMCC с DMF образует хлорид тетраметилформамидиния,[16] который является основным промежуточным звеном в приготовлении трис (диметиламино) метан, реагент для введения функций енамина в сочетании с активированными метиленовыми группами[17] и получение амидинов.[18]
DMCC является исходным материалом для инсектицид класс диметилкарбаматов, которые действуют как ингибиторы ацетилхолинэстераза, включая диметилан,[19] и родственные соединения изолин, пиримикарб и триазамат.
В четвертичный аммоний соединения неостигмин[20] находит применение в фармацевтике как ингибиторы ацетилхолинэстеразы. Его получают из 3- (диметиламино) фенола и DMCC и последующей кватернизации с бромистый метил или же диметилсульфат[21]
и пиридостигмин, который получается из 3-гидроксипиридин и DMCC и последующая реакция с бромистым метилом.[22]
DMCC также используется в синтезе бензодиазепин камазепам.[23]
Смотрите также
Рекомендации
- ^ Поханиш, Р. П. (2011). Справочник Ситтига по токсичным и опасным химическим веществам и канцерогенным веществам (6-е изд.). Амстердам: Эльзевир. п. 1045–1047. ISBN 978-1437778694.
- ^ Michler, W .; Эшерих, К. (1879). "Ueber mehrfach substituirte Harnstoffe" [О многозамещенных мочевинах]. Berichte der Deutschen Chemischen Gesellschaft (на немецком). 12 (1): 1162–1164. Дои:10.1002 / cber.187901201303.
- ^ Slocombe, R.J .; Харди, Э. А .; Saunders, J. H .; Дженкинс, Р. Л. (1950). «Производные фосгена. Получение изоцианатов, карбамилхлоридов и циануровой кислоты». Журнал Американского химического общества. 72 (5): 1888–1891. Дои:10.1002 / ja01161a009.
- ^ Karimipour, G .; Kowkabi, S .; Нагиха, А. (2015). «Новые аминопорфирины, содержащие заместители в виде производных мочевины: синтез, характеристика, антибактериальная и противогрибковая активность». Бразильский архив биологии и технологий. 58 (3). Дои:10.1590 / S1516-891320500024.
- ^ Babad, H .; Цайлер, А. Г. (1973). «Химия фосгена». Химические обзоры. 73 (1): 75–91. Дои:10.1021 / cr60281a005.
- ^ Saegusa, T .; Цуда, Т .; Исегава, Ю. (1971). «Образование карбамоилхлорида из хлорамина и окиси углерода». Журнал органической химии. 36 (6): 858–860. Дои:10.1021 / jo00805a033.
- ^ Stare, M .; Ланевски, К .; Вестермарк, А .; Sjögren, M .; Тиан, В. (2009). «Исследование образования и гидролиза N,N-диметилкарбамоилхлорид (DMCC) в реакциях Вильсмайера с использованием ГХ / МС в качестве аналитического метода обнаружения ». Исследования и разработки в области органических процессов. 13 (5): 857–862. Дои:10.1021 / op900018f.
- ^ Левин Д. (1997). «Возможные токсикологические проблемы, связанные с хлорированием карбоновых кислот и другими реакциями». Исследования и разработки в области органических процессов. 1 (2): 182. Дои:10.1021 / op970206t.
- ^ Королева, А. (1967). «Кинетика гидролиза ацилхлоридов в чистой воде». Канадский химический журнал. 45 (14): 1619–1629. Дои:10.1139 / v67-264.
- ^ а б Kreutzberger, C.B .; Олофсон, Р. А. (2001). «Диметилкарбамоилхлорид». Энциклопедия реагентов для органического синтеза e-EROS. Дои:10.1002 / 047084289X.rd319.
- ^ Jäger, P .; Rentzea, C. N .; Кечка, Х. (2014). «Карбаматы и карбамоилхлорид». Ullmann’s Fine Chemicals. Вайнхайм: Wiley-VCH. п. 57–58. ISBN 978-3-527-33477-3.
- ^ "Диметилкарбамоилхлорид, CAS № 79-44-7" (PDF). Отчет о канцерогенных веществах (13-е изд.). Национальная токсикологическая программа, Министерство здравоохранения и социальных служб. Получено 2016-09-25.
- ^ Де Кусати, П. Ф .; Олофсон, Р. А. (1990). «Простой синтез 1- (1,3-бутадиенил) карбонатов и карбаматов». Буквы Тетраэдра. 31 (10): 1405–1408. Дои:10.1016 / S0040-4039 (00) 88817-6.
- ^ Lawson, J. K., Jr .; Крум, Дж. А. Т. (1963). «Диметиламиды из карбоксилатов щелочных металлов и диметилкарбамоилхлорид». Журнал органической химии. 28 (1): 232–235. Дои:10.1021 / jo1036a513.
- ^ США 3597478, Weakly, M. L., "Preparation of tetramethylurea", выпущенный 1971-08-03, передан Nipak Inc.
- ^ Арнольд, З. (1959). «Получение солей тетраметилформамидиния и их винилогов». Сборник чехословацких химических сообщений. 24: 760–765. Дои:10.1135 / cccc19590760.
- ^ Meerwein, H .; Флориан, В .; Schön, N .; Стопп, Г. (1961). "Uber Säureamidacetale, Harnstoffacetale und Lactamacetale" [Об ацеталях амидов кислот, ацеталей мочевины и ацеталей лактама]. Юстус Либигс Аннален дер Хеми (на немецком). 641 (1): 1–39. Дои:10.1002 / jlac.19616410102.
- ^ Bredereck, H .; Effenberger, F .; Brendle, Th. (1966). "Synthese und Reaktionen von Trisdimethylaminomethan" [Синтез и реакции трис (диметиламино) метана] (PDF). Angewandte Chemie (на немецком). 78 (2): 147–148. Дои:10.1002 / ange.19660780212.
- ^ США 3452043, Грауэр, Т. и Урвайлер, Х. "Производство 1-N,N-диметилкарбамоил-5-метил-3-N,N-диметилкарбамоилоксипиразол », выданный 1969-06-24, переуступлен J. R. Geigy AG
- ^ Aeschlimann, J. A .; Райнерт, М. (1931). «Фармакологическое действие некоторых аналогов физостигмина». Журнал фармакологии и экспериментальной терапии. 43 (3): 413–444.
- ^ США 1905990, Aeschlimann, J. A., "Дизамещенные эфиры карбаминовой кислоты и фенолов, содержащие основную составляющую", выпущенный 1933-04-25, переуступлен Hoffmann-La Roche Inc.
- ^ США 2572579, Urban, R., "Дизамещенные эфиры карбаминовой кислоты солей 3-гидрокси-1-алкилпиридиния", выпущенный 1951-10-23, переуступленный Hoffmann-La Roche Inc.
- ^ DOS 2448015, "Verfahren zur Herstellung des 3-N,N-Диметилкарбамоил-окси-1-метил-5-фенил-7-хлор-1,3-дигидро-2ЧАС-1,4-бензодиазепин-2-он », выдан 16 сентября 1976 г., передан Siphar SA