Фостемсавир - Fostemsavir
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Рукобия |
| Другие имена | БМС-663068, ГСК3684934 |
| AHFS /Drugs.com | Монография |
| MedlinePlus | a620046 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | Устно |
| Код УВД |
|
| Легальное положение | |
| Легальное положение | |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| Панель управления CompTox (EPA) | |
| Химические и физические данные | |
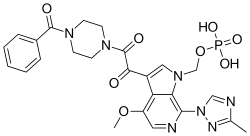
| Формула | C25ЧАС26N7О8п |
| Молярная масса | 583.498 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
Фостемсавир, продается под торговой маркой Рукобия, является антиретровирусным препаратом для взрослых, живущих с ВИЧ / СПИДом, которые попробовали несколько препаратов от ВИЧ и чья ВИЧ-инфекция не может быть успешно вылечена другими методами лечения из-за устойчивости, непереносимости или соображений безопасности.[2][1]
Самая частая побочная реакция - тошнота.[2][3][1] Тяжелые побочные реакции включали повышение ферментов печени у участников, также инфицированных вирусом гепатита B или C, и изменения в иммунной системе (синдром восстановления иммунитета).[2]
Фостемсавир - это ВИЧ ингибитор входа и пролекарство темсавира (BMS-626529).[4] Фостемсавир представляет собой ингибитор gp120-направленного прикрепления вируса иммунодефицита человека типа 1 (ВИЧ-1).[5] Он был одобрен для медицинского применения в США в июле 2020 года.[2][3][5]
Медицинское использование
Фостемсавир в сочетании с другими антиретровирусными препаратами показан для лечения ВИЧ-1-инфекции у взрослых с множественной лекарственной устойчивостью ВИЧ-1, у которых наблюдается отказ от текущего режима антиретровирусной терапии из-за устойчивости, непереносимости или безопасности.[5]
Побочные эффекты
Фостемсавир может вызвать серьезное состояние, называемое синдромом восстановления иммунитета, как и другие одобренные препараты для лечения инфекции ВИЧ-1.[3] Это состояние может возникнуть в начале лечения ВИЧ-1, когда иммунная система может окрепнуть и начать бороться с инфекциями, которые были скрыты в организме в течение длительного времени.[3] Другие серьезные побочные эффекты включают нарушения сердечного ритма из-за удлинения электрической активности сердца (удлинение интервала QT) и повышение уровня ферментов печени у пациентов с коинфекцией вируса гепатита B или C.[3]
История
Это было под разработка к ViiV Здравоохранение / GlaxoSmithKline для использования при лечении ВИЧ-инфекции. Блокируя gp120 рецептор вируса, он предотвращает начальное прикрепление вируса к CD4 + Т-клетке хозяина и проникновение в иммунную клетку хозяина; его метод действия является первым среди препаратов против ВИЧ.[6] Поскольку он нацелен на другой этап жизненного цикла вируса, он предлагает многообещающие перспективы для людей с вирусом, который стал очень устойчивым к другим вирусам. ВИЧ наркотики.[7] Поскольку gp120 является высококонсервативной областью вируса, лекарство вряд ли будет способствовать развитию устойчивости к самому себе.[8] Следователи обнаружили, что энфувиртид -устойчивый и ибализумаб Конверты с устойчивостью к ВИЧ оставались чувствительными к Фостемсавиру. Напротив, устойчивый к фостемсавиру ВИЧ оставался чувствительным ко всем ингибиторам проникновения. Кроме того, изоляты ВИЧ, которым не требуется рецептор CD4 для входа в клетки, также были чувствительны к Фостемсавиру, и вирус не избежал действия ингибитора связывания, став CD4-независимым. Предыдущие исследования in vitro показали, что Фостемсавир подавляет оба CCR5 -тропический и CXCR4 -тропный ВИЧ.[6]

Фостемсавир был одобрен для медицинского применения в США в июле 2020 года.[2][3][5]
Безопасность и эффективность фостемсавира, принимаемого перорально два раза в день, были оценены в клиническом исследовании 371 взрослого участника, интенсивно опытного в лечении, у которых сохранялся высокий уровень вируса (РНК ВИЧ) в крови, несмотря на то, что они принимали антиретровирусные препараты.[2] Двести семьдесят два участника получали лечение в основной группе исследования, а еще 99 участников получали фостемсавир в другой группе исследования.[2][3] Большинство участников лечились от ВИЧ более 15 лет (71 процент), подвергались пяти или более различным схемам лечения ВИЧ перед включением в испытание (85 процентов) и / или болели СПИДом (86 процентов).[2] Участники основной группы испытания получали либо фостемсавир, либо плацебо два раза в день в течение восьми дней в дополнение к их неудачному режиму антиретровирусной терапии.[2][3] На восьмой день у участников, получавших фостемсавир, наблюдалось значительно большее снижение уровней РНК ВИЧ в крови по сравнению с участниками, принимавшими плацебо.[2] После восьмого дня все участники получали фостемсавир с другими антиретровирусными препаратами.[2][3] После 24 недель приема фостемсавира и других антиретровирусных препаратов 53 процента участников достигли подавления РНК ВИЧ, при этом уровни ВИЧ были достаточно низкими, чтобы считаться неопределяемыми.[2] Спустя 96 недель у 60 процентов участников продолжалось подавление РНК ВИЧ.[2]
Клиническое испытание (NCT02362503) проводилось в 108 центрах в 23 странах Северной Америки, Южной Америки, Европы, Австралии, Тайваня и Южной Африки.[3]
Соединенные штаты. Управление по контролю за продуктами и лекарствами (FDA) удовлетворило заявку на Фостемсавир быстрый трек, приоритетный обзор, и революционная терапия обозначения.[2] FDA предоставило ViiV Healthcare одобрение Rukobia.[2]
Рекомендации
- ^ а б c «Рукобиафостемсавир трометамин таблетка, покрытая пленочной оболочкой пролонгированного высвобождения». DailyMed. 2 июля 2020. Получено 14 июля 2020.
- ^ а б c d е ж грамм час я j k л м п о «FDA одобряет новый метод лечения ВИЧ для пациентов с ограниченными возможностями лечения». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Пресс-релиз). 2 июля 2020. Получено 2 июля 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ а б c d е ж грамм час я j "Снимки испытаний лекарств: Рукобия". НАС. Управление по контролю за продуктами и лекарствами (FDA). 2 июля 2020. Получено 14 июля 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ Лай, Йен-Тин; Ван, Дао; О'Делл, Сиджи; Громче, Марк К .; Шен, Арне; Cheung, Crystal S. F .; Чуанг, Гво-Ю; Друз, Александр; Лин, Боб; Макки, Криша; Пэн, Дунцзюнь (3 января 2019 г.). «Решетчатая инженерия позволяет определять молекулярные особенности, позволяющие эффективно ингибировать проникновение ВИЧ-1 с помощью малых молекул». Nature Communications. 10 (1): 47. Bibcode:2019НатКо..10 ... 47л. Дои:10.1038 / s41467-018-07851-1. ISSN 2041-1723. ЧВК 6318274. PMID 30604750.
- ^ а б c d «ViiV Healthcare объявляет об одобрении FDA в США препарата Rukobia (фостемсавир), первого в своем классе лечения ВИЧ для взрослых с ограниченным количеством доступных вариантов лечения» (Пресс-релиз). ViiV Здравоохранение. 2 июля 2020. Получено 2 июля 2020 - через Business Wire.
- ^ а б Ингибитор привязанности к ВИЧ BMS-663068 хорошо выглядит в ранних исследованиях
- ^ Ингибитор прикрепления ВИЧ BMS-663068 показывает хорошую безопасность и эффективность в исследовании фазы 2b.
- ^ Активность ингибитора прикрепления ВИЧ-1 BMS-626529, активного компонента пролекарства BMS-663068, против CD4-независимых вирусов и оболочек ВИЧ-1, устойчивых к другим ингибиторам проникновения
дальнейшее чтение
- Козал М., Аберг Дж., Пиалу Дж., Кан П., Томпсон М., Молина Дж. М. и др. (Март 2020 г.). «Фостемсавир у взрослых с инфекцией ВИЧ-1 с множественной лекарственной устойчивостью». N. Engl. J. Med. 382 (13): 1232–1243. Дои:10.1056 / NEJMoa1902493. PMID 32212519.
внешняя ссылка
- «Фостемсавир». Портал информации о наркотиках. Национальная медицинская библиотека США.
- «Фостемсавир трометамин». Портал информации о наркотиках. Национальная медицинская библиотека США.
- Номер клинического исследования NCT02362503 для «Сравнение ингибиторов прикрепления у тяжелых пациентов, прошедших лечение» на ClinicalTrials.gov
