Вернакалант - Википедия - Vernakalant
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Brinavess |
| Другие имена | RSD1235 |
| Данные лицензии | |
| Маршруты администрация | Внутривенно,[1] устный[нужна цитата ] |
| Код УВД | |
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Связывание с белками | низкий |
| Метаболизм | CYP2D6, глюкуронизация |
| Устранение период полураспада | 3–5,5 часов |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.121.790 |
| Химические и физические данные | |
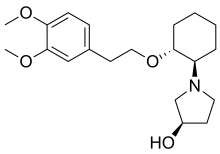
| Формула | C20ЧАС31NО4 |
| Молярная масса | 349.471 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Вернакалант (ГОСТИНИЦА; Торговое наименование ЕС Brinavess; предлагаемое торговое название в США Кинапид) - фармацевтический препарат для лечения острой конверсии мерцательная аритмия своего рода нерегулярное сердцебиение в виде внутривенная инфузия. Он был одобрен для использования в Европейском Союзе и Великобритании с 2010 года. Управление по контролю за продуктами и лекарствами отказано в утверждении в 2008 и 2019 годах.
Медицинское использование
Препарат применяется для лечения мерцательная аритмия продолжительностью до трех дней у взрослых после операции на сердце или продолжительностью до семи дней у других взрослых в виде внутривенной инфузии.[1]
Противопоказания
Вернакалант противопоказан при ряде сердечных заболеваний: тяжелых. стеноз аорты, низкое кровяное давление (систолический давление ниже 100 мм рт. ст.), сердечная недостаточность (NYHA III – IV класс), удлиненное время QT, суровый брадикардия (медленный пульс), синусовый узел дисфункция, второй или же атриовентрикулярная блокада третьей степени, и острый коронарный синдром включая острое сердечно-сосудистое заболевание. Вернакалант и другие внутривенные препараты для контроля ритма (класс I и антиаритмические препараты III класса ) нельзя давать в течение четырех часов друг после друга.[1]
Побочные эффекты
Наиболее частыми побочными эффектами в исследованиях были: дисгевзия (нарушение вкуса, у 18% пациентов), чихание (13%) и парестезия (аномальные кожные ощущения, 7%); они были временными и редко приводили к прерыванию лечения. Потенциально серьезные побочные эффекты включали низкое кровяное давление и преобразование сердечного ритма в трепетание предсердий вместо нормального синусовый ритм; флаттер в основном подействовал на вторую дозу вернакаланта.[1]
Передозировка
Имеется единичный случай, когда человеку вводили полную дозу веракаланта за половину рекомендуемого времени, что привело к тахикардия (учащенное сердцебиение) без длительных побочных эффектов.[1]
Взаимодействия
Препараты, подавляющие фермент печени CYP2D6 теоретически может увеличивать концентрацию вернакаланта в организме, поскольку последний метаболизируется этим ферментом; но было обнаружено, что это не имеет клинического значения. Хотя сам препарат является умеренным ингибитором CYP2D6, ожидается, что он не окажет существенного влияния на другие фармацевтические препараты, которые расщепляются этим ферментом, поскольку он остается в организме лишь на короткое время. Вернакалант, вероятно, взаимодействует с другими антиаритмическими препаратами, хотя официальных исследований не проводилось.[1]
Фармакология
Механизм действия
Как и другие антиаритмические препараты III класса, блоки вернакалант предсердный калиевые каналы, тем самым продлевая реполяризация. Он отличается от типичных агентов класса III тем, что блокирует определенный тип калиевого канала, кардиальный транзиторный выходящий калиевый ток, с усилением потенции по мере увеличения частоты сердечных сокращений. Это означает, что он более эффективен при высокой частоте сердечных сокращений, в то время как другие препараты класса III имеют тенденцию терять эффективность в этих условиях. Также он немного блокирует hERG калиевый канал, приводящий к длительному QT интервал. Теоретически это может увеличить риск вентрикулярная тахикардия, хотя это не кажется клинически значимым.[2]
Препарат также блокирует предсердные натриевые каналы.[2]
Фармакокинетика и фармакогеномика
После настаивания вещество быстро распределяется в организме. в сыворотка крови, 53–56% находятся в свободном обращении и не связаны белки плазмы. У людей с нормальной функцией CYP2D6 основной путь деградации - это О-деметилирование через этот фермент. В 2D6 плохие метаболизаторы, вернакалант в основном инактивируется глюкуронизация и выводится почками. Период полувыведения составляет три часа у 2D6 экстенсивных (нормальных) метаболизаторов и 5,5 часа у слабых метаболизаторов. Различия между бедными и экстенсивными метаболизаторами в отношении пиковых концентраций, AUC и период полураспада не имеют клинического значения.[1][3]
Вернакалант не угнетает ферменты. CYP3A4, CYP1A2, CYP2C9, CYP2C19, CYP2E1, ни белок-переносчик P-gp.[1]
Химия
В молекуле три асимметричный углерод атомов, учитывая 23 = 8 стереомеры. В транс известно, что стереомеры фармакологически активны, но только RRR-форма содержится в продаваемой рецептуре. В SRR-форма (с гидроксильная группа в S конфигурация) является второстепенным метаболитом, который образуется в организме человека, в основном, в плохих метаболизаторах.[3]
Настой содержит вернакалант гидрохлорид, который хорошо растворим в воде.[3]
История
Вернакалант изначально был разработан Кардиом Фарма, а внутривенный препарат был куплен для доработки Merck в апреле 2009 г.[4] В сентябре 2012 года Merck расторгла свои соглашения с Cardiome и, следовательно, вернула все права на препарат обратно компании Cardiome, которая с 2018 года известна как Корревио Фарма.
11 декабря 2007 г. Консультативный комитет США по сердечно-сосудистым и почечным препаратам Управление по контролю за продуктами и лекарствами (FDA) проголосовало за рекомендацию одобрения вернакаланта,[5] но в августе 2008 года FDA решило, что для утверждения необходима дополнительная информация.[4] В Европе препарат был одобрен под торговой маркой Brinavess 1 сентября 2010 года.[6]
Пероральный препарат прошел фазу II. клинические испытания с 2005 по 2008 гг.[7][8]
10 декабря 2019 г. Заявка на новый препарат для вернакаланта обсуждался Консультативным комитетом по сердечно-сосудистым и почечным препаратам.[9] Консультативный комитет проголосовал за то, чтобы не рекомендовать утверждение.[10]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час "Brinavess: EPAR - Информация о продукте" (PDF). Европейское агентство по лекарствам. 19 декабря 2019.
- ^ а б Мики Финнин, Вернакалант: новое средство для прекращения фибрилляции предсердий: фармакология, Medscape сегодня, получено 12 октября 2010
- ^ а б c "Brinavess: EPAR - Отчет об общественной оценке" (PDF). Европейское агентство по лекарствам. 25 июня 2010 г.
- ^ а б «Merck и Cardiome Pharma подписывают лицензионное соглашение на Vernakalant, исследуемый препарат для лечения фибрилляции предсердий». FierceBiotech. 9 апреля 2009 г.. Получено 12 октября 2010.
- ^ «Консультативный комитет FDA рекомендует одобрить Kynapid для лечения острой фибрилляции предсердий». Drugs.com. Получено 15 марта 2008.
- ^ «Brinavess (вернакалант) для инфузий, одобренный в Европейском союзе для быстрого лечения недавно развившейся фибрилляции предсердий» (Пресс-релиз). Merck & Co., Inc., 1 сентября 2010 г. Архивировано с оригинал 28 сентября 2010 г.. Получено 28 сентября 2010.
- ^ Номер клинического исследования NCT00267930 за "Исследование RSD1235-SR для профилактики фибрилляции предсердий / рецидива трепетания предсердий" в ClinicalTrials.gov
- ^ Номер клинического исследования NCT00526136 для "Vernakalant (Oral) Prevention of the Atrial Fibrillation Recurrent Fibrillation Study Post-Conversion Study" в ClinicalTrials.gov
- ^ "Объявление о заседании Консультативного комитета по сердечно-сосудистым и почечным препаратам от 10 декабря 2019 г.". FDA.gov. Получено 9 декабря 2019.
- ^ «Группа FDA опровергает кардиоверсию препарата Afib из соображений безопасности». MedPage сегодня. Получено 11 декабря 2019.
