Альдольная реакция - Aldol reaction
| Альдольная реакция | |
|---|---|
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | альдольное присоединение |
| RSC ID онтологии | RXNO: 0000016 |
В альдольная реакция является средством формирования углерод-углеродные связи в органическая химия.[1][2][3]Открыт независимо российским химиком Александр Бородин в 1869 г.[4] и французским химиком Шарль-Адольф Вюрц в 1872 г.,[5][6][7] реакция сочетает в себе два карбонил соединения (в исходных экспериментах использовались альдегиды ) с образованием нового β-гидроксикарбонильного соединения. Эти продукты известны как альдолы, от альдэгид + спиртол, структурный мотив, который можно увидеть во многих продуктах. Структурные единицы альдола встречаются во многих важных молекулах, как природных, так и синтетических.[8][9][10]Например, альдольная реакция использовалась в крупномасштабном производстве товарных химических веществ. пентаэритрит[11]и синтез лекарства от болезней сердца Липитор (аторвастатин, кальциевая соль).[12][13]
Альдольная реакция объединяет два относительно простых молекулы в более сложный. Повышенная сложность возникает из-за того, что до двух новых стереогенные центры (на α- и β-углерод альдольного аддукта, отмеченного звездочками на схеме ниже). Современная методология не только позволяет альдольным реакциям протекать с высокой скоростью. урожай но также управляя как относительным, так и абсолютная конфигурация из этих стереоцентры.[14] Эта способность выборочно синтезировать определенный стереоизомер важно, потому что разные стереоизомеры могут иметь очень разные химические и биологические свойства.
Например, стереогенные альдольные звенья особенно распространены в поликетиды, класс молекулы, обнаруженные в биологических организмах. В природе поликетиды синтезируются ферменты этот эффект итеративный Клейзеновские конденсации. Затем 1,3-дикарбонильные продукты этих реакций могут быть подвергнуты различным дериватизам с образованием широкого разнообразия интересных структур. Часто такая дериватизация включает восстановление одной из карбонильных групп с образованием альдольной субъединицы. Некоторые из этих структур обладают мощными биологическими свойствами: иммунодепрессант FK506, то противоопухолевый агент дискодермолид, или противогрибковое средство амфотерицин B, Например. Хотя когда-то считалось, что синтез многих таких соединений практически невозможен, альдольная методология позволила их эффективно использовать. синтез во многих случаях.[15]

Типичный современный альдоль реакция присоединения, показанный выше, может включать нуклеофильное присоединение из енолят кетона для альдегид. После образования альдольный продукт иногда может потерять молекулу воды сформировать α, β-ненасыщенное карбонильное соединение. Это называется альдольная конденсация. В альдольной реакции можно использовать различные нуклеофилы, включая Enols, енолирует, и энол эфиры кетонов, альдегидов и многих других карбонил соединения. В электрофильный партнером обычно является альдегид или кетон (многие варианты, такие как Реакция Манниха, существовать). Когда нуклеофил и электрофил различны, реакция называется перекрестная альдольная реакция; наоборот, когда нуклеофил и электрофил совпадают, реакция называется альдол димеризация.

Колба справа - это раствор диизопропиламид лития (LDA) в тетрагидрофуран (THF). Колба слева - раствор енолята лития терт-бутилпропионат (образуется добавлением LDA к терт-бутилпропионат). Затем в енолатную колбу можно добавить альдегид, чтобы инициировать реакцию присоединения альдола.
Обе колбы погружают в сухой лед / ацетон. охлаждающая ванна (−78 ° C), температура которого контролируется термопарой (провод слева).
Механизмы
Альдольная реакция может протекать по двум принципиально различным механизмам. Карбонильные соединения, такие как альдегиды и кетоны, можно превратить в енолы или простые енольные эфиры. Эти виды, будучи нуклеофильными на α-углерод, могут атаковать особенно реакционноспособные протонированные карбонилы, такие как протонированные альдегиды. Это «енольный механизм». Карбонильные соединения, являющиеся угольные кислоты, также могут быть депротонированы с образованием енолятов, которые намного более нуклеофильны, чем енолы или енольные эфиры, и могут напрямую атаковать электрофилы. Обычный электрофил - это альдегид, поскольку кетоны гораздо менее реакционноспособны. Это «енолятный механизм».
Если условия особенно суровые (например: NaOMe / MeOH /рефлюкс ) может происходить конденсация, но этого обычно можно избежать с помощью мягких реагентов и низких температур (например, LDA (сильное основание), THF, −78 ° C). Хотя добавление альдола обычно протекает почти до конца в необратимых условиях, изолированные альдольные аддукты чувствительны к индуцированному основанием ретроальдольному расщеплению с возвращением исходных материалов. Напротив, ретроальдольные конденсации редки, но возможны.[16]

Enol механизм
Когда используется кислотный катализатор, начальная стадия механизм реакции включает катализируемые кислотой таутомеризация карбонильного соединения на енол. Кислота также служит для активации карбонильной группы другая молекула протонированием, что делает его высоко электрофильным. Енол является нуклеофильным по α-углероду, что позволяет ему атаковать протонированное карбонильное соединение, что приводит к альдолу после депротонирование. Обычно он дегидратируется с образованием ненасыщенного карбонильного соединения. На схеме показана типичная катализируемая кислотой самоконденсация альдегида.
Кислотно-катализируемый альдольный механизм

Кислотно-катализируемая дегидратация

Механизм энолата
Если катализатор умеренная база, такая как гидроксид ион или алкоксид, альдольная реакция происходит через нуклеофильную атаку со стороны резонансно-стабилизированный енолят по карбонильной группе другой молекулы. Продукт алкоксид соль альдольного продукта. Затем образуется сам альдол, который затем может подвергаться дегидратации с образованием ненасыщенного карбонильного соединения. На схеме показан простой механизм альдольной реакции альдегида с самим собой, катализируемой основанием.
Альдольная реакция, катализируемая основанием (показано с использованием −ОСН3 в качестве базы)

Катализируемая основанием дегидратация (часто неправильно пишется как отдельный шаг, см. Реакция элиминирования E1cB )

Хотя в некоторых случаях требуется только каталитическое количество основания, более обычной процедурой является использование стехиометрический количество сильной базы, такой как LDA или же NaHMDS. В этом случае образование енолята необратимо, и альдольный продукт не образуется до тех пор, пока алкоксид металла альдольного продукта не протонируется на отдельной стадии обработки.
Модель Циммермана – Тракслера
Известны более совершенные формы механизма. В 1957 г. Говард Циммерман и Марджори Д. Тракслер предположили, что некоторые альдольные реакции имеют «шестичленные переходные состояния, имеющие конформация стула."[17] Теперь это известно как Модель Циммермана – Тракслера. E-енолаты дают начало анти продукты, в то время как Z-енолаты дают начало продукты Syn. Факторами, контролирующими селективность, являются предпочтение экваториального размещения заместителей в шестичленных переходных состояниях и предотвращение син-пентановые взаимодействия, соответственно.[18] E и Z обратитесь к цис-транс стереохимические отношения между енолятом кислорода, несущим положительный противоион, и группой наивысшего приоритета на альфа-углероде. В действительности только некоторые металлы, такие как литий, достоверно следуют модели Циммермана – Тракслера. Таким образом, в некоторых случаях стереохимический исход реакции может быть непредсказуемым.

Контроль перекрестно-альдольного реагента
Проблему «контроля» при добавлении альдола лучше всего продемонстрировать на примере. Рассмотрим результат этой гипотетической реакции:

В этой реакции два несимметричных кетона конденсируются с использованием этоксид натрия. Основность этоксида натрия такова, что он не может полностью депротонировать ни один из кетонов, но может производить небольшие количества енолята натрия обоих кетонов. Это означает, что, помимо того, что оба кетона являются потенциальными альдольными электрофилами, они также могут действовать как нуклеофилы через свой енолят натрия. Таким образом, два электрофила и два нуклеофила могут дать четыре возможных продукта:

Таким образом, если кто-то желает получить только один из перекрестных продуктов, необходимо контролировать, какой карбонил становится нуклеофильным енолом / енолятом, а какой остается в своей электрофильной карбонильной форме.
Кислотность
Самый простой контроль - если только один из реагентов имеет кислые протоны, и только эта молекула образует енолят. Например, добавление диэтилмалонат в бензальдегид будет производить только один продукт. Только малонат имеет альфа-атомы водорода, поэтому он является нуклеофильным партнером, тогда как неенолизируемый бензальдегид может быть только электрофилом:

Малонат особенно легко депротонировать, поскольку α-положение фланкируется более чем одним карбонилом. Двойная активация делает енолят более стабильным, поэтому для его образования требуется не такое сильное основание. Расширение этого эффекта может позволить контролировать, какой из двух карбонильных реагентов становится енолятом, даже если оба имеют α-атомы водорода. Если один партнер значительно более кислый, чем другой, наиболее кислый протон отщепляется основанием, и у этого карбонила образуется енолят, в то время как менее кислый карбонил не подвергается воздействию основания. Этот тип контроля работает только в том случае, если разница в кислотности достаточно велика и для реакции не используется избыток основания. Типичный субстрат для этой ситуации - это когда депротонируемое положение активируется более чем одной карбонилподобной группой. Общие примеры включают CH2 группа, фланкированная двумя карбонилами или нитрилами (см., например, Конденсация Кневенагеля и первые шаги Синтез малонового эфира ).
Порядок добавления
Одно из распространенных решений - сначала сформировать енолят одного партнера, а затем добавить другого партнера под кинетический контроль.[19] Кинетический контроль означает, что прямая реакция альдольного присоединения должна быть значительно быстрее, чем обратная ретро-альдольная реакция. Для того, чтобы этот подход был успешным, должны быть выполнены еще два условия; должно быть возможно количественно образовать енолят одного партнера, и прямая альдольная реакция должна быть значительно быстрее, чем перенос енолят от одного партнера к другому. Общие условия кинетического контроля включают образование енолята кетона с LDA при -78 ° C с последующим медленным добавлением альдегида.
Энолизирует
Формирование
Енолят можно получить, используя сильное основание («жесткие условия») или используя Кислота Льюиса и слабая база («мягкие условия»):

На этой диаграмме B: представляет собой основание, которое принимает протон. В трифлат дибутилбора фактически присоединяется к кислороду только во время реакции. Второй продукт справа (сформированный из N, N-диизопропилэтиламин ) должно быть я-Пр2EtNH+ OTf −.
За депротонирование Стереоэлектронное требование состоит в том, чтобы альфа-C-H сигма-облигация должен иметь возможность перекрываться с орбиталью pi * карбонил:
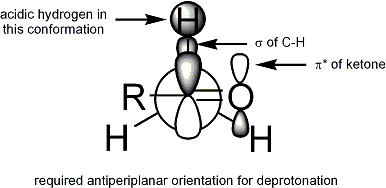
Геометрия
Обширные исследования были выполнены по образованию енолятов в различных условиях. Теперь в большинстве случаев можно создать желаемую геометрию енолята:[20]

Для кетонов большинство условий енолизации дают Z енолирует. За сложные эфиры, большинство условий енолизации дают E енолирует. Добавление HMPA известно, чтобы обратить вспять стереоселективность депротонирования.

Стереоселективное образование енолятов было рационализировано с помощью Ирландская модель,[21][22][23][24] хотя его обоснованность несколько сомнительна. В большинстве случаев неизвестно, какие промежуточные звенья являются мономерный или же олигомерный в природе; тем не менее, модель Ирландии остается полезным инструментом для понимания енолятов.
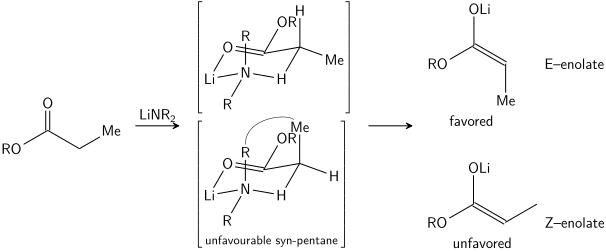
В модели Ирландии предполагается, что депротонирование протекает шестичленным или циклическим[25] мономерное переходное состояние. Более крупный из двух заместителей у электрофила (в приведенном выше случае метил больше, чем протон) занимает экваториальное расположение в предпочтительном переходном состоянии, что приводит к предпочтению енолятов E. Модель явно не работает во многих случаях; например, если смесь растворителей изменяется с THF на 23% HMPA-THF (как показано выше), геометрия енолята меняется на обратную, что несовместимо с этой моделью и его циклическим переходным состоянием.
Региохимия
Если несимметричный кетон подвергается действию основания, он может образовывать два региоизомерных енолята (игнорируя геометрию енолята). Например:

Тризамещенный енолят считается кинетический енолят, в то время как тетразамещенный енолят считается термодинамическим енолятом. Альфа-водород, депротонированный с образованием кинетического енолята, менее затруднен и, следовательно, депротонируется быстрее. В общем, тетразамещенные олефины более стабильны, чем тризамещенные олефины, из-за гиперконъюгативной стабилизации. На соотношение енолятных региоизомеров сильно влияет выбор основания. Для приведенного выше примера кинетический контроль может быть установлен с помощью LDA при -78 ° C, что дает селективность кинетики: термодинамический енолят 99: 1, в то время как термодинамический контроль может быть установлен с помощью трифенилметиллитий в комнатная температура, что дает избирательность 10:90.
В общем, кинетическим енолатам благоприятствуют низкие температуры, условия, которые дают относительно ионную связь металл-кислород, и быстрое депротонирование с использованием небольшого избытка сильного, стерически затрудненного основания. Большое основание депротонирует только более доступный водород, а низкие температуры и избыток основания помогают избежать уравновешивания с более стабильным альтернативным енолятом после начального образования енолята. Термодинамическим енолятам способствуют более длительное время уравновешивания при более высоких температурах, условия, которые обеспечивают относительно ковалентную связь металл-кислород, и использование небольшого субстехиометрического количества сильного основания. При использовании недостаточного количества основания для депротонирования всех молекул карбонила еноляты и карбонилы могут обмениваться протонами друг с другом и уравновешиваться со своим более стабильным изомером. Использование различных металлов и растворителей может обеспечить контроль над степенью ионности связи металл-кислород.
Стереоселективность
Альдольная реакция особенно полезна, поскольку в одной реакции образуются два новых стереогенных центра. Были проведены обширные исследования, чтобы понять механизм реакции и улучшить селективность, наблюдаемую во многих различных условиях. В син/анти Условные обозначения обычно используются для обозначения относительной стереохимии α- и β-углерода.
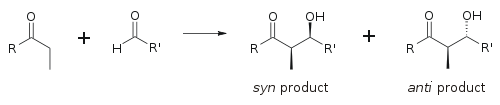
Это соглашение применяется, когда к альдегидам добавляются нуклеофилы пропионата (или более высокого порядка). В р группа кетона и Р' группы альдегида выровнены по схеме «зигзаг» в плоскости бумаги (или экрана), и расположение сформированных стереоцентров считается син или же анти, в зависимости от того, находятся ли они на одной или на противоположных сторонах основной цепи.
В более старых документах используется эритро / трео номенклатура, знакомая по химии сахаридов.
Enolate геометрия
Существенной разницы между уровнем стереоиндукция наблюдается с E и Z енолирует. Каждая геометрия алкена приводит в первую очередь к одной определенной относительной стереохимии в продукте, E давая анти и Z давая син:[20]


Ион металла
Катион металла енолята может играть большую роль в определении уровня стереоселективности в альдольной реакции. Бор часто используется[26][27] потому что это длина облигаций значительно короче, чем у металлов, таких как литий, алюминий, или же магний.

Например, связи бор – углерод и бор – кислород составляют 1,4–1,5 Å и 1,5–1,6 Å соответственно, тогда как типичные связи металл-углерод и металл-кислород имеют длину 1,9–2,2 и 2,0–2,2 Å соответственно. Использование бора вместо металла «сужает» переходное состояние и дает большую стереоселективность в реакции.[28] Таким образом, приведенная выше реакция дает синоним: анти соотношение 80:20 при использовании енолята лития по сравнению с 97: 3 при использовании енолята бибутилбора.
Альфа-стереоцентр на енолате
Альдольная реакция может демонстрировать «стереоконтроль на основе субстрата», при котором существующие хиральность на любой реагент влияет на стереохимический исход реакции. Это было тщательно изучено, и во многих случаях можно предсказать чувство асимметричная индукция, если не абсолютный уровень диастереоселективность. Если енолят содержит стереоцентр в альфа-положении может быть реализован отличный стереоконтроль.
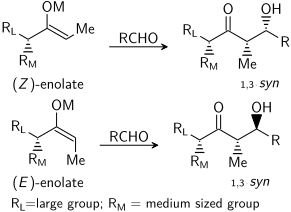
В случае енолята E доминирующим элементом управления является аллильный 1,3-штамм тогда как в случае енолята Z доминирующим элементом управления является предотвращение 1,3-диаксиальных взаимодействий. Общая модель представлена ниже:

Для наглядности стереоцентр на енолате был эпимеризованный; в действительности, атака была бы направлена на противоположную диастереофасаду альдегида. В обоих случаях предпочтение отдается диастереомеру 1,3-син. Есть много примеров такого стереоконтроля:[29]

Альфа-стереоцентр на электрофиле
Когда енолаты атакуют альдегиды с помощью альфа-стереоцентра, также возможен отличный стереоконтроль. Общее наблюдение таково: E енолирует выставку Фелкин диастерический отбор, а Z енолаты проявляют селективность против Фелкина. Общая модель[30][31] представлен ниже:

С Z енолаты должны реагировать через переходное состояние который содержит дестабилизирующее синпентановое взаимодействие или антифелкинский ротамер, Z-енолаты в этом случае проявляют более низкие уровни диастереоселективности. Некоторые примеры представлены ниже:[32][33]

Единая модель стереоиндукции
Если и енолят, и альдегид содержат ранее существовавшую хиральность, то результат «двойной стереодифференцирующей» альдольной реакции можно предсказать с использованием объединенной стереохимической модели, которая учитывает енолятное смещение лица, геометрию енолята и альдегидное смещение лица.[34] Ниже приведены несколько примеров применения этой модели:[33]

Химия оксазолидинона Эванса
Современные органические синтезы теперь требуют синтеза соединений в энантиочистка форма. Поскольку реакция присоединения альдола создает два новых стереоцентра, может получиться до четырех стереоизомеров.
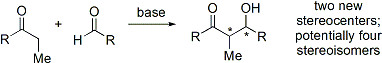
Многие методы, которые контролируют как относительную стереохимию (т. Е. Син или анти, как обсуждалось выше), так и абсолютную стереохимия (т.е. р или же S) были разработаны.
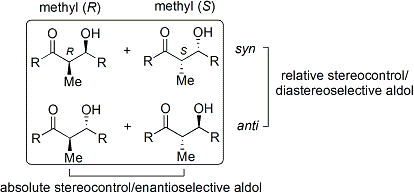
Широко используется метод Эванса. ацил оксазолидинон метод.[35][36] Разработан в конце 1970-х и 1980-х гг. Дэвид А. Эванс и коллег, метод работает, временно создавая хиральный енолят, добавляя хиральный вспомогательный. Ранее существовавшая хиральность от вспомогательного вещества затем переносится на альдольный аддукт путем проведения диастереоселективной альдольной реакции. При последующем удалении вспомогательного вещества обнаруживается желаемый стереоизомер альдола.
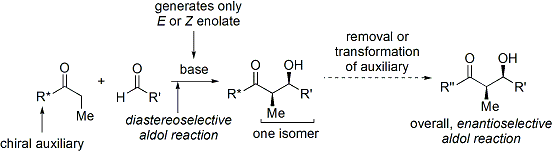
В случае метода Эванса добавляемый киральный вспомогательный элемент представляет собой оксазолидинон, и полученное карбонильное соединение представляет собой имид. Ряд оксазолидинонов в настоящее время легко доступен в обеих энантиомерных формах. Они могут стоить примерно 10–20 долларов за грамм, что делает их относительно дорогими. Однако энантиочистые оксазолидиноны получают в 2 стадии синтеза из сравнительно недорогих аминокислот, что означает, что крупномасштабные синтезы можно сделать более экономичными за счет собственного приготовления. Обычно это включает опосредованное борогидридом восстановление кислоты. часть с последующей конденсацией / циклизацией полученного аминоспирта с простым карбонатным эфиром, таким как диэтилкарбонат.

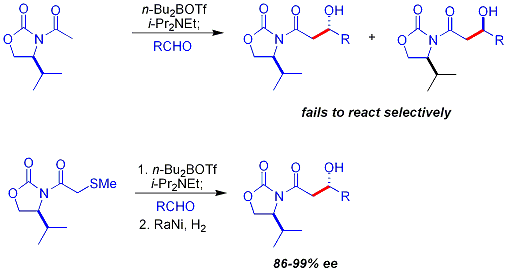
В ацилирование оксазолидинона является удобной процедурой и неофициально называется «загрузка выполнена». Z-енолаты, приводящие к син-альдольным аддуктам, могут быть надежно образованы с помощью бора-опосредованной мягкой енолизации:[37]

Часто сингл диастереомер может быть получен одним кристаллизация альдольного аддукта. Однако с помощью метода Эванса нельзя надежно получить антиальдольные аддукты. Несмотря на стоимость и ограничение давать только син аддуктов, высокая надежность, простота использования и универсальность метода делают его предпочтительным во многих ситуациях. Для расщепления вспомогательного средства доступно множество методов:[38]

После конструирования имида могут быть выполнены как син-, так и антиселективные реакции альдольного присоединения, что позволяет собрать три из четырех возможных стереомассивов: син-селективный:[39] и антиселективные:[40]

В син-селективных реакциях оба метода енолизации дают Z enolate, как и ожидалось; однако стереохимический результат реакции контролируется метилстереоцентром, а не хиральностью оксазолидинона.[нужна цитата ] Описанные методы позволяют стереоселективную сборку поликетиды, класс натуральных продуктов, которые часто содержат альдол-ретрон.
Внутримолекулярная реакция

Внутримолекулярная альдольная реакция - это реакция конденсации двух альдегид группы или кетон группы в одной молекуле. Пяти- или шестичленный α, β-ненасыщенный кетон или альдегиды образуются как продукты. Эта реакция является важным подходом к образованию углерод-углеродных связей в органических молекулах, содержащих кольцевые системы. Например, при сильных основных условиях (например, едкий натр ), гексан-2,5-дион (соединение A на Фигуре 1) может циклизоваться посредством внутримолекулярной альдольной реакции с образованием 3-метилциклопент-2-ен-1-она (соединение B).
Механизм внутримолекулярной альдольной реакции включает образование ключевого энолировать промежуточное соединение с последующим внутримолекулярным нуклеофильное присоединение процесс. Во-первых, гидроксид отводит α-водород от концевого углерода с образованием енолята. Далее нуклеофильная атака енолята на другой кетогруппе образует новую углерод-углеродную связь (красная) между атомами углерода 2 и 6. Наконец, обычно в условиях нагревания, отщепление молекулы воды дает циклизованный α, β-ненасыщенный кетон.

Внутримолекулярные альдольные реакции широко используются для полного синтеза различных природных продуктов, особенно алкалоиды и стероиды. Примером является применение внутримолекулярной альдольной реакции на стадии замыкания кольца для полного синтеза (+) -Вортманнин Шигехиса и др.[41] (Фигура 2).
Современные вариации и методы
Недавний[когда? ] методология теперь позволяет проводить гораздо более широкий спектр альдольных реакций, часто с каталитическим количеством хиральный лиганд. Когда в реакциях используются небольшие количества энантиомерно чистых лигандов для индукции образования энантиомерно чистых продуктов, реакции обычно называют «каталитическими, асимметричными»; например, много разных каталитических, асимметричный альдольные реакции теперь доступны.
Ацетат-альдольные реакции
Ключевым ограничением хирального вспомогательного подхода, описанного ранее, является неспособность N-ацетил имиды реагировать избирательно. Ранний подход заключался в использовании временного тиоэфир группа:[38][42]
Альдольная реакция Мукаяма
В Альдольная реакция Мукаяма[43] это нуклеофильное присоединение из силиловые эфиры енола в альдегиды, катализируемые Кислота Льюиса Такие как трифторид бора (в качестве эфират трифторида бора ) или же тетрахлорид титана.[44][45] Альдольная реакция Мукаямы не соответствует модели Циммермана-Тракслера. Каррейра описал особенно полезную асимметричную методологию с силилкетенацеталями, примечательную своими высокими уровнями энантиоселективности и широким спектром субстратов.[46]
Метод работает на неразветвленный алифатические альдегиды, которые часто бедны электрофилы для каталитических асимметричных процессов. Это может быть связано с плохой электронной и стерической дифференциацией их энантиофас.

Аналогичный винилогичный Альдольный процесс Мукаяма также может быть каталитическим и асимметричным. Пример, показанный ниже, работает эффективно для ароматических (но не алифатических) альдегидов, и предполагается, что этот механизм включает хиральный диенолят, связанный с металлом.[47][48]

Crimmins тиазолидинтион альдол
Более свежий[когда? ] версия вспомогательного оборудования Эванса - это Crimmins тиазолидинтион.[49][50]В дает, диастереоселективность, и энантиоселективности реакции, как правило, высоки, хотя и не так высоки, как в сопоставимых случаях Эванса. Однако, в отличие от вспомогательного вещества Эванса, тиазолдинтион может выполнять реакции ацетат-альдола (см. Crimmins, Org. Lett. 2007, 9 (1), 149–152) и может производить «синус Эванса» или «синус не Эванса». аддуктов, просто варьируя количество (-) - спартеин. Считается, что реакция протекает через шестичленный, связанный с титаном переходные состояния, аналогично предложенным переходным состояниям для вспомогательного Эванса. ПРИМЕЧАНИЕ: в структуре спартеина, показанной ниже, отсутствует атом N.

Органокатализ
Более свежий[когда? ] развитие - это использование хиральных вторичных амин катализаторы. Эти вторичные амины образуют переходные енамины при воздействии кетонов, которые могут реагировать энантиоселективно[51] с подходящими альдегидными электрофилами. Амин реагирует с карбонилом с образованием енамина, енамин действует как енолоподобный нуклеофил, а затем амин выделяется из всего продукта - амин сам является катализатором. Этот метод енаминного катализа является разновидностью органокатализ, поскольку катализатор полностью основан на небольшой органической молекуле. В отличном примере пролин эффективно катализирует циклизацию трикетона:
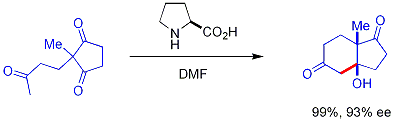
Эта реакция известна как Реакция Хаджоса-Пэрриша[52][53] (также известная как реакция Хайоса-Пэрриша-Эдера-Зауэра-Вихерта, ссылаясь на недавний отчет Шеринга о реакции в более жестких условиях).[54] В условиях Хаджоса-Пэрриша необходимо только каталитическое количество пролина (3 мол.%). Опасности возникновения ахиральной фоновой реакции нет, поскольку промежуточные енаминовые промежуточные соединения гораздо более нуклеофильны, чем их исходные кетонные енолы. Эта стратегия предлагает простой способ создания энантиоселективности в реакциях без использования переходных металлов, которые могут иметь недостатки, связанные с токсичностью или дороговизной.
Катализируемые пролином альдольные реакции не проявляют каких-либо нелинейных эффектов (энантиоселективность продуктов прямо пропорциональна энантиочистоте катализатора). В сочетании с изотопная маркировка доказательства и вычислительные исследования предлагаемые механизм реакции для катализируемых пролином альдольных реакций выглядит следующим образом:[55]

Эта стратегия позволяет осуществить сложную кросс-альдольную реакцию между двумя альдегидами. В общем, кросс-альдольные реакции между альдегидами обычно сложны, потому что они могут полимеризовать легко или неселективно реагировать, давая статистическую смесь продуктов. Первый пример показан ниже:[56]
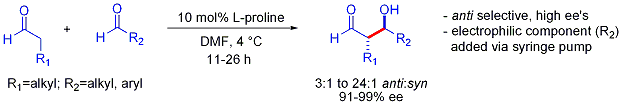
В отличие от предпочтения син-аддуктов, которое обычно наблюдается при добавках альдолов на основе енолятов, эти альдольные добавки с органокатализацией являются антиселективными. Во многих случаях органокаталитические условия достаточно мягкие, чтобы избежать полимеризации. Однако селективность требует медленного добавления желаемого электрофильного партнера, контролируемого шприцевым насосом, поскольку оба реагирующих партнера обычно имеют енолизуемые протоны. Если один альдегид не имеет енолизируемых протонов или альфа- или бета-разветвлений, может быть достигнут дополнительный контроль.
Элегантная демонстрация силы асимметричных органокаталитических альдольных реакций была раскрыта Макмилланом и его коллегами в 2004 г. в их синтезе дифференциально защищенных углеводы. В то время как традиционные синтетические методы обеспечивают синтез гексозы с использованием вариантов итеративного защита-снятие защиты Стратегии, требующие 8–14 шагов, органокатализ может получить доступ ко многим из тех же субстратов, используя эффективный двухэтапный протокол, включающий катализируемую пролином димеризацию альфа-оксиальдегидов с последующей тандемной циклизацией альдола Мукаямы.

Альдольная димеризация альфа-оксиальдегидов требует, чтобы альдольный аддукт, сам по себе альдегид, был инертен по отношению к дальнейшим альдольным реакциям.[57]Более ранние исследования показали, что альдегиды, несущие альфа-алкилокси или альфа-силилокси заместители подходили для этой реакции, а альдегиды, несущие Электроноакцепторные группы Такие как ацетокси были безреактивными. Защищенный эритроза затем продукт может быть преобразован в четыре возможных сахара путем добавления альдола Мукаяма с последующим лактол формирование. Это требует соответствующего диастереоконтроля добавления альдола Мукаяма и продукта. силилоксикарбениевый ион предпочтительно циклизоваться, а не подвергаться дальнейшей альдольной реакции. В конце концов, глюкоза, манноза, и аллозе были синтезированы:

«Прямые» альдольные добавки
При обычном присоединении альдола карбонильное соединение депротонируется с образованием енолята. Енолят добавляют к альдегиду или кетону, который образует алкоксид, который затем протонируется при переработке. В принципе, более совершенный метод позволил бы избежать необходимости в многоступенчатой последовательности в пользу «прямой» реакции, которая может быть проведена за одну стадию процесса. Одна из идей состоит в том, чтобы получить енолят с использованием металлического катализатор который высвобождается после механизма добавления альдола. Общая проблема заключается в том, что при добавлении образуется алкоксид, который является гораздо более основным, чем исходные материалы. Этот продукт прочно связывается с металлом, предотвращая его реакцию с дополнительными карбонильными реагентами.
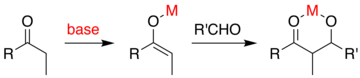
Один из подходов, продемонстрированный Эвансом, заключается в силилировании альдольного аддукта.[58][59] Кремниевый реагент, такой как TMSCl добавляется в реакцию, которая заменяет металл на алкоксид, позволяя оборот металлического катализатора. Сведение к минимуму количества стадий реакции и количества используемых реакционноспособных химикатов приводит к экономичной и промышленно полезной реакции.
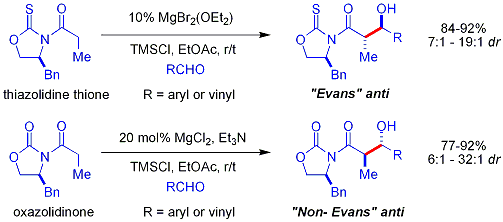
Более свежий[когда? ] биомиметик подход Шаира использует бета-тиокетокислоты как нуклеофил.[60] Кетокислота часть является декарбоксилированный на месте. Процесс похож на способ малонил-КоА используется Поликетидсинтазы. В хиральный лиганд это случай бисоксазолин. Ароматические и разветвленные алифатические альдегиды обычно являются плохими субстратами.
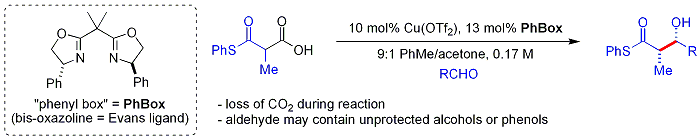
Биологические альдольные реакции
Примеры альдольных реакций в биохимии включают расщепление фруктозо-1,6-бисфосфат в дигидроксиацетон и глицеральдегид-3-фосфат на четвертом этапе гликолиз, который является примером обратной («ретро») альдольной реакции, катализируемой ферментом альдолаза А (также известная как фруктозо-1,6-бисфосфатальдолаза).
в глиоксилатный цикл растений и некоторых прокариот, изоцитратлиаза производит глиоксилат и сукцинат из изоцитрат. После депротонирования группы ОН изоцитратлиаза расщепляет изоцитрат на четырехуглеродный сукцинат и двухуглеродный глиоксилат в результате реакции альдольного расщепления. Механически это расщепление очень похоже на реакцию гликолиза альдолазой А.
Смотрите также
Рекомендации
- ^ Уэйд, Л. Г. (2005). Органическая химия (6-е изд.). Река Аппер Сэдл, Нью-Джерси: Prentice Hall. С. 1056–66. ISBN 978-0-13-236731-8.
- ^ Smith, M. B .; Марч, J. (2001). Продвинутая органическая химия (5-е изд.). Нью-Йорк: Wiley Interscience. С. 1218–23. ISBN 978-0-471-58589-3.
- ^ Mahrwald, R. (2004). Современные альдольные реакции, тома 1 и 2. Вайнхайм, Германия: Wiley-VCH Verlag GmbH & Co. KGaA. стр.1218–23. ISBN 978-3-527-30714-2.
- ^ Видеть:
- Бородин сообщил о сгущении пентанал (Валерианальдегид) с гептанальный (Oenanthaldehyd) в: von Richter, V. (1869) "В. фон Рихтер, из Санкт-Петербурга 17 октября 1869 г." (В. фон Рихтер [доклад] из Петербурга 17 октября 1869 г.), Berichte der deutschen chemischen Gesellschaft (на немецком), 2 : 552-553.
- Английская версия отчета Рихтера: (Staff) (10 декабря 1869 г.) "Химические заметки из зарубежных источников: Berichte der Deutschen Chemischen Gesellschaft zu Berlin, № 16, 1869 г .: альдегид валерианы и альдегид энанта - М. Бородин", Химические новости и журнал промышленной науки, 20 : 286.
- Гарнер, Сьюзан Эми (2007) «Опосредованные водородом образования углерод-углеродных связей: применительно к восстановительным альдольным реакциям и реакциям Манниха», доктор философии. диссертация, Техасский университет (Остин), стр.4 и 51.
- Бородин, А. (1873) "Ueber einen neuen Abkömmling des Valerals" (О новом производном альдегида валерианы), Berichte der deutschen chemischen Gesellschaft (на немецком), 6 : 982–985.
- ^ Вюрц, К.А. (1872). "Sur un aldéhyde-alcool" [Об альдегидном спирте]. Bulletin de la Société Chimique de Paris. 2-я серия (на французском языке). 17: 436–442.
- ^ Вюрц, К.А. (1872). "Ueber einen Aldehyd-Alkohol" [Об альдегидном спирте]. Journal für Praktische Chemie (на немецком). 5 (1): 457–464. Дои:10.1002 / prac.18720050148.
- ^ Вюрц, К.А. (1872). "Sur un aldéhyde-alcool" [Об альдегидном спирте]. Comptes rendus de l'Académie des Sciences (На французском). 74: 1361.
- ^ Хиткок, К. Х. (1991). «Альдольная реакция: кислотный и основной катализ». В Трост, Б.М.; Флеминг, И. (ред.). Комплексный органический синтез. 2. Elsevier Science. С. 133–179. Дои:10.1016 / B978-0-08-052349-1.00027-5. ISBN 978-0-08-052349-1.
- ^ Мукайяма Т. (1982). Направленная реакция на альдол. Орг. Реагировать. 28. С. 203–331. Дои:10.1002 / 0471264180.or028.03. ISBN 978-0471264187.
- ^ Патерсон И. (1988). «Новая методология асимметричных альдолов с использованием енолатов бора». Chem. Ind. 12: 390–394.
- ^ Местрес Р. (2004). «Зеленый взгляд на альдольную реакцию». Зеленая химия. 6 (12): 583–603. Дои:10.1039 / b409143b.
- ^ М. Браун; Р. Девант (1984). «(R) и (S) -2-ацетокси-1,1,2-трифенилэтанол - эффективные синтетические эквиваленты хирального енолята ацетата». Буквы Тетраэдра. 25 (44): 5031–4. Дои:10.1016 / S0040-4039 (01) 91110-4.
- ^ Джи Джек Ли; и другие. (2004). Современный синтез наркотиков. Wiley-Interscience. С. 118–. ISBN 978-0-471-21480-9.
- ^ Wulff W. D .; Андерссон Б. А. (1994). «Стереоселективные реакции альдольного присоединения карбеновых комплексов Фишера посредством электронной настройки металлического центра для енолятной реакционной способности». Неорганика Chimica Acta. 220 (1–2): 215–231. Дои:10.1016/0020-1693(94)03874-0.
- ^ Schetter, B .; Mahrwald, R. (2006). «Современные альдольные методы полного синтеза поликетидов». Энгью. Chem. Int. Эд. 45 (45): 7506–7525. Дои:10.1002 / anie.200602780. PMID 17103481.
- ^ Guthrie, J.P .; Купер, К.Дж .; Cossar, J .; Dawson, B.A .; Тейлор, К.Ф. (1984). «Ретроальдольная реакция коричного альдегида». Может. J. Chem. 62 (8): 1441–1445. Дои:10.1139 / v84-243.
- ^ Zimmerman, H.E .; Трэкслер, М. Д. (1957). "Стереохимия реакций Иванова и Реформатского. I". Журнал Американского химического общества. 79 (8): 1920–1923. Дои:10.1021 / ja01565a041.
- ^ Хиткок, К. Х.; Buse, C.T .; Kleschnick, W.A .; Пиррунг, М. С .; Sohn, J. E .; Лампе, Дж. (1980). «Ациклический стереоселектив. 7. Стереоселективный синтез 2-алкил-3-гидроксикарбонильных соединений альдольной конденсацией». Журнал органической химии. 45 (6): 1066–1081. Дои:10.1021 / jo01294a030.
- ^ Бал, Б .; Buse, C.T .; Smith, K .; Хиткок, К. Х., (2SR, 3RS) -2,4-диметил-3-гидроксипентановая кислота В архиве 2011-06-06 на Wayback Machine, Орг. Synth., Сб. Vol. 7, стр.185 (1990); Vol. 63, стр.89 (1985).
- ^ а б Браун, Х.; Dhar, R.K .; Бакши, Р. К .; Pandiarajan, P.K .; Сингарам Б. (1989). «Главный эффект уходящей группы в хлоридах и трифлатах диалкилбора в контроле стереоспецифического превращения кетонов в E- или Z-енол боринаты». Журнал Американского химического общества. 111 (9): 3441–3442. Дои:10.1021 / ja00191a058.
- ^ Ирландия, R.E .; Уиллард, А. К. (1975). «Стереоселективная генерация енолятов сложных эфиров». Буквы Тетраэдра. 16 (46): 3975–3978. Дои:10.1016 / S0040-4039 (00) 91213-9.
- ^ Нарула А.С. (1981). «Анализ взаимодействия диастереомерных переходных состояний для кинетического депротонирования ациклических карбонильных производных с диизопропиламидом лития». Буквы Тетраэдра. 22 (41): 4119–4122. Дои:10.1016 / S0040-4039 (01) 82081-5.
- ^ Ирландия, RE; Wipf, P; Армстронг, JD (1991). «Стереохимический контроль перегруппировки Клайзена сложного эфира енолята. 1. Стереоселективность образования силилкетенацеталь». Журнал органической химии. 56 (2): 650–657. Дои:10.1021 / jo00002a030.
- ^ Се, L; Изенбергер, КМ; Held, G; Даль, Л. М. (октябрь 1997 г.). «Высокостереоселективное образование кинетических енолатов: стерические и электронные эффекты». Журнал органической химии. 62 (21): 7516–7519. Дои:10.1021 / jo971260a. PMID 11671880.
- ^ Направленный синтез альдолов - образование E-енолята и Z-енолята
- ^ Cowden, C.J .; Патерсон, И. Орг. Реагировать. 1997, 51, 1.
- ^ Cowden, C.J .; Патерсон, И. (2004). Асимметричные альдольные реакции с использованием енолатов бора. Органические реакции. С. 1–200. Дои:10.1002 / 0471264180.or051.01. ISBN 978-0471264187.
- ^ Эванс, Д.А.; Nelson J. V .; Vogel E .; Табер Т. Р. (1981). «Стереоселективная альдольная конденсация через еноляты бора». Журнал Американского химического общества. 103 (11): 3099–3111. Дои:10.1021 / ja00401a031.
- ^ Эванс, Д.А.; Rieger D. L .; Билодо М. Т .; Урпи Ф. (1991). «Стереоселективные альдольные реакции енолятов хлортитана. Эффективный метод сборки синтонов, связанных с полипропионатом». Журнал Американского химического общества. 113 (3): 1047–1049. Дои:10.1021 / ja00003a051.
- ^ Эванс Д. А. и другие. Вершина. Стереохим. 1982, 13, 1–115. (Рассмотрение)
- ^ Руш В. Р. (1991). «Относительно диастереофациальной селективности альдольных реакций альфа-метилхиральных альдегидов и енолятов пропионата лития и бора». Журнал органической химии. 56 (13): 4151–4157. Дои:10.1021 / jo00013a015.
- ^ Masamune S .; Ellingboe J. W .; Чой В. (1982). «Алдольная стратегия: координация катиона лития с алкоксизаместителем». Журнал Американского химического общества. 104 (20): 1047–1049. Дои:10.1021 / ja00384a062.
- ^ а б Эванс, Д.А.; Дарт М. Дж .; Даффи Дж. Л .; Ригер Д. Л. (1995). «Двойные стереодифференцирующие альдольные реакции. Документация« частично согласованных »конструкций альдольных связей в сборке полипропионатных систем». Журнал Американского химического общества. 117 (35): 9073–9074. Дои:10.1021 / ja00140a027.
- ^ Masamune S .; Чой В .; Petersen J. S .; Сита Л. Р. (1985). «Двойной асимметричный синтез и новая стратегия стереохимического контроля в органическом синтезе». Энгью. Chem. Int. Эд. Англ. 24: 1–30. Дои:10.1002 / anie.198500013.
- ^ Эванс Д. А. Aldrichimica Acta 1982, 15, 23. (Обзор)
- ^ Gage J. R .; Эванс Д. А., Диастереоселективная конденсация альдолов с использованием вспомогательного хирального оксазолидинона: (2S *, 3S *) - 3-гидрокси-3-фенил-2-метилпропановая кислота В архиве 2012-09-29 в Wayback Machine, Органический синтез, Сб. Vol. 8, стр. 339 (1993); Vol. 68, стр.83 (1990).
- ^ Эванс, Д.А.; Bartroli J .; Ши Т. Л. (1981). «Энантиоселективная альдольная конденсация. 2. Эритроселективная хиральная альдольная конденсация через еноляты бора». Журнал Американского химического общества. 103 (8): 2127–2129. Дои:10.1021 / ja00398a058.
- ^ а б Эванс, Д.А.; Бендер С.Л .; Моррис Дж. (1988). «Полный синтез полиэфирного антибиотика Х-206». Журнал Американского химического общества. 110 (8): 2506–2526. Дои:10.1021 / ja00216a026.
- ^ Эванс, Д.А.; Clark J.S .; Меттерних Р .; Шеппард Г.С. (1990). «Диастереоселективные альдольные реакции с использованием енолятов, производных β-кетоимида. Универсальный подход к сборке полипропионатных систем». Журнал Американского химического общества. 112 (2): 866–868. Дои:10.1021 / ja00158a056.
- ^ Эванс, Д.А.; Ng, H.P .; Clark, J.S .; Ригер, Д.Л. (1992). «Диастереоселективные антиальдольные реакции хиральных этилкетонов. Энантиоселективные процессы синтеза полипропионатных природных продуктов». Тетраэдр. 48 (11): 2127–2142. Дои:10.1016 / S0040-4020 (01) 88879-7.
- ^ Shigehisa, H .; Mizutani, T .; Tosaki, S. Y .; Ohshima, T .; Шибасаки, М., Тетраэдр 2005, 61, 5057-5065.
- ^ В этой реакции нуклеофилом является енолят бора, полученный в результате реакции с трифлат дибутилбора (nBu2BOTf), база N, N-диизопропилэтиламин. Тиоэфир удаляется на этапе 2 путем Никель Ренея / водород снижение
- ^ С. Б. Дженнифер Кан; Кеннет К.-Х. Ng; Ян Патерсон (2013). «Влияние альдольной реакции Мукаяма на общий синтез». Angewandte Chemie International Edition. 52 (35): 9097–9108. Дои:10.1002 / anie.201303914. PMID 23893491.
- ^ Теруаки Мукаяма; Казуо Банно; Коичи Нарасака (1974). «Реакции эфиров силиленола с карбонильными соединениями, активированными тетрахлоридом титана». Журнал Американского химического общества. 96 (24): 7503–7509. Дои:10.1021 / ja00831a019.
- ^ 3-гидрокси-3-метил-1-фенил-1-бутанон по реакции перекрестных альдолов Теруаки Мукаяма и Коичи Нарасака Органический синтез, Сб. Vol. 8, стр.323 (1993); Vol. 65, стр.6 (1987)
- ^ Carreira E.M .; Певица Р.А .; Ли У.С. (1994). «Каталитические, энантиоселективные альдольные добавки с метилом и этилацетатом. О-силил енолаты - хира; тридентатный хелат в качестве лиганда титана (IV) » (PDF). Журнал Американского химического общества. 116 (19): 8837–8. Дои:10.1021 / ja00098a065.
- ^ Kruger J .; Каррейра Э.М. (1998). «Видимое каталитическое образование хиральных енолятов металлов: энантиоселективные диенолятные добавки к альдегидам, опосредованные фторидными комплексами Cu (II) с центром Tol-BINAP». Журнал Американского химического общества. 120 (4): 837–8. Дои:10.1021 / ja973331t.
- ^ Pagenkopf B.L .; Kruger J .; Стоянович А .; Каррейра Э.М. (1998). «Механистические взгляды на медь-катализируемые асимметричные альдольные реакции: химические и спектроскопические доказательства металлоенолятного промежуточного соединения». Энгью. Chem. Int. Эд. 37 (22): 3124–6. Дои:10.1002 / (SICI) 1521-3773 (19981204) 37:22 <3124 :: AID-ANIE3124> 3.0.CO; 2-1.
- ^ Кримминс М. Т .; King B.W .; Табет А. Э. (1997). «Асимметричные альдольные добавки с титановыми енолятами ацилоксазолидинтионов: зависимость селективности от аминного основания и стехиометрии кислоты Льюиса». Журнал Американского химического общества. 119 (33): 7883–7884. Дои:10.1021 / ja9716721.
- ^ Кримминс М. Т .; Чаудхари К. (2000). «Титановые еноляты хиральных вспомогательных веществ тиазолидинтиона: универсальные инструменты для асимметричных альдольных добавок». Органические буквы. 2 (6): 775–777. Дои:10.1021 / ol9913901. PMID 10754681.
- ^ Carreira, E.M .; Fettes, A .; Мартл, К. (2006). Каталитические энантиоселективные реакции присоединения альдолов. Орг. Реагировать. 67. С. 1–216. Дои:10.1002 / 0471264180.or067.01. ISBN 978-0471264187.
- ^ Z. G. Hajos, D. R. Parrish, патент Германии DE 2102623 1971
- ^ Hajos, Zoltan G .; Пэрриш, Дэвид Р. (1974). «Асимметричный синтез бициклических интермедиатов химии природных продуктов». Журнал органической химии. 39 (12): 1615–1621. Дои:10.1021 / jo00925a003.
- ^ Эдер, Ульрих; Зауэр, Герхард; Вихерт, Рудольф (1971). "Новый тип асимметричной циклизации оптически активных стероидных частичных структур CD". Angewandte Chemie International Edition на английском языке. 10 (7): 1615–1621. Дои:10.1002 / anie.197104961.
- ^ Список, Бенджамин (2006). «Инь и янь асимметричного аминокатализа». Химические коммуникации (8): 819–824. Дои:10.1039 / b514296m. PMID 16479280.
- ^ Нортрап, Алан Б .; Макмиллан Дэвид В. К. (2002). «Первая прямая и энантиоселективная кросс-альдольная реакция альдегидов» (PDF). Журнал Американского химического общества. 124 (24): 6798–6799. Дои:10.1021 / ja0262378. PMID 12059180.
- ^ Northrup A. B .; Mangion I.K .; Hettche F .; Макмиллан Д. В. К. (2004). «Энантиоселективные органокаталитические прямые альдольные реакции -оксальдегидов: первая стадия двухстадийного синтеза углеводов». Angewandte Chemie International Edition на английском языке. 43 (16): 2152–2154. Дои:10.1002 / anie.200453716. PMID 15083470.
- ^ Эванс, Д.А.; Tedrow, J. S .; Shaw, J. T .; Дауни, К. У. (2002). «Катализируемые диастереоселективным галогенидом магния антиалдольные реакции хиральных N-ацилоксазолидинонов». Журнал Американского химического общества. 124 (3): 392–393. Дои:10.1021 / ja0119548. PMID 11792206.
- ^ Эванс, Дэвид А.; Дауни, К. Уэйд; Шоу, Джаред Т .; Тедроу, Джейсон С. (2002). "Катализируемые галогенидом магния антиалдольные реакции хиральных N-ацилтиазолидинтионов". Органические буквы. 4 (7): 1127–1130. Дои:10.1021 / ol025553o. PMID 11922799.
- ^ Magdziak, D .; Lalic, G .; Lee, H.M .; Fortner, K. C .; Aloise, A.D .; Шаир, М. Д. (2005). «Каталитические энантиоселективные реакции тиоэфирных альдолов, которые совместимы с протонными функциональными группами». Журнал Американского химического общества. 127 (20): 7284–7285. Дои:10.1021 / ja051759j. PMID 15898756.
внешняя ссылка
- Chem 206, 215 Lecture Notes (2003, 2006). к Д. А. Эванс, А. Г. Майерс, и другие., Гарвардский университет (стр. 345, 936)
